左旋聚乳酸对单核细胞来源巨噬细胞M1/M2极化的影响及姜黄素的干预作用*
陈冬萍, 肖建民, 董志会, 曾素芬, 张素贞
暨南大学附属东莞医院、东莞市滨海湾中心医院 1中心实验室, 2心血管内科(广东东莞 523900)
左旋聚乳酸(poly-L-lactic acid,PLLA)由于其较好的机械性能和生物相容性,广泛用于临床各个领域包括冠脉支架、骨科支架等[1],但还存在植入部位慢性炎症等问题,并影响临床使用效果。其生物相容性与炎症反应密切相关。巨噬细胞作为慢性炎症反应中最具代表性的炎症细胞,根据不同微环境产生不同功能的经典活化(classically activated)的M1型和替换活化(alternatively activated)的M2型亚群。姜黄素是姜科植物姜黄根茎的主要成分,通过多种作用机制发挥抗炎、抗氧化等多种功能[2]调节巨噬细胞的极化。生物可降解材料在体内降解过程中,持续的炎症反应可相应增加移植失败风险。因此对PLLA引起巨噬细胞M1/M2极化的研究有助了解生物可吸收材料如何影响免疫反应[3]。我们的前期研究表明,PLLA支架对猪冠脉内皮层有一定炎症反应,PLLA对人主动脉内皮细胞有炎症和功能损失的影响并且姜黄素有缓解功能[4],但姜黄素对低分子PLLA颗粒诱导的巨噬细胞的极化的影响尚不明确。为了探讨PLLA对机体的炎症反应和姜黄素的抗炎功能,2018年7月至2020年3月,我们将通过细胞实验,研究PLLA预降解产物对巨噬细胞M1亚型细胞因子和M2亚型细胞因子表达的影响,并研究姜黄素对PLLA引起的巨噬细胞极化的调节作用。
1 材料与方法
1.1 材料及仪器 主要试剂包括有端羟基左旋聚乳酸(PLLA)(Mw 0.7万,购自济南岱罡生物工程有限公司,#DG-LOH030)、人单核细胞白血病单核细胞(THP-1)(中乔新舟,#ZQ0086)、细胞培养基(RPMI 1640)(Gibco,#11875085)、胎牛血清(Scien Cell,#0500)、青霉素-链霉素双抗(Gibco,#15140122)、佛波酯(PMA)(上海MCE,#HY-1879)、姜黄素(上海MCE,#HY-N0005)、CCK-8试剂盒(日本,同仁)、乳酸脱氢酶试剂盒(南京建成生物工程研究所,#A019-2)、白细胞介素(IL)-6、肿瘤坏死因子-α(TNF-α)和IL-10的酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA试剂盒,MEIMIAN公司)、总RNA提取试剂(Trizol试剂盒,上海生工,#B511311)、 PrimeScriptTMRT reagent Kit with gDNA Eraser反转录试剂盒(TaKaRa,#RR047A)、SYBR qPCR Mix试剂盒(广州四和,#SH3005)等。主要仪器包括有:电子天平(赛多利斯,BSA223S)、二氧化碳细胞培养箱(Thermo Scientific,150i),超级洁净台(苏州净化,SW-CJ-1F),高速冷冻离心机(EPPENDORF,5804R),酶标仪(Thermo Scientific,MULTISKAN FC),荧光PCR仪(上海宏石,SLAN-96P)。
1.2 实验方法
1.2.1 材料和试剂准备 (1)PLLA:在超级洁净台中以紫外线照射方式消毒后,5 g PLLA粉末用50 mL 1640完全培养基制成悬液,浓度为100 mg/mL。(2)PMA:1 mg PMA溶解于0.5 mL DMSO中,并轻轻摇匀使其溶解浓度为2 mg/mL的佛波醇酯;(3)姜黄素:10 mg姜黄素溶解于2.715 mL DMSO溶解,得到10 mmol/L浓度,再用培养基10倍稀释得1 mmol/L浓度姜黄素,1 mL分装,-80℃冰箱保存;(4)细胞培养基:取440 mL RPMI 1640、50 mL 56℃灭活30 min的胎牛血清、5 mL 谷氨酰胺、5 mL青霉素-链霉素配制成含10%胎牛血清的1640细胞培养基,谷氨酰胺浓度为1%,青霉素-链霉素的浓度为100 U/mL。
1.2.2 THP-1细胞培养 将THP-1细胞用灭菌的滴管轻轻吹打混匀,将细胞悬液吸到灭菌的离心管中,低速离心1 000 r/min离心5 min,去除上清液,底部细胞加入含10%胎牛血清的细胞培养液轻轻吹打使细胞重悬,转移到细胞培养瓶中,旋松瓶盖,放入37℃ 5%CO2培养箱培养,24~48 h以1∶1传代。
1.2.3 巨噬细胞诱导 调整THP-1单核细胞细胞密度为2×105·mL-1,加入含100 ng/mL PMA的培养基中,加到24孔板于CO2培养箱培养48 h。然后弃上清,用无菌D-Hanks液洗涤3次再加入无血清RPMI 1640 540 μL,放入培养箱继续培养12 h,用于下一步实验。
1.2.4 巨噬细胞鉴定 倒置相差显微镜下观察细胞状态,确认悬浮的THP-1单核细胞已经诱导为贴壁的巨噬细胞。
1.2.5 细胞毒性试验 调整THP-1细胞密度为5×104·mL-1,加入在96孔板中(每孔100 μL,培养基含100 ng/mL PMA),于37℃,5%CO2细胞培养箱中孵育。48 h后换新鲜无PMA的培养基再培养24 h,更换不同浓度的PLLA(0、10、20、30、40、50、100 mg/mL)、姜黄素(5、10、20、30、40 μmol/L),每个浓度做5个复孔。再经过24 h培养后,更换新鲜培养基,每孔再加入10 μL CCK8溶液。细胞培养箱中孵育3 h后,用酶标仪检测450 nm下吸光度。细胞毒性试验后获取PLLA和姜黄素作用于巨噬细胞的最佳浓度,用于后续实验。
1.2.6 ELISA检测炎症因子IL-6、TNF-α和 IL-10表达水平的检测 实验分为4个组(对照组、PLLA组、PLLA+姜黄素组、姜黄素组)进行,每组3个复孔。各组分别孵育24 h后,收集各组细胞上清液采用酶联免疫法,严格按照说明书操作步骤检测IL-6、TNF-α和IL-10的释放水平。
1.2.7 RT-qPCR检测炎症因子IL-6、TNF-α和IL-10转录水平的检测 分组方法同1.2.6所述。按照试剂盒说明书步骤,进行总RNA提取、逆转录为cDNA和real-time PCR。引物Primer Premier 5设计,由广州捷瑞生物公司合成。见表1。荧光定量结果采用2-ΔΔCt法进行分析。

2 结果
2.1 THP1细胞经PMA诱导为巨噬细胞 在光学显微镜下可见,THP1细胞由悬浮细胞经PMA刺激72 h后成为贴壁的巨噬细胞。见图1。

表1 IL-6、TNF-α和IL-10的引物序列
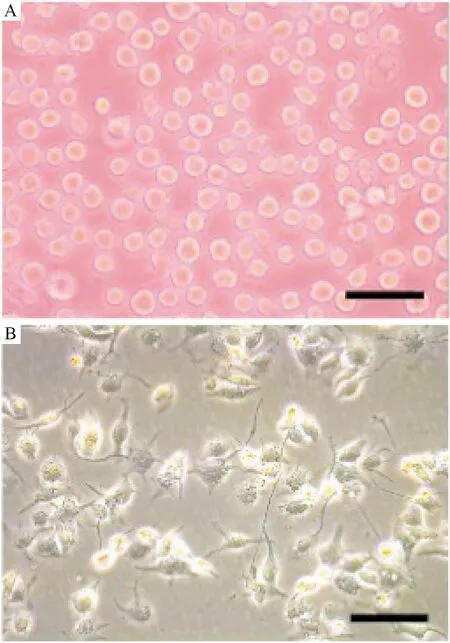
注:A:PMA诱导前,THP-1单核细胞为悬浮生长,因不易对焦而稍模糊。细胞呈圆形,形态均匀、细胞外缘折光度强;B:经PMA诱导后,THP-1转化为贴壁生长的巨噬细胞,细胞呈梭型或多边形,多伪足。黑色线段示意50 μm标尺
图1 THP-1细胞经PMA诱导的巨噬细胞光镜下形态学改变
2.2 PLLA、姜黄素对巨噬细胞的毒性测验结果 PLLA浓度在0~100 mg/mL范围内、姜黄素浓度在0~20 μmol/L范围内,细胞活力均是对照组的70%以上。其中10 mg/mL的PLLA和20 μmol/L姜黄素的细胞活性最强。见表2和图2。
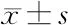

药物浓度细胞存活率(对照组的%)PLLA10 mg92.163±5.36620 mg87.730±6.72330 mg86.842±4.03240 mg81.757±6.57550 mg82.329±4.536100 mg83.608±2.927姜黄素5 μmol/L98.363±4.231 10 μmol/L96.331±6.861 20 μmol/L100.925±5.93630 μmol/L70.078±7.498 40 μmol/L51.234±4.753
2.3 PLLA、姜黄素分别对巨噬细胞极化的影响
2.3.1 各组炎症因子IL-6、TNF-α和IL-10表达水平的ELISA检测 根据细胞毒性结果,选用对细胞增殖影响较小、细胞活力相对较高的10 mg/mL PLLA和20 μmol/L姜黄素浓度,对诱导后的巨噬细胞进行干预实验。巨噬细胞在培养24 h后,收集细胞上清液对IL-6、TNF-α和IL-10等炎症因子进行ELISA检测,结果显示PLLA组分泌IL-6、TNF-α、IL-10都显著高于对照组。而姜黄素组分泌的促炎因子IL-6、TNF-α炎症因子都显著低于对照组,但作为抗炎因子的IL-10显著高于对照组(P<0.01)。见表3。
2.3.2 炎症因子TNF-α、IL-10和 IL-6转录水平的检测 同样地,对各组炎症因子mRNA转录水平进行RT-qPCR检测。结果显示,PLLA单独作用时,对比正常组,TNF-α、IL-6的mRNA转录水平均明显上升,IL-10基因表达水平显著下降。姜黄素加入后,对比PLLA单独作用可见TNF-α、IL-6的mRNA转录水平均明显下降,IL-10 mRNA转录水平显著上升。见表4。
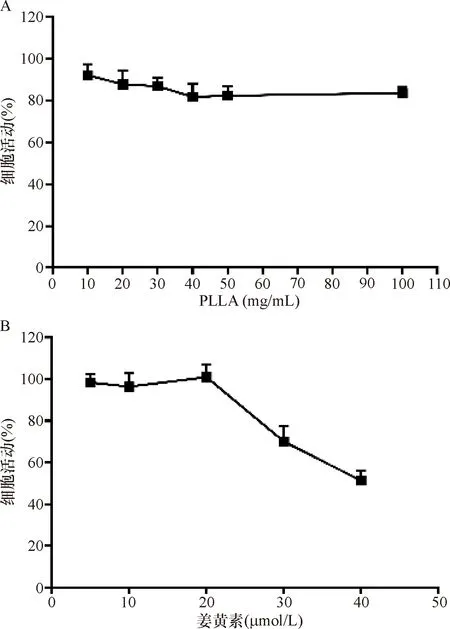
注:A:10~100 mg/mL PLLA作用下,细胞活力均大于正常组的70%,其中10 mg/mL的细胞活力最高;B:5~20 μmol/L的姜黄素作用下,细胞活力均大于正常组的70%,其中20 μmol/L组细胞活力最高。30 μmol/L及40 μmol/L姜黄素组细胞活力接近或低于70%
图2 不同浓度PLLA和姜黄素对巨噬细胞毒性检测结果


检测因子组别 n检测结果IL-6对照组43.47±0.429PLLA组44.71±0.227*PLLA+姜黄素组43.30±0.222△△姜黄素组42.75±0.152*TNF-α对照组4182.25±6.014PLLA组4213.13±3.224*PLLA+姜黄素组4134.75±12.470*△△姜黄素组4114.25±6.770*IL-10对照组428.13±1.349PLLA组471.27±2.503*PLLA+姜黄素组476.06±1.923*△姜黄素组477.49±4.369*
注:*与对照组比较P<0.01;与PLLA组比较△P<0.05,△△P<0.001


检测因子组别 n检测结果IL-6对照组40.938±0397PLLA组45.535±1.431*PLLA+姜黄素组43.886±1.739*△姜黄素组40.704±0.089TNF-α对照组41.027±0.400PLLA组42.191±0.697*PLLA+姜黄素组41.792±0.633△姜黄素组41.348±0.334IL-10对照组41.002±0.040PLLA组40.273±0.023PLLA+姜黄素组40.604±0.209*△姜黄素组41.621±0.178*
注:*与对照组比较P<0.01;△与PLLA组比较P<0.01
3 讨论
PLLA作为常用的生物可降解材料,其体内外的生物相容性得到比较充分的认可[1]。但体内的慢性炎症一直是影响长期生物相容性的主要因素,未能得到充分的研究。PLLA在人体中多是高分子聚合物,降解时间2~4年,可以采用低分子PLLA模拟植入后期的中间降解产物。本研究采用了7 000 D的PLLA颗粒作为诱导物,分子量与报道[5]相似。巨噬细胞作为慢性炎症反应中最具代表性的炎症细胞,参与PLLA降解过程。M1/M2这两个亚型的细胞表面标记和分泌细胞因子均不同,分别执行促进炎症和调理免疫的功能,对PLLA植入后的免疫状态产生影响[6]。
THP-1是人白血病单核细胞,通过PMA作用后转化为巨噬细胞。在体外培养体系中,前者呈悬浮状态,后者呈贴壁状态。本实验通过显微镜下形态学分析,对THP-1诱导得到的巨噬细胞进行了确认。此外,通过细胞毒性实验的筛选,我们选择细胞活力较高(大于对照组70%)的10 mg/mL PLLA和20 μmol/L姜黄素进行后续研究。有些研究的姜黄素浓度选择30 μmol/L[7]或50 μmol/L[8],但作用细胞不尽相同。本研究中20 μmol/L细胞活力最高,后续研究证明该浓度姜黄素已有明显的调节巨噬细胞极化作用。
众多的研究证据证明,巨噬细胞在不同环境刺激下呈现不同的免疫状态[9]。比如M1表型的巨噬细胞可分泌大量促炎因子TNF-α、IL-1、IL-6等,发挥促炎和抗原呈递作用,M2表型巨噬细胞主要分泌抗炎因子如IL-10、IL-13、IL-14等,进而发挥免疫调节、促进伤口愈合和组织修复的作用。这些不同作用的亚型可以发生极化[10]。可见巨噬细胞的不同亚型的极化是其发挥免疫调控作用的重要途径,也是其参与疾病过程的关键环节[11-14]。因此,在本研究中,选用了TNF-α、IL-6作为M1表型巨噬细胞炎症反应标记,IL-10作为M2表型巨噬细胞炎症反应标记。我们发现PLLA处理组TNF-α、IL-6要明显高于对照组,IL-10在细胞上清中表达水平虽然也升高,但RT-PCR结果显示IL-10的mRNA转录水平下降,这表明PLLA颗粒以促进巨噬细胞的炎症反应为主。这与临床上观察到PLLA降解成碎片且被大量巨噬细胞包围,局部炎症反应明显的现象吻合。Petrosyan等[15]研究PLLA细胞外基质人工组织材料对小鼠巨噬细胞M1/M2极化的影响,结果天然细胞外基质可促使巨噬细胞项修复型M2巨噬细胞表型转化,而PLLA外基质人工组织材料则诱导巨噬细胞向炎症M1表型转化,提示PLLA具有诱导炎性反应作用。
巨噬细胞极化可以被调节,这就让改良材料工艺特点、调控巨噬细胞炎症表型从而改善生物相容性的策略成为可能。有研究在材料上添加IgG-Fab段蛋白质,从而调节人类单核巨噬细胞为非炎症表型M2型,达到改良生物相容性的目的[16]。Shafiq等[17]观察到PLLA-己内酯组织材料可诱导植入局部血管管壁大量M2表型巨噬细胞浸润,提示改良过的PLLA材料可以通过募集内源性细胞以促进移植局部血管再生,促进巨噬细胞向M2表型转化,提高组织相容性。
对于PLLA炎症以及姜黄素的调节作用,国内外也有相关研究。国内桂灵升等[13]通过建立巨噬细胞株的体外炎症模型,用姜黄素及PPAR-γ的特异性抑制剂GW9662对其进行干预,观察巨噬细胞株极化状态的改变。结果提示姜黄素可能是通过激动PPAR-γ通路促使巨噬细胞向M2型极化,为进一步研究姜黄素的抗炎机制及治疗慢性低度炎症相关的代谢性疾病提供了一个新的思路。陈方圆等[12]观察姜黄素对脂多糖(LPS)和IFN-γ诱导的RAW264.7巨噬细胞(M1)极化的影响及机制,采用Real-time PCR、ELISA及Western blot方法检测IL-1β、IL-6和M2表型标志分子的表达,结果发现姜黄素通过活化PPARγ促进LPS和IFN-γ诱导的RAW264.7巨噬细胞(M1)向M2表型极化。宋志华等[18]探讨姜黄素对LPS刺激腹腔巨噬细胞(PMs)分泌炎症因子的影响,结果显示一定浓度的姜黄素可以抑制LPS刺激腹腔巨噬细胞炎症因子TNF-α、IL-6的分泌,进而减轻炎症反应的程度。Kong等[19]比较PLLA/无定形磷酸钙(ACP)生物可吸收支架与单纯PLLA支架在冠状动脉中引起的炎症反应,结果发现ACP的应用有助于减轻PLLA所致的炎症反应,也有助于提高PLLA生物可吸收支架的内皮形成和功能。国外Farajzadeh等[20]探讨封装在靶向CD44的透明质酸聚乳酸(HA-PLA)纳米颗粒(NPs)中的天然物质姜黄素调节巨噬细胞由M1促炎表型向M2抗炎表型极化的作用,发现负载姜黄素的HA-PLA NP可以改变巨噬细胞表型进而抑制LPS/IFN-γ刺激的巨噬细胞炎症,具有靶向CD44的HA-PLA NP的姜黄素制剂可能是治疗炎性疾病的有前途的途径。Su等[21]研究姜黄素对PLLA丝和圈作为可植入支架引起的炎症反应的影响。采用小鼠腹腔巨噬细胞模型,研究姜黄素PLLA复合物(C-PLLA)纤维的体外抗炎作用。结果发现姜黄素可以减少生物可吸收PLLA纤维引起的炎症反应,同时改善机械性能,从而提示姜黄素有益于PLLA的植入。在本研究中,姜黄素单独作用时,IL-6和TNF-α的表达水平显著低于空白对照组,IL-10表达高于空白对照组,这也表明姜黄素具有抗炎的作用,这与报道结果类似。姜黄素和PLLA混合组与单独的PLLA组相比,其IL-6、TNF-α浓度明显降低,IL-10明显升高,这说明姜黄素在一定程度上可以缓解PLLA颗粒引起的炎症。因此,本研究也为姜黄素作为以PLLA为材料的可降解生物工程材料表面结构改性备选药物提供一定的实验基础。但本研究是体外研究,没有进行动物体内研究。PLLA在体内降解情况与体外低分子量粉末不同,未能完全反映体内情况。
综上所述,PLLA颗粒在体外促进人THP-1源巨噬细胞向炎症亚型M1极化,姜黄素通过调节M1向M2转化而发挥抗炎作用。

