桑黄提取物改善PM2.5暴露诱导的SD大鼠氧化应激及肾损伤
李 森, 杨 焱, 黄小流, 骆小莉, 吴 迪, 李 觉
(1. 同济大学医学院,上海 200092; 2. 上海市农业科学院食用菌研究所,国家食用菌工程技术研究中心,上海 201106)
PM2.5是评估空气污染严重程度的主要指标之一[1],其沉积在肺泡中并通过肺泡毛细血管进入血流,导致慢性阻塞性肺病、肺癌及心血管疾病等风险增加。目前,国内外大量体内体外研究证实了PM2.5对呼吸系统[2]和心血管系统[3]的影响。但对PM2.5的探索已经并不局限于此,最近的研究表明,PM2.5可以很容易地通过肺泡上皮细胞,进入循环系统,最终损害心血管系统和肾脏[4]。PM2.5诱导的氧化应激被认为是其造成肾功能损害的重要机制[5],PM2.5暴露能够改变抗氧化酶如超氧化物歧化酶(superoxide dismutase, SOD)、过氧化氢酶(catalase, CAT)和谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)等表达,并降低它们的活性[6]。
桑黄在我国已有1300多年的历史,是一种珍稀的药用真菌[7],桑黄菌丝体主要由多酚类化合物组成,具有抗炎、抗氧化作用,有助于改善血液循环、缓解胃痛、抗肿瘤、抗糖尿病和肺炎[8]。目前,对有效干预PM2.5所致肾损伤的作用研究尚无明确报道。本研究利用人工气候环境暴露设备,以接近人体实际暴露途径的方式评估亚慢性暴露于PM2.5对肾功能的影响以及桑黄的干预作用。
1 材料与方法
1.1 实验动物
4周龄雄性SPF级SD大鼠,体重34~48g,购于上海杰斯捷实验动物有限公司,饲养于复旦大学公共卫生学院上海市气象与健康重点实验室,于暴露前适应性饲养1周,所有动物实验操作规范依据同济大学医学院实验动物委员会文件(TJmed-010-10)执行。
1.2 桑黄提取物
桑黄子实体及菌种由上海市农业科学院食用菌研究所提供,标本存放于上海市农业科学院食用菌研究所药用真菌研究室。本研究所使用的桑黄提取物(Inonotus Sanghuang extract, ISE)是由桑黄Z子实体醇提取物与水提取物按质量比1∶1混匀得到,在每天暴露前给予大鼠200mg/(kg·d)的ISE水悬液灌胃。
1.3 分组和暴露方案
PM2.5暴露采用由上海市气象局长三角环境气象预报预警中心研发的人工气候环境暴露仓(型号:Shanghai-MR-TAS),实验动物以自然吸入的方式实现全身暴露[9]。将30只SD大鼠随机分为3组(n=10),对照组(filtered air, FA)置于对照仓以接受过滤后的清洁空气,暴露组(concentrated ambient PM2.5, PM组)和暴露干预组(inonotus Sanghuang, ISE组)置于暴露仓以接受浓缩后的高浓度颗粒物空气。暴露期间保持室温(20~25℃)和相对湿度(40%~ 70%),进行12h∶12h的光/暗循环,提供足够的清洁饮用水和标准饲料。暴露方案连续进行12周(2018年11月—2019年1月),每周5d,每天8~10h。每周选取1d将大鼠置于代谢笼(江苏赛昂斯生物科技公司)中,收集24h尿液,计算单位时间的尿流率[10],并根据大鼠体重调整数据。暴露期间,每天记录对照仓、浓缩仓和室外环境颗粒物浓度。
1.4 样品采集
最后一次暴露后收集大鼠尿液,在4℃下以离心半径16cm,1500r/min,离心10min。取上清液于-80℃下保存。将大鼠颈椎脱臼处死后,用心脏穿刺法抽取血液,4℃下离心后取血清保存于-80℃,用于血清学检测。摘取两侧肾组织,去除筋膜后用预冷的PBS清洗,挤压去除多余的血液。纵向切取大小适中的组织置于4%的多聚甲醛中固定,脱水、包埋、切片并进行苏木精-伊红染色(H-E染色),高倍显微镜下观察各组肾脏病理变化。其余肾脏组织放入液氮速冻后转入-80℃保存,用于检测氧化应激及肾损伤指标。
1.5 肾功能参数
使用罗氏生化自动分析仪(Roche, Cobas 8000)检测大鼠的血清肌酐(serum creatinine, Scr)、血清尿素氮(blood urea nitrogen, BUN)和尿肌酐(urine creatinine, Ucr)含量,并按照以下公式估算肾小球滤过率(estimated glomerular filtration rate, eGFR)[10]:
eGFR=尿流率[μL/(min·100g)]×[尿肌酐(mg·mL-1)/血清肌酐(mg·mL-1)]。
1.6 肾损伤和氧化应激标志物的检测
使用ELISA试剂盒检测大鼠血清中胱抑素C和尿液中β2微球蛋白的含量以评估大鼠肾功能的情况,ELISA试剂盒购于上海晶抗生物工程有限公司。使用丙二醛(malonaldehyde, MDA)、总超氧化物歧化酶(superoxide dismutase, SOD)、总谷胱甘肽(total glutathione, T-GSH)检测试剂盒检测MDA、SOD及T-GSH的表达水平或活性,试剂盒均购自于上海碧云天生物技术有限公司。
1.7 统计学处理
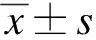
2 结 果
2.1 暴露情况
在大鼠暴露期间,对照仓中的PM2.5的浓度为8.24μg/m3(4.52~13.54μg/m3),暴露仓中平均浓度为255.71μg/m3(72.15~596.84μg/m3),室外环境中平均浓度为41.48μg/m3(19.2~83.8μg/m3),暴露仓中颗粒物的平均浓缩倍数为室外环境的6.16倍(2.91~13.69倍),见图1。
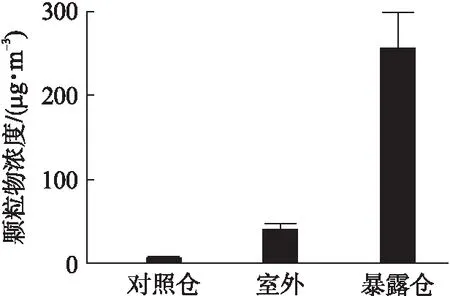
图1 暴露期间PM2.5平均浓度Fig.1 Average concentration of PM2.5 during exposureto PM2.5
2.2 暴露过程中各组大鼠尿流率的比较
从暴露的第3周开始,PM组大鼠的尿流率显著高于FA组(P<0.05),并在第8、9、11、12周出现极显著差异(P<0.01)。ISE组与PM组相比,第8、9、11、12周大鼠尿流率显著降低。与FA组相比,ISE组大鼠尿流率虽然有升高但差异无统计学意义,见表1。
表1 暴露期间各组大鼠尿流率的比较
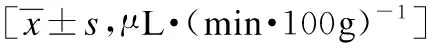
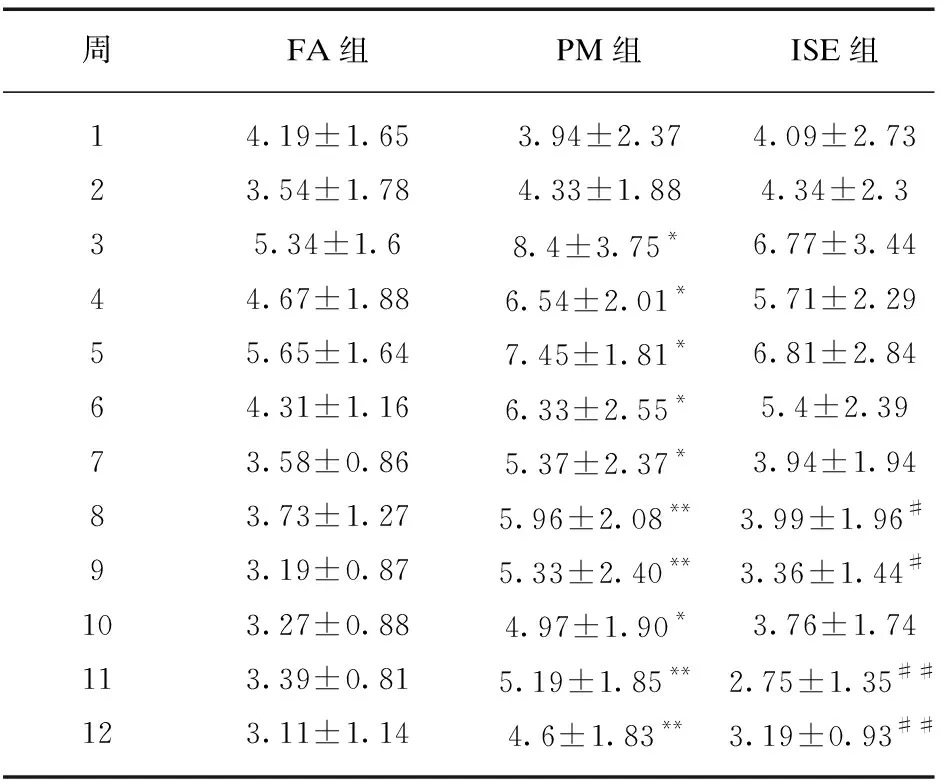
周FA组PM组ISE组14.19±1.653.94±2.374.09±2.7323.54±1.784.33±1.884.34±2.335.34±1.68.4±3.75*6.77±3.4444.67±1.886.54±2.01*5.71±2.2955.65±1.647.45±1.81*6.81±2.8464.31±1.166.33±2.55*5.4±2.3973.58±0.865.37±2.37*3.94±1.9483.73±1.275.96±2.08**3.99±1.96#93.19±0.875.33±2.40**3.36±1.44#103.27±0.884.97±1.90*3.76±1.74113.39±0.815.19±1.85**2.75±1.35##123.11±1.144.6±1.83**3.19±0.93##
与FA组相比,*P<0.05,**P<0.01;与PM组相比,#P<0.05,##P<0.01
2.3 肾功能指标和肾损伤标志物
经过12周的PM2.5暴露,PM组相对于FA组大鼠Scr(P=0.014)和BUN(P=0.011)浓度显著升高,而eGFR(P=0.003)水平明显降低;ISE组Scr和BUN(P=0.013)浓度低于PM组,而eGFR(P=0.009)水平高于PM组,其中后两者差异具有统计学意义,见表2。进一步分析肾损伤的标志物结果表明,PM组大鼠尿液中β2-MG浓度高于FA组(P=0.02),ISE组β2-MG浓度较PM组明显降(P=0.002),与FA组持平,见图2A;同时,PM组血清中Cys-C的浓度显著高于FA组(P=0.018),而ISE组Cys-C浓度较PM组降低,差异具有边际效应(P=0.051),与FA组相比无明显变化,见图2B。
2.4 大鼠肾脏组织病理学变化
各组大鼠肾脏病理切片H-E染色显示,PM组大鼠正常的肾小管结构破坏,可见肾小管空泡变性,上皮细胞水肿和轻微的管间免疫细胞浸润,但肾小球损伤较轻。ISE组较PM组大鼠肾组织损伤明显减轻,肾小管结构基本正常,肾小球细胞略有增多,见图3。
表2 暴露后大鼠肾脏和血清学参数
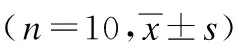

组别Scr/(mg·L-1)BUN/(mmol·L-1)eGFR/[μL·(min·100g)-1]FA23.03±3.544.22±0.70875.32±86.13PM26.91±1.48*4.97±0.65*757.45±69.30**ISE24.34±2.584.23±0.30#859.3±85.03##
与FA组相比,*P<0.05,**P<0.01;与PM组相比,#P<0.05,##P<0.01
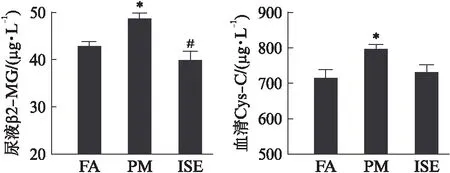
图2 暴露后各组大鼠尿液和血清中肾损伤标志物的含量Fig.2 Contents of kidney damage markers in urine and serum of rats与FA组相比,*P<0.05,与PM组相比,#P<0.05
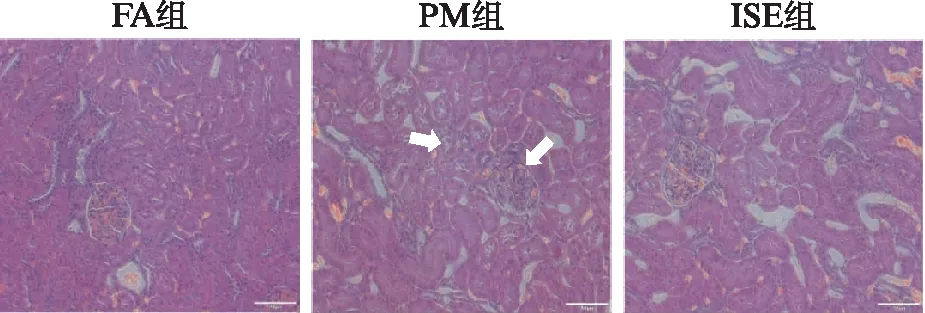
图3 各组大鼠肾脏组织病理检查结果(H-E,×200)Fig.3 The pathological results of kidney in rats(H-E,×200)
2.5 大鼠血清和肾组织中氧化应激情况
暴露12周后,PM组肾组织和血清中氧化应激标志物MDA(P=0.004,P=0.002)水平较FA组明显升高,抗氧化应激标志物SOD(P=0.003,P=0.0003)和T-GSH(P=0.001,P=0.002)水平降低。ISE组与PM组相比,肾组织和血清中MDA(P=0.016,P=0.002)水平显著降低,而T-GSH(P=0.029,P=0.038)水平显著升高。ISE组与FA组相比,只有血清中SOD(P=0.031)水平低于FA组,见图4。
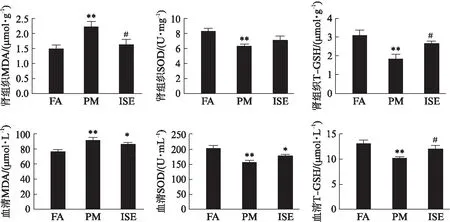
图4 暴露PM2.5后大鼠肾组织和血清中MDA、SOD和T-GSH水平Fig.4 Levels of MDA、 SOD and T-GSH in kidney tissues and serum after exposureto PM2.5与FA组相比,*P<0.05,**P<0.01,与PM组相比,#P<0.05,##P<0.01
3 讨 论
目前大多数研究主要是关注短期急性PM2.5暴露导致的肾损伤。本研究使用SD大鼠来观察亚慢性暴露于PM2.5诱导的肾脏损伤并研究ISE的干预作用。本研究使用的气候环境暴露设备,采用旋风切割和富集式浓缩的方式使颗粒物达到较理想的浓缩效果,并且最大限度保留了PM2.5浓缩前的化学特性,动物自然吸入PM2.5完成暴露,突破了滴入式染毒法的局限性,使暴露过程更接近人体真实的暴露方式[11]。
在持续12周的暴露过程中,PM组大鼠的尿流率从第3周到暴露结束均显著高于FA组,这种持续性多尿现象,一方面可能是因为PM2.5环境的直接作用,PM2.5具有吸湿特性,使气道内水分流失,从而刺激口渴和饮水,引起尿量增加;另一方面与PM2.5诱导肾小管损伤,导致浓缩功能受损有关,PM组大鼠肾组织H-E染色显示肾小管上皮细胞水肿及轻微管腔闭塞。而对于ISE组,同样是从第3周开始,其尿流率一直略高于FA组,但从第8周起显著低于PM组。我们猜测可能是ISE持续作用一段时间后,减轻了PM2.5暴露导致的肾小管损伤,逐渐提高了尿浓缩能力。在暴露后进行的尿液和血清生化检查,结果支持本研究的假设,PM2.5暴露导致肾小球功能下降,但在PM2.5暴露的同时使用ISE干预,则产生了有效的保护作用。考虑到通过测量Scr和eGFR水平对肾脏损伤情况进行评价的方法并不是十分可靠[12],本研究继续检测了肾损伤敏感的生物标志物血清Cys-C和尿液β2-MG,它们分别代表肾小球和肾小管损伤[13],结果发现PM组Cys-C和β2-MG水平均显著升高,而ISE组尿液β2-MG水平较PM组明显降低,这从分子层面说明ISE减轻了PM2.5介导的肾脏损伤。
PM2.5引起的肾损伤很大程度上可解释为氧化应激的结果[5]。PM2.5暴露后,PM组大鼠血清和肾组织中MDA水平的升高以及T-GSH和SOD活力的降低证实了氧化应激的激活。而与PM组相比,ISE组大鼠血清和肾组织中MDA水平显著降低以及T-GSH和SOD水平的升高说明ISE显著抑制了PM2.5诱导的系统性氧化应激反应。本研究中使用的ISE由多种复杂的多糖和多酚类化合物组成,其中的槲皮素、绿原酸等多酚类化合物已被证明具有良好的抗氧化、抗增殖、抗炎和抗微生物活性[14-15]。
总之,本研究结果表明,亚慢性PM2.5暴露激活了氧化应激反应,导致SD大鼠肾小管和肾小球损伤,从而引起肾功能下降。而ISE的干预抑制肾脏的氧化应激反应,减轻了PM2.5暴露诱导的肾功能损伤。初步推定ISE通过发挥其抗氧化能力具有改善PM2.5致肾损伤的保护作用,不过,此过程中ISE抑制氧化应激的作用途径和确切机制以及其发挥作用的剂量和有效成分,还需要在细胞和分子水平上进行深入研究以进一步阐明。

