幽门螺杆菌感染的C57BL/6 CD177基因敲除小鼠模型建立
杨行堂, 王芝珺, 郑佳谊, 刘占举
(1. 同济大学附属第十人民医院急诊科,上海 200072; 2. 同济大学附属第十人民医院病理科,上海 200072; 3. 同济大学附属第十人民医院消化科,上海 200072)
幽门螺杆菌(Helicobacterpylori, Hp)是一种需微需氧环境下生长的呈螺杆状、短杆杆状及不规则弯曲状等形态的革兰阴性细菌,常定植于人类及灵长目类动物的胃黏膜组织。Hp是慢性胃炎、消化性溃疡、胃癌及胃黏膜相关淋巴组织(mucosa-associated lymphoid tissue, MALT)淋巴瘤等众多消化系统疾病的重要致病因素[1-5],有关Hp致病机制的研究一直是胃肠病工作者研究的热点之一。模拟人体菌群环境构建Hp感染的动物模型为方便和深入开展有关Hp耐药机制研究,研发新药、筛选疫苗及Hp致胃炎、胃癌等疾病机制的研究不失为一个行之有效的途径。当前Hp感染动物模型造模所用动物选择以猕猴,蒙古沙鼠,BALB/c、C57BL/6小鼠,猫及猪等小型实验动物为主[6-9]。但猕猴、猪等价格昂贵,操作繁杂不便,且不易控制处理因素,对大规模及常规开展研究带来诸多不便。而小鼠由于遗传背景明晰、个体差异小、品种品系选择多、易饲养、繁殖快、花费低等优点,成为目前Hp体内感染动物模型建立所广泛选用的模型动物[9]。普通实验小鼠带菌多,污染大,干扰因素众多,建立Hp感染动物模型困难重重。无特定病原生物(specific pathogen free, SPF)动物是指动物机体内无特定的微生物和寄生虫存在及无传染病的健康动物,要求屏障饲养环境,是目前广泛使用的实验动物。采用SPF动物造模,屏障环境下,不仅利于Hp的定植,也尽可能模拟了人体的菌群状态,且花费相对较少,简便易行。中性粒细胞是固有免疫应答的重要成分,能快速迁徙到感染位点从而对感染做出迅速响应。胃内Hp感染的最初炎症反应是中性粒细胞浸润,中性粒细胞是清除Hp感染的关键细胞[10]。而CD177是白细胞抗原6超家族成员之一,CD177有2种等位基因(NB1、PRV-1)其编码的蛋白称为HNA-2a,是一种糖基化磷脂酰肌醇锚定糖蛋白,仅在中性粒细胞特异表达,CD177在应答感染的循环中性粒细胞上的表达显著上调,业已证实与严重细菌感染、红细胞增多症、炎症性肠病等疾病有关[11-13]。Toyoda等[14]还提出CD177可作为胃肿瘤中肿瘤细胞黏附和迁移的调节因子,并报道CD177表达上调并非由于中性粒细胞向胃黏膜浸润增加所致,而是由于基因表达的变化。但此前并无中性粒细特异性分化抗原CD177和Hp相关性胃炎关系的研究报道。本课题组通过人胃黏膜活检组织病理切片免疫组织化学初步研究发现中性粒细胞分化抗原CD177在人Hp相关性胃炎中表达增高,在Hp感染的人胃黏膜组织中CD177的表达显著高于非Hp感染的胃黏膜组织[15]。为了进一步探讨CD177与Hp相关性胃炎的关系,本研究拟比较不同Hp标准株感染的中性细胞CD177基因敲除小鼠和野生型小鼠的胃黏膜Hp感染、炎症分级、活动性胃炎等变化情况。本实验选取了SPF级C57BL/6 CD177基因敲除(CD177 gene knock-out, CD177 KO)小鼠试图建立该小鼠的Hp感染的动物模型。
1 材料与方法
1.1 实验动物
造模小鼠由同济大学附属第十人民医院中心实验室动物中心提供。实验动物根据中华人民共和国技术监督局GB l4922.94《实验动物微生物和寄生虫检测等级》标准,健康4~6周龄雌、雄性各半C57BL/6 CD177基因敲除(CD177 gene knock-out, CD177 KO)小鼠和C57BL/6野生型(Wild Type, WT)小鼠(SPF级)各22只,体重18~30g,饲养于同济大学附属第十人民医院中心动物实验楼的SPF动物房内,所有实验动物在相关实验操作前均饲养在动物房适应7d(光照按照6:00~18:00),自由进食和进水、控制室温在25℃左右,湿度60%,分笼喂养,每笼5~6只。所有动物实验均得到同济大学附属第十人民医院伦理委员会和上海市科学技术委员会批准。本研究遵循美国国家卫生机构发布的《实验动物保护和应用指南》(NIH publication No.85.23,1996年修订);实验动物使用和操作遵循同济大学附属第十人民医院动物实验管理委员会相应规定。
1.2 试剂与仪器
Hp悉尼菌株(Hp, Sydney Strain 1, HpSS1)(VacA+CagA-)标准株及Hp49503(VacA+、CagA+)标准株均购自上海交通大学医学院病原生物教研室。
布氏肉汤培养基购自上海市疾病预防控制中心;培养基制作用琼脂粉由英国Oxoid公司邮购;Hp 尿素酶测定试剂盒、革兰氏染色试剂盒分别购自珠海丽拓生物科技及上海恩康生物科技有限公司;二氨基联苯胺盐酸盐(DAB)由美国Sigma公司邮购。
自行设计、可通、换气的Hp简易培养罐,于中国科学院上海生命科学研究院精工厂定制。
培养Hp用混合气体(N285%、CO210%、O25%)购自上海尤嘉利液氮有限公司。高压蒸汽消毒锅购自日本SANYO电器公司。超净工作台购自苏州市永久调压器厂。
1.3 方法
1.3.1 Hp培养 取出冻存于液氮中的HpSS1及Hp49503标准菌株,在生物安全柜内经复苏、传代培养后,3~5接种环菌液于布氏肉汤血琼脂固体培养基上连续划线接种,接种的平皿即刻放入可通换混合气(N285%、CO210%、O25%),并能保持较好湿度Hp微需氧培养罐中,培养罐转置37℃恒温培养箱培养3~5d,具体参照文献[16-18]的培养方法。
1.3.2 Hp感染小鼠动物模型的制作 造模方法参照有关文献[19-23],C57BL/6野生型小鼠及CD177基因敲除小鼠各22只,雌雄各半,野生型及CD177基因敲除小鼠各自随机分成2组: 野生型小鼠Hp悉尼菌株(SS1)灌胃组(HpSS1 WT组)10只、野生型小鼠Hp49503株灌胃组(Hp49503 WT组)10只、CD177基因敲除小鼠Hp悉尼株灌胃组(HpSS1 KO组)10只、CD177基因敲除小鼠Hp49503株灌胃组(Hp49503 KO组)10只,另设WT及KO空白对照各1组,各自相应对照组小鼠每组随机各2只,共计6组。用接种环刮取培养皿上Hp菌落,经尿素酶、氧化酶实验及涂片革兰染色鉴定后,刮下Hp菌落混悬于PBS中,经分光光度计检测菌液浓度,当A660=1时,Hp菌液浓度达 1×108CFU/mL(colony-forming unites)。模型组每只小鼠灌服细菌浓度为1×108CFU/mL Hp菌液0.3mL,间隔1d,共灌服3次,正常空白对照组以0.3mL无菌PBS灌喂,所有实验组小鼠于灌喂处理前予禁食12h,禁水4h,于灌喂后继续予禁食、禁水4h。
1.3.3 动物模型的处理 末次灌喂2周后颈椎脱臼法处死小鼠,腹正中部开腹,取出全胃(包含胃窦、胃体及十二指肠等),继而沿大弯切开鼠胃,充分暴露胃黏膜后,以PBS清洗小鼠胃黏膜,然后分离出实验小鼠胃黏膜组织[21],一半用于石蜡包埋病理切片用,另一半置-80℃冰箱备用。
1.3.4 Hp的检测 (1) 快速尿素酶检测试验。取部分新鲜的小鼠胃黏膜组织剪碎后置入尿素酶测试反应孔中,5min内测试反应孔由桔黄色变为红色或紫红色鉴定为阳性。(2) Warthin-Starry银染染色。组织固定于4%甲醛,常规脱水包埋。切片厚约4~6μm,常规脱蜡至水。经蒸馏水浸洗切片1min,再重复2次后,切片置入酸性硝酸银溶液(加盖)中,水浴染色。取出切片放入现配制的Warthin-Starry染色液(加盖),置入56℃水浴染色,直至切片呈淡黄棕色时取出,切片平放在染色架上,再用预热的自来水彻底清洗。经自来水冲洗,常规脱水后,再予二甲苯透明,最后中性树胶封片。Hp菌体染色呈黑色。
两种方法均显示为阳性结果鉴定为感染Hp。
1.3.5 组织病理学检查 部分胃黏膜组织块用4%甲醛常规固定,乙醇脱水,二甲苯透明,石蜡包埋,蜡块包埋组织切片机切片,切片厚约4~6μm,经 56℃ 烤箱烤片固定2h。常规H-E染色: 组织切片经二甲苯脱蜡和梯度乙醇脱水处理晾干后,置于苏木素染液中染色3~5min,流水冲洗 5min,继而盐酸酒精30s脱色,然后水洗蓝化后伊红染色1~ 3min,水洗后再经常规脱水、透明、中性树胶封片固定。显微镜下见细胞核染成蓝色,细胞质和Hp均染成粉红色。
1.3.6 胃黏膜炎症病理组织学改变标准确定 参阅2012及2017中国慢性胃炎共识意见[24-25]。按胃黏膜层淋巴细胞、单核细胞等慢性炎性反应细胞的密集程度和浸润深度对胃炎进行分级评分。0分: 单个核细胞每高倍视野不多余5个;1分: 慢性炎症细胞较少并限于黏膜浅层,不超过黏膜层的1/3;2分: 慢性炎症细胞较密集,超过黏膜层的1/3,未超过黏膜层2/3;3分: 慢性炎症细胞密集,占据胃黏膜全层。炎症细胞计数评分应避开淋巴滤泡及其周淋巴细胞区域。
1.3.7 Hp定植判断标准[25]观察显微镜下每10个高倍视野胃黏膜黏液层、胃黏膜上皮、胃小凹上皮及腺管表面上皮的Hp定植情况,以Hp定植数量的多少进行定植计分。0分:无Hp定植;1分:偶见或小于标本黏膜全层1/3有少数Hp;2分:Hp分布超过黏膜全层1/3而未达到黏膜全层2/3或连续性、薄而稀疏散在于上皮表面;3分:Hp成堆,分布胃黏膜上皮全层。
1.4 统计学处理
实验数据以SPSS 17.0统计软件包进行分析。多组间率的比较用卡方检验。检验水准α=0.05,P<0.05表示差异有统计学意义。
2 结 果
2.1 各组小鼠胃黏膜Hp定植及组织学炎症情况染色结果
银染色显示,各造模组小鼠胃黏膜均可见Hp成功定植(图1A~D)。各造模组小鼠胃黏膜黏液层、黏膜上皮表面及胃小凹均可见黑色及棕黑色杆状、螺杆状、短杆状、逗点状及不规则弯曲状Hp定植。其中CD177 KO组小鼠中,Hp49503菌株较HpSS1菌株有更强的定植能力,小鼠胃黏膜黏液层、黏膜上皮表面及小凹和隐窝见弥漫的Hp分布(图1A、1B)。WT组小鼠中,HpSS1株Hp散在分布于小鼠胃黏膜黏液层至黏膜小凹及隐窝之间,Hp49503菌株Hp较广泛分布于小鼠胃黏膜黏液层、上皮表面、胃小凹及隐窝,见图1C、1D。WT组小鼠较KO组小鼠黏膜炎症反应强,且KO组小鼠黏膜炎症细胞以淋巴及单核样细胞为主,零星散在中性粒样细胞;而WT组中黏膜炎症细胞构成除淋巴及单核样细胞外,黏膜全层尚可见大量中性粒样细胞浸润分布。
H-E染色显示,各造模组小鼠胃黏膜上皮表面、胃小凹及黏膜隐窝全层均可见大量炎症细胞浸润;其中KO组小鼠胃黏膜炎症细胞构成以淋巴及单核细胞为主,散在零星中性粒细胞;WT组胃黏膜炎症浸润细胞构成除淋巴和单核细胞外,尚有大量中性粒细胞浸润,炎症反应更强;而各自空白对照组小鼠胃黏膜未见明显组织学炎症改变,见图2。

图1 各组小鼠胃黏膜Hp定植情况银染色Fig.1 Colonization of Hp in Gastric mucosa of mice by silver stainingA: KO小鼠HpSS1株感染,胃黏膜见较多Hp定植;B: KO小鼠Hp49503株感染,胃黏膜见大量Hp定植、堆积;C: WT小鼠HpSS1株感染,胃黏膜见散在Hp定植;D: WT小鼠Hp49503株感染,胃黏膜见大量Hp定植、堆积;银染色,×400

图2 各组小鼠胃黏膜组织学炎症情况H-E染色Fig.2 H-E staining of gastric mucosa inflammation in each groupA: Hp49503株菌KO小鼠,胃黏膜全层见大量炎症细胞浸润,以单个核细胞为主,零星散在中性粒细胞;B: Hp49503株菌WT小鼠,胃黏膜全层见大量炎症细胞浸润,除单个核细胞外黏膜全层可见大量中性粒细胞;C: HpSS1株菌KO小鼠,胃黏膜全层见大量炎症细胞浸润,以单个核细胞为主,固有层有零星中性粒细胞散在;D: HpSS1株WT小鼠,胃黏膜全层见大量单个核及中心粒细胞等急、慢性炎症细胞浸润;E: KO空白对照小鼠,胃黏膜未见明显炎症变化;F: WT空白对照小鼠,胃黏膜未见明显炎症变化;H-E,×100
2.2 各组Hp感染率比较
各组感染率构成比差异有统计学意义(P<0.01),去空白对照组后各组感染率构成比仍然有统计学差异(P<0.05),剔除对照组后,余下各组之间两两相比较,感染构成比差异均无统计学意义(P>0.05),见表1。
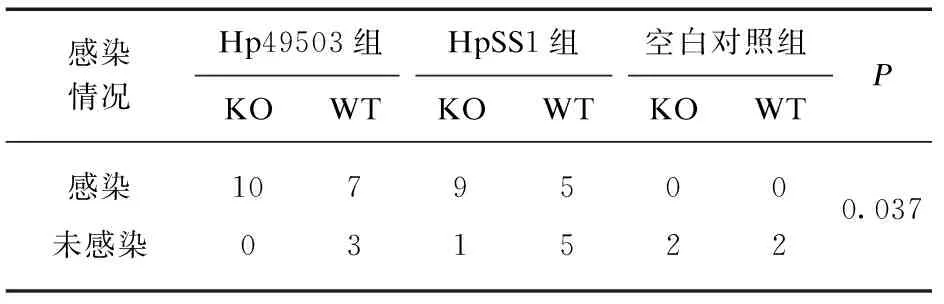
表1 Hp感染率比较Tab.1 Comparison of Hp infection rate
2.3 各组胃黏膜炎症评分比较
造模小鼠炎症分级构成比差异有统计学意义,不纳入空白对照组差异仍具有显著统计学意义(P<0.05)。组内两两相比较,HpSS1株菌造模WT及KO小鼠炎症构成比差异有统计学意义(P=0.023),WT小鼠炎症反应较KO小鼠强烈,见表2。
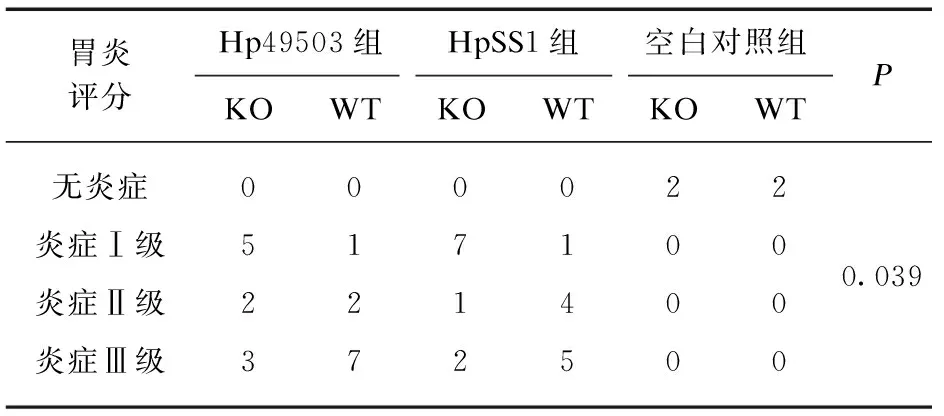
表2 胃黏膜炎症评分比较Tab.2 Comparison of gastric mucosal inflammation scores
2.4 各组活动性胃炎评分构成比较
各造模组小鼠活动性胃炎评分构成比较差异有统计学意义(P<0.01),其中WT造模组小鼠胃黏膜炎症除单个核细胞外,尚见较多中性粒细胞浸润,呈活动性炎症变化,而KO组小鼠胃黏膜炎症细胞以慢性单个核炎症细胞为主,中性粒细胞基本不可见。组内两两比较,WT小鼠中Hp49503和HpSS1处理组差异无统计学意义(P=0.587);KO组小鼠中,Hp49503和HpSS1处理组差异无统计学意义(P=0.531);余下各组相比较差异均有统计学意义(P=0.01),见表3。
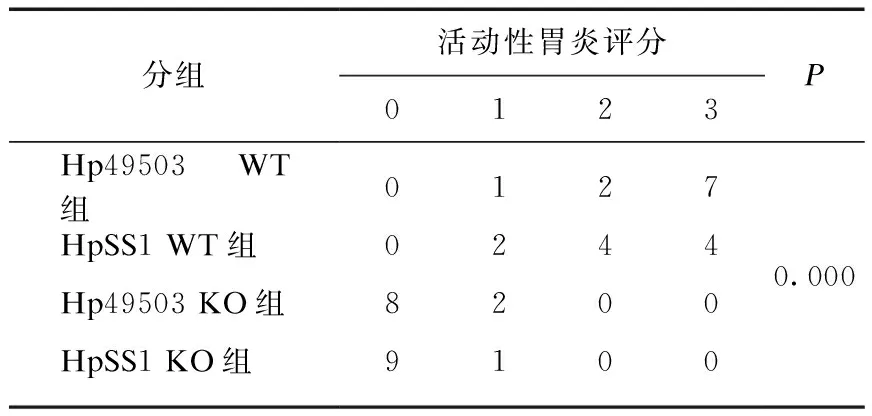
表3 活动性胃炎评分构成比较Tab.3 Comparison of scores of active gastritis
2.5 Hp定植评分
造模小鼠Hp定植构成比差异有统计学意义(P<0.05)。剔除空白对照组定植构成比仍然有统计学意义(P<0.05)。组内两两比较,Hp49503菌株在KO组小鼠的定植优于WT组小鼠,差异有显著性意义(P=0.034),余下各组两两相比较Hp定植构成差异无统计学意义(P>0.05),见表4。

表4 Hp定植评分比较Tab.4 Comparison of cloned Hp scores
3 讨 论
Hp是慢性胃炎、消化性溃疡、胃癌及胃MALT淋巴瘤等众多消化系统疾病重要致病因素[1-5],有关Hp致病机制的研究一直是消化病学研究的热点之一。Hp通常定植于人及灵长目动物的胃黏膜组织。构建Hp感染的动物模型为方便和深入开展有关Hp致病机制的研究提供了便捷。
在感染引起的固有免疫应答过程中,中性粒细胞扮演极其重要的角色。胃黏膜Hp感染的最初炎症反应是中性粒细胞浸润,中性粒细胞是清除Hp感染的关键细胞[10]。应对感染引起的免疫应答过程中中性粒细胞从血管内迁徙到感染组织,而这种迁徙是通过中性粒细胞特异表达表面受体CD177与血小板内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1, PECAM-1)的相互作用实现[26-27]。作为中性粒细胞表面特异表达抗原,CD177在应对感染的循环中性粒细胞表面的表达显著上调,已发现CD177和严重感染、红细胞增多症、炎症性肠病及胃肿瘤等疾病有关[12-14]。但尚无中性粒细胞特异表达受体CD177和Hp相关性胃炎相关性研究报道,本课题组近期研究发现中性粒细胞特异性表面受体CD177在人Hp相关性胃炎中表达增高,CD177在Hp感染的人胃黏膜组织中的表达显著高于非Hp感染的胃黏膜组织[15]。为了进一步探讨CD177与Hp相关性胃炎的关系,拟比较Hp不同标准株感染的中性细胞CD177基因敲除小鼠和野生型小鼠的胃黏膜Hp胃腔内感染定植,胃黏膜炎症细胞构成,炎症变化情况,及今后进一步深入研究Hp相关性胃炎发病机制的需要,有必要构建相应的实验动物模型。本实验选取了SPF级C57BL/6 CD177基因敲除(CD177 gene knock-out, CD177 KO)小鼠试图建立该小鼠的Hp感染的动物模型[19-23],并构建C57BL/6野生型小鼠Hp感染模型。
Lee等[19]鉴定的HpSS1菌株目前已被认为是理想的动物模型接种菌株。本研究采用HpSS1菌株及Hp49503菌株各分别对C57BL/6 CD177基因敲除小鼠和C57BL/6野生型小鼠进行灌喂造模。结果表明,HpSS1及Hp49503菌株均分别在C57BL/6 CD177基因敲除小鼠和C57BL/6野生型小鼠表现出良好的定植。其中,Hp49503菌株在C57BL/6 CD177基因敲除小鼠的定植优于C57BL/6野生型小鼠,而余下各组定植比较差异未见统计学差异,定植率相当。Hp49503菌株在C57BL/6 CD177基因敲除小鼠的定植优于C57BL/6野生型小鼠,原因可能为Hp49503菌株含CagA+基因毒力较HpSS1株强;C57BL/6 CD177基因敲除小鼠由于循环血液中CD177+中性粒细胞缺少,固有免疫应答应对感染的能力不足,免疫功能降低,对Hp的清除能力减弱,从而导致Hp在C57BL/6 CD177基因敲除小鼠较C57BL/6野生型小鼠更容易定植。各组实验组小鼠不论有无Hp定植,胃黏膜均出现一定的炎症改变,而对照组小鼠胃黏膜未出现明显胃黏膜炎症改变。少部分胃黏膜未见Hp定植的造模鼠,胃黏膜炎症的发生可能与Hp感染被清除过程继发的炎症反应等有关,这些必要时需扩大样本量以进一步明确。实验尚发现WT造模组小鼠胃黏膜炎症细胞构成除单个核细胞外,尚见较多中性粒细胞浸润,呈活动性炎症变化,而KO组小鼠胃黏膜炎症细胞以单个核慢性炎症细胞为主,中性粒细胞基本不可见。这可能与中性粒细胞CD177基因敲除后,CD177介导的中性粒细胞迁徙能力极度低下,导致循环血液中应对Hp急性感染的中性粒细胞极度匮乏有关,故黏膜炎症反应缺少急性活动性表现,表现为单个核细胞浸润的慢性炎症反应为主,而WT组小鼠在应对幽门螺杆感染时,急慢性炎症细胞均作出正常的炎症应答。提示CD177在介导中性粒细胞迁徙过程中起到重要作用,与Sachs等[26]观点一致,国内周广玺等[28]研究发现,在炎症性肠病患者外周循环和肠黏膜组织的中性粒细胞显著高于健康者,主要因为中性粒细胞膜表达CD177分子促进了中性粒细胞向外周循环和肠黏膜炎症部位的迁移。在Hp相关性胃炎中,CD177如何介导中性粒细胞参与固有免疫应答,CD177+中性粒细胞在炎症发生及免疫清除中所扮演的角色,及与其它炎症细胞、炎症介质及炎症因子的相互作用等,需要进一步去深入探究。总之,本研究成功建立了Hp感染的C57BL/6中性粒细胞CD177基因敲除小鼠模型,为接下来进一步深入探究CD177+中性粒细胞在Hp相关性胃炎发生中的作用提供了可选途径,也为其他有关Hp感染的基因敲除小鼠模型的建立提供了参考。

