姜黄素纳米乳的制备及对大鼠心肌缺血再灌注的保护作用
李 迪,李 杨,吴 迪
(1.大庆油田总医院心内科,黑龙江 大庆 163000; 2.大庆市人民医院,黑龙江 大庆 163001)
心肌缺血再灌注损伤指冠状动脉部分或完全急性阻塞后,一定时间又重新获得再通,但其组织损伤反而呈进行性加重的病理过程[1]。 一般来说,休克治疗、动脉搭桥术、溶栓疗法、经皮腔内冠脉血管成形术、心脏外科体外循环、心肺脑复苏、断肢再植和器官移植等方法可引起心肌缺血再灌注[2]。心肌缺血再灌注损伤可加重原有的损伤,引起心肌细胞的结构及功能发生不可逆性改变[3]。 因此如何预防心肌缺血再灌注损伤具有重要的临床意义。
天然化合物由于其安全有效,并且副作用小,受到全球研究学者的关注。 姜黄素(Curcumin,CUR)是姜黄根中的多酚类物质,具有降血脂、抗肿瘤、抗炎、利胆、抗氧化等作用[4-5]。 CUR 可降低胆固醇吸收和抵抗炎症,因而可降低心血管疾病的风险,具有心脏保护作用[4-5]。 但作为药物来讲,CUR脂溶性较强,但在水中很难溶解,口服吸收困难,靶细胞不易摄取,这限制了它的临床应用。 近年来,新型给药系统,如缓控释给药系统、靶向给药系统、纳米给药系统、透皮给药系统、粘附给药系统等,发展迅速并且解决了许多药物的溶解、释放以及靶向性问题。 CUR 纳米乳(CUR nanoemulsion, CURNMs)解决了CUR 水溶性问题,目前已用于抗炎、抗肿瘤及组织器官损伤保护等。 但CUR-NMs 是否对心肌缺血再灌注损伤具有保护作用还未有研究报道。 本研究通过构建CUR-NMs 药物载体,观察其对大鼠心肌缺血再灌注的保护作用和作用机制,为CUR 的临床应用提供更多的理论依据。
1 材料和方法
1.1 实验动物
健康清洁级雄性SD 大鼠40 只,体重180 ~200 g,由北京维通利华实验动物有限公司提供[SCXK(京)2016-0001],本实验获本院伦理委员会批准,批准文号:20180825。 所有动物饲养于黑龙江中医药大学屏障环境中[SYXK(黑)2018-007],每笼3 ~4 只动物,自由饮水、摄食,12 h 光照/12 h 黑暗,温度20℃~25℃,相对湿度40%~70%。,实验前动物饲养一周以适应动物房环境。 整个动物实验期间严格按实验动物3R 原则给予实验动物人道主义关怀。
1.2 主要试剂与仪器
姜黄素(批号20181221)购自大连美仑生物科技有限公司;棕榈油和吐温-80 购自国药集团化学试剂有限公司;CK、LDH、MDA 和SOD 试剂盒购自南京建成生物工程有限公司;calpain1、calpastatin、Bcl-2、caspase 3 抗体购自美国CST 公司;GAPDH 抗体购自武汉博士德公司;异氟烷购自北京华中海威公司;TUNEL 染色试剂盒(货号ATK00001)购自武汉普健生物公司。 电子天平(赛多利斯);高速剪切机(德国IKA);高压均质机(德国APV 公司);CX31倒置显微镜(日本奥林巴斯);64R 高速低温离心机(美国贝克曼公司);JEOL JEM-2100F 场发射透射电子显微镜(日本JEOL);NanoSight NS300 纳米颗粒跟踪分析仪(英国Malvern 公司);小动物心电图监测系统(美国IVORX 公司);SpectraMax 190 酶标仪(美国Molecular Devices 公司);AI600 凝胶成像仪(美国GE 公司);小动物麻醉机(购自北京众实迪创科技发展有限责任公司)。
1.3 实验方法
1.3.1 CUR 纳米乳的构建及表征
参考文献[6]制备CUR-NMs,首先将处方中的棕榈油和姜黄素溶于无水乙醇中作为油相,使其浓度为1 mg/mL,以去离子水作为连续相制备水包油型乳剂。 将油相加入到水相中12000 rpm 剪切5 min形成初乳,随后用高压均质机以15000 PSI 的压力进行均质10 min,得到包载姜黄素的CUR-NMs。 取制备的CUR-NMs,用去离子水稀释100 倍,移液枪吸取5 μL 样品溶液滴加到覆有碳支持膜的铜网上,自然条件下晾干,利用透射电子显微镜观察CURNMs 的表面形态,同时通过纳米颗粒分析仪对其粒径分布进行测定。
1.3.2 分组及给药
SD 大鼠40 只,其中30 只冠状动脉左前降支结扎30 min 再松开灌注2 h 建立心肌缺血再灌注模型。 按照随机数字表将其分为三组,每组10 只动物,分别为模型组、CUR 处理组和CUR-NMs 处理组,CUR 处理组和CUR-NMs 处理组在缺血前4 h 分别腹腔注射CUR(20 mg/kg)和CUR-NMs(20 mg/kg)预处理, 模型组以等体积溶剂预处理。 剩余10只动物只手术但不做结扎处理设为假手术组,假手术组予以等体积上述溶剂预处理。 手术时,实验动物采用小动物麻醉机给与异氟烷持续吸入麻醉,维持浓度为3%。
1.3.3 指标检测
多导生理记录仪分别于基础状态、再灌注30、60、90、120 min 时记录LVDP、+dp/dtmax 和-dp/dtmax。 生理记录仪信号采集结束后,各大鼠进行腹主动脉取血约3 mL,室温下静置至凝固,随后3000 rpm 离心10 min,取上层血清,参照肌酸激酶(CK)、乳酸脱氢酶(LDH)、丙二醛(MDA)、超氧化物歧化酶(SOD)检测试剂盒说明书检测血清CK、LDH、MDA 和SOD 水平。
1.3.4 TUNEL 染色检测大鼠心肌细胞凋亡情况
取血后迅速处死大鼠,并进行解剖,取出心脏,切取结扎部位周边组织,用生理盐水冲洗表面血液后置于4%多聚甲醛中固定,参考文献[7]将收集好的心肌组织石蜡包埋、切片、苏木素染核,将切面放入Tris-HCL(含3%BSA 和20%牛血清)中15℃~25℃浸泡,以PBS 浸泡切片两次,晾干,取50 μL TUNEL 反应混合液滴于切片上,37℃孵育1.5 h,PBS 洗3 遍,稍微晾干,于倒置显微镜下观察组织细胞凋亡情况,并拍照,随机选取5 个非重叠400 倍镜视野,计数凋亡心肌细胞数和心肌细胞总数,计算凋亡指数,心肌细胞凋亡指数=凋亡心肌细胞数/心肌细胞总数×100%。
1.3.5 蛋白印记实验检测心肌 calpain1、calpastatin、Bcl-2、caspase 3 蛋白表达变化
取各组大鼠心脏组织0.5 g,加入细胞组织裂解液液于均质仪研碎,冰上静置5 min,参考文献[8]的方法进行蛋白提取、SDS-PAGE 电泳、转膜及封闭。按需求加入calpain1 抗体(1 ∶2000)、calpastatin 抗体(1 ∶1000)、Bcl-2 抗体(1 ∶1000)、caspase 3 抗体(1 ∶800)或GAPDH 抗体(1 ∶5000)4℃温育过夜。 次日,TBST 洗膜3 次,再加入相应的抗兔IgG-HRP 二抗(1 ∶2000),室温杂交1 h,PVDF 膜以ECL 发光试剂盒进行显色,用AI600 进行成像并对蛋白印迹条带进行处理和分析。
1.4 统计学方法
应用SPSS17.0 软件进行统计学分析,数据以平均数±标准差(±s)表示。 两组间比较采用t 检验,多组间比较采用单因素方差分析,两两多重比较方法用LSD-t 检验。 P<0.05 差异有统计学意义(双尾)。
2 结果
2.1 CUR-NMs 的表征
2.2 各组大鼠血流动力学变化
与假手术组相比,模型组大鼠缺血30 min 再松开灌注2 h 后LVDP、+dp/dtmax 和-dp/dtmax 指标均明显下降(P<0.01);相较于模型组,CUR 处理组和CUR-NMs 处理组大鼠LVDP、+dp/dtmax 和-dp/dtmax均有不同程度升高(P<0.05 或P<0.01);与CUR 处理组相比,CUR-NMs 处理组LVDP、+dp/dtmax 和-dp/dtmax 升高幅度更大(P<0.01),见表1。
2.3 各组大鼠血清LDH、CK、MDA、SOD 水平比较
大鼠缺血30 min 再松开灌注2 h 后,相较于假手术组,模型组大鼠血清LDH、CK、MDA 明显升高,SOD 显著降低(P<0.01);与模型组相比,CUR 处理组和CUR-NMs 处理组LDH、CK、MDA 显著下降,SOD 明显升高(P<0.05 或P<0.01);与CUR 处理组相比,CUR-NMs 处理组LDH、CK、MDA 降低,SOD升高(P<0.05 或P<0.01),见表2。
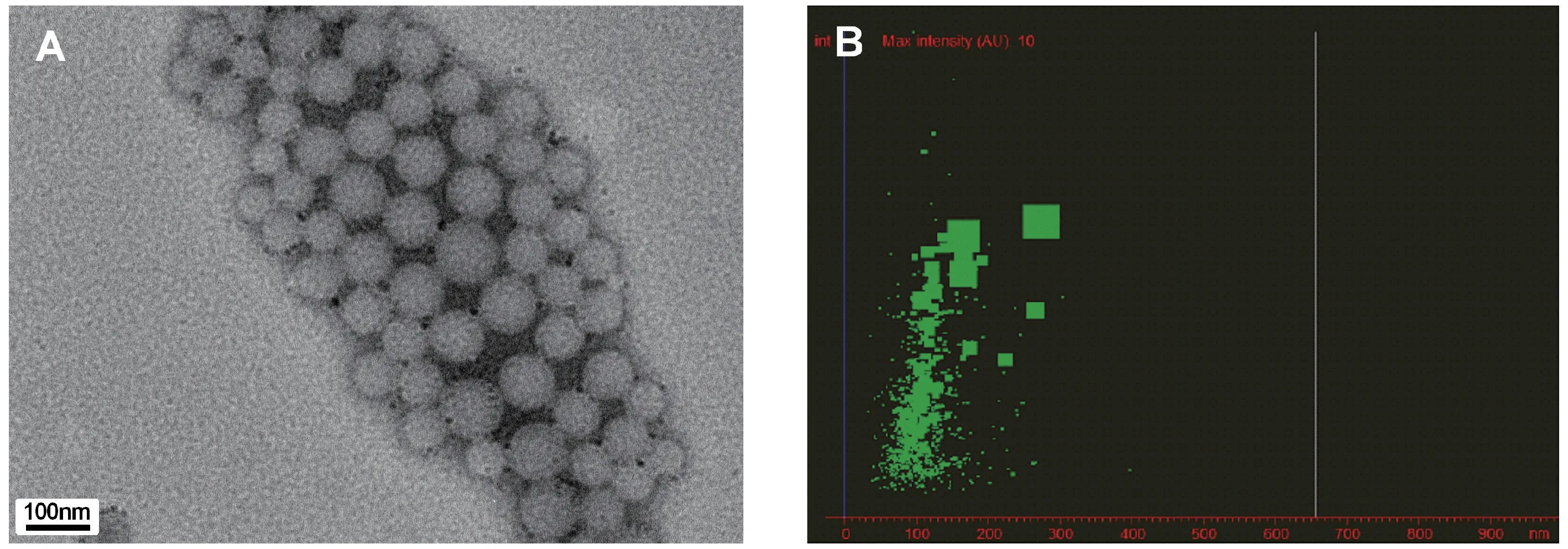
图1 CUR-NMs 表面形态及其粒径分布Figure 1 Surface morphology and particle size distribution of CUR-NMs
表1 各组大鼠缺血再灌注血流动力学参数的变化( ±s,n=10)Table 1 Changes in the hemodynamic parameters of ischemia-reperfusion rats in each group
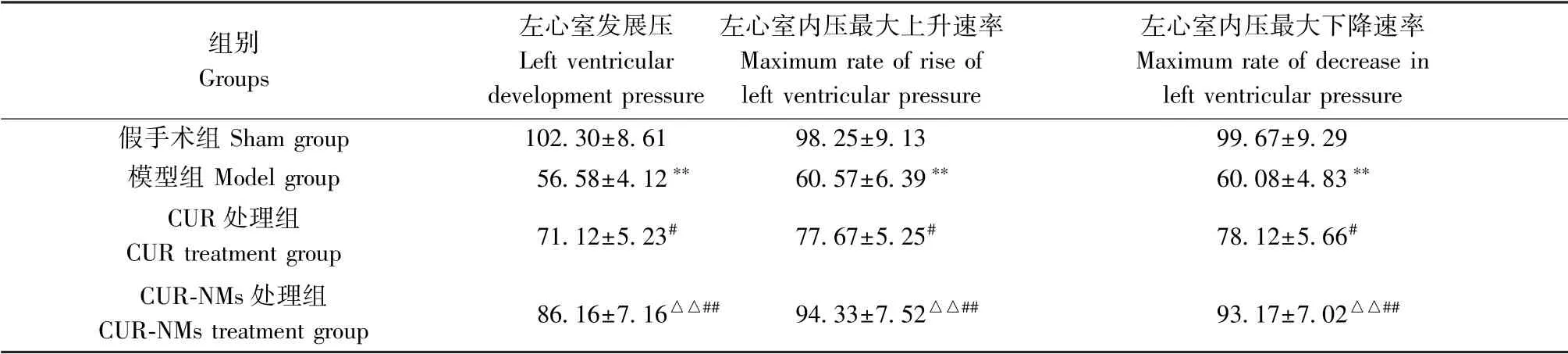
表1 各组大鼠缺血再灌注血流动力学参数的变化( ±s,n=10)Table 1 Changes in the hemodynamic parameters of ischemia-reperfusion rats in each group
注:与假手术组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01;与CUR 处理组相比,△△P<0.01。Note. Compared with the sham group,**P<0.01.Compared with the model group,#P<0.05,##P<0.01.Compared with the CUR treatment group,△△P<0.01.
组别Groups左心室发展压Left ventricular development pressure左心室内压最大上升速率Maximum rate of rise of left ventricular pressure左心室内压最大下降速率Maximum rate of decrease in left ventricular pressure假手术组Sham group 102.30±8.61 98.25±9.13 99.67±9.29模型组Model group 56.58±4.12** 60.57±6.39** 60.08±4.83**CUR 处理组CUR treatment group 71.12±5.23# 77.67±5.25# 78.12±5.66#CUR-NMs 处理组CUR-NMs treatment group 86.16±7.16△△## 94.33±7.52△△## 93.17±7.02△△##
表2 各组大鼠血清LDH、CK、MDA、SOD 水平较( ±s,n=10)Table 2 Comparison of serum LDH, CK, MDA, and SOD levels of the rats in each group
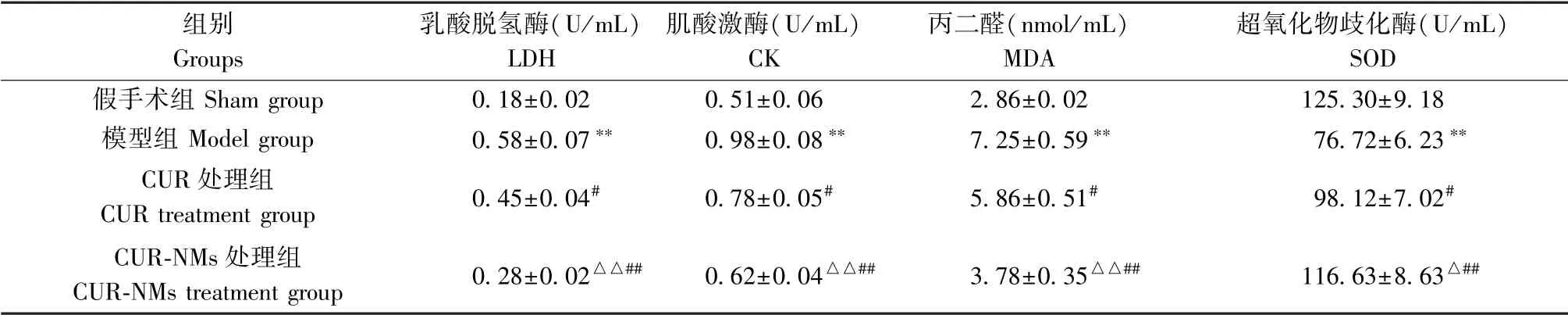
表2 各组大鼠血清LDH、CK、MDA、SOD 水平较( ±s,n=10)Table 2 Comparison of serum LDH, CK, MDA, and SOD levels of the rats in each group
注:与假手术组相比,**P<0.01;与模型组相比,#P<0.05,##P<0.01;与CUR 处理组相比,△P<0.05,△△P<0.01。Note. Compared with the sham group,**P<0.01.Compared with the model group,#P<0.05,##P<0.01.Compared with the CUR treatment group,△P<0.05,△△P<0.01.
组别Groups乳酸脱氢酶(U/mL)LDH肌酸激酶(U/mL)CK丙二醛(nmol/mL)MDA超氧化物歧化酶(U/mL)SOD假手术组Sham group 0.18±0.02 0.51±0.06 2.86±0.02 125.30±9.18模型组Model group 0.58±0.07** 0.98±0.08** 7.25±0.59** 76.72±6.23**CUR 处理组CUR treatment group 0.45±0.04# 0.78±0.05# 5.86±0.51# 98.12±7.02#CUR-NMs 处理组CUR-NMs treatment group 0.28±0.02△△## 0.62±0.04△△## 3.78±0.35△△## 116.63±8.63△##
2. 4 各组大鼠心肌细胞凋亡情况
大鼠缺血30 min 再松开灌注2 h 后,假手术组、模型组、CUR 处理组、CUR-NMs 处理组凋亡指数 分 别 为(1.98 ± 0. 20)、(22. 50 ± 2. 12)、(15. 00±1.65)、(7. 52±0. 66)。 与假手术组相比,模型组心肌细胞凋亡明显增加(P<0. 01);与模型组相比,CUR 处理组和CUR-NMs 处理组心肌细胞凋亡明显减少(P<0. 01);而相较于CUR处理组,CUR-NMs 处理组心肌细胞凋亡明显减少(P<0. 01),见图2。
2.5 各组大鼠心肌calpain1、calpastatin、Bcl-2、cleaved-caspase 3 蛋白表达变化
大鼠缺血30 min 再松开灌注2 h 后,模型组较假手术组calpain1 和cleaved-caspase 3 蛋白表达明显上调,Bcl-2 和calpastatin 蛋白表达明显下调(P<0.01);与模型组相比,CUR 处理组和CUR-NMs 处理组calpain1 和cleaved-caspase 3 蛋白表达显著下调,Bcl-2和calpastatin 蛋白表达明显上调(P<0.05 或P<0.01);相较于CUR 处理组,CUR-NMs 处理组calpain1 和cleaved-caspase 3 蛋白表达下调,Bcl-2 和calpastatin 蛋白表达上调(P<0.05 或P<0.01)(见图3,表3)。
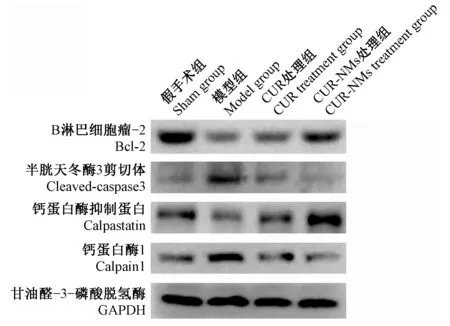
图3 各组大鼠心肌calpain1、calpastatin、Bcl-2、cleaved-caspase 3 表达变化Figure 3 Changes in myocardial calpain1, calpastatin, Bcl-2, and cleaved-caspase 3 expression in each group of rats

表3 各组大鼠心肌calpain1、calpastatin、Bcl-2、cleaved-caspase 3 表达变化Table 3 Changes in myocardial calpain1, calpastatin, Bcl-2, and cleaved-caspase 3 expression in each group of rats
3 讨论
一般来讲,在心肌缺血基础上恢复血流后组织损伤反而加重,甚至发生不可逆性损伤的现象称为心肌缺血再灌注损伤。 心肌缺血再灌注能引起心功能改变,表现为心室舒张末期压力(VFDP)增大,心室收缩峰(VPSP)、心室内压±dp/dtmax降低,室性期前收缩、阵发性室速及室颤等[9]。 心肌缺血再灌注还能破坏心肌超微结构,引起心肌能量代谢异常,如释放细胞内LDH 和CK[10]。 本研究模型组大鼠缺血30 min 再松开灌注2 h 后LVDP、+dp/dtmax和-dp/dtmax 指标均明显下降,血清LDH、CK 显著升高,提示本研究模型成功,心肌缺血再灌注引起心肌细胞损伤。 而CUR 和CUR-NMs 处理均能抑制上述指标的变化,且与CUR 相比,CUR-NMs 处理后心肌缺血再灌注模型鼠LVDP、+dp/dtmax 和-dp/dtmax 升高幅度更大,LDH 和CK 下降更多。 进一步研究发现,CUR 和CUR-NMs 均能抑制心肌缺血再灌注引起的心肌细胞凋亡,二者中CUR-NMs 的抑制效应更强。 这些提示,CUR 和CUR-NMs 均对心肌缺血再灌注损伤具有保护作用,且CUR-NMs明显优于CUR。 研究显示,心肌缺血再灌注可产生大量的氧自由基和其降解产物(如MDA),内源性自由基清除物(如SOD)不足以将过多的氧自由基清除[11]。 而过多的氧自由基可导致细胞膜脂质过氧化,细胞通透性增加,引起氧化损伤[12]。 本研究显示,大鼠心肌缺血再灌注引起MDA 增加,SOD 减少,而CUR 和CUR-NMs 可抑制MDA 和SOD 的变化,且CUR-NMs 的抑制作用更强。 提示CUR 和CUR-NMs 均可减轻心肌缺血再灌注引起的氧化损伤,CUR-NMs 效果更佳。
钙蛋白酶1(calpain1)属于Ca2+依赖性的半胱氨酸蛋白酶水解家族成员,其活性受到钙离子浓度和其天然的活性抑制分子calpastatin 的限制[13]。 研究显示,毛蕊异黄酮可能通过抑制calpain-1 的表达发挥抗脑缺血再灌注损伤作用[14]。 提示calpain1参与缺血再灌注损伤。 为此, 本研究观察了calpain1 在心肌缺血再灌注中的变化。 结果发现心肌缺血再灌注模型组细胞calpain1 表达上调,而calpastatin 表达下调,提示缺血再灌注大鼠心肌calpain1 表达和活性增加。 而CUR 和CUR-NMs 预处理后calpain1 和calpastatin 蛋白表达变化受到抑制,且CUR-NMs 的抑制作用更强。 提示CUR 和CUR-NMs 可能通过抑制calpain1 蛋白表达和活性从而对心肌缺血再灌注损伤起到保护作用。
CUR 脂溶性较强,但在水中很难溶解。 因此从制剂角度解决CUR 的药物输送问题十分关键。 纳米乳剂是脂质体输送亲脂性化合物的理想工具[15]。纳米乳剂的表面特性与机体细胞膜的生物学特性类似,易被细胞摄取,因此在改善溶解度的同时也能够增加药物在体内的摄取[16-17]。 这是本研究CUR-NMs 对心肌缺血再灌注保护作用强于CUR 的可能原因。 但CUR-NMs 稳定性不佳,对于储存条件要求较高,工业化难度大,因而它的广泛应用还面临很大挑战。 总之,本研究发现CUR-NMs 可改善大鼠心肌缺血再灌注损伤,且效果优于CUR;该效应可能与增强细胞摄取、抑制calpain1 蛋白表达和活性有关。 CUR-NMs 可能是临床治疗心肌缺血再灌注损伤的潜在药物。

