α-突触核蛋白A53T 突变损伤小鼠认知功能
王嫚诗,张 玲,秦 川,丛 斌
(1.国家卫生健康委员会人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021;2.河北省法医学重点实验室,河北医科大学法医学院,河北省法医分子鉴定协同创新中心,石家庄 050017)
突触核蛋白相关路易体病是一种常见的中老年人痴呆性疾病,主要包括帕金森病痴呆(PDD)、路易氏体痴呆(DLB)[1-2]。 其病理特征主要为多巴胺能神经元缺失以及突触核蛋白(α-synuclein)的沉积即路易氏小体(Lewy bodies,LBs)的形成[3]。 突触核蛋白相关路易体病的主要症状表现为认知功能障碍以及帕金森病症状,包括早期出现进展性痴呆,后期伴随锥体外系症状表现[4-5],并且其SNCA 基因中特定的遗传变异可以影响临床表型[6],其A53T 突变起病年龄早,生存期短[7]。 但在目前,没有针对DLB 及PDD 确切的治疗以及理想的动物模型。
此外,研究表明α-synuclein 沉积可以通过干扰线粒体外膜,影响线粒体融合与裂变,从而导致线粒体结构破坏[8-10],并且其A53T 突变能够直接抑制线粒体呼吸链中复合物的活性,从而导致线粒体氧化应激,进而影响神经细胞的正常功能[11-12]。 在认知功能方面,神经突触内的线粒体含量变化、电子传递链的改变直接影响神经元的传递[13-14],因此,保护线粒体形态,维持线粒体稳定可作为潜在的治疗方向。
突触核蛋白相关疾病至今仍无确切的治疗措施,而有效的动物模型的建立及应用是解决问题的关键。 因此,本实验通过行为学实验对该模型进行运动,焦虑样行为以及认知方面评价;结合免疫组化观察小鼠不同脑区的突触核蛋白沉积,多巴胺能神经元的变化;应用电镜观察其对线粒的影响,进而评价该模型的可行性。
1 材料和方法
1.1 实验动物
清洁级,雌雄各半,表达人α-synuclein A53T 突变的转基因模型小鼠和野生型C57BL/6 小鼠各30只,10 月龄,体重20 ~30 g,购于北京华阜康生物科技股份有限公司[SCXK(京)2014-0004],饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2018-0019]。 动物实验方案获中国医学科学院医学实验动物研究所实验动物使用与管理委员会(IACUC)的批准(ILAS-QC-19004),并根据3R 原则对实验动物的使用及饲养给予人道主义关怀。
1.2 主要试剂与仪器
引物购买于中国生工生物工程股份有限公司;Mouse Direct PCR Kit 购买于美国Biotool 公司;TH(EP1532Y)抗体,α-synuclein (EP1536Y)抗体,P-αsynuclein (ab59264)抗体购买于美国Abcam 公司;HRP 标记兔抗购买于北京中杉金桥生物技术有限公司;BSA(牛血清白蛋白)购买于德国SIGMA 公司;免疫组化试剂盒购买于北京中杉金桥生物技术有限公司;尼氏染色试剂盒购买于北京索莱宝科技有限公司。 EthoVision XT 动物轨迹跟踪于行为观察记录分析系统购自荷兰Noldus 公司;条件恐惧分析系统购于美国MED Associates 公司;转棒分析系统购于中国淮北正华公司;抓力分析系统购于法国BIOSEB 公司;圆筒实验装置为自行设计;冰冻切片机购于美国SAKURA Tissue-Tek 公司;电镜JEM-1400 购于日本电子公司;显微镜购于德国莱卡公司。
1.3 实验方法
1.3.1 转基因阳性动物鉴定
子代小鼠出生8 ~14 d 内剪鼠尾,按照试剂盒说明加入组织消化液,配置20 μL 反应体系,上下游引 物 为: 5’-GAGGAAGGGTATCAAGACTACGAAC-3’; 5’-GCCGGATCATAATCAGCC ATACCAC-3’,参照文献设置循环参数进行PCR 扩增基因型鉴定[15]。
1.3.2 认知、焦虑样及运动行为学检测
旷场行为学实验可以反应小鼠的自主运动能力、探索能力及焦虑程度。 旷场实验箱为40 cm×40 cm×40 cm 正方体,未有顶部遮盖,上方悬挂摄像机。设置实验箱内观察区,中央区及边缘区,记录小鼠5 min 内运动时间,距离,平均运动速度,中央区及边缘区停留时间。 圆筒实验用于检测小鼠在圆筒内的自发活动,主要包括小鼠在圆桶内的站立,理毛和前肢活动情况。 圆筒为一直径7.5 cm 的圆柱型透明有机玻璃,未有顶部遮盖,在圆筒前后方分别放有摄像机和镜子,用于全方位观测和量化小鼠自发活动情况。 实验时将小鼠放入圆筒内,记录3 min内小鼠的站立次数和理毛时间。 转棒实验用于评价小鼠的运动协调能力。 转棒仪主要由转轴和独立隔间组成,实验分3 d 进行,前2 d 为训练期,转速为10 r/min,每天训练3 次,每次持续5 min;第3 d为测试期,从初始逐渐加速至40 r/min 共计5 min,每只小鼠检测3 次,每次间隔20 min,取3 次均值记为在棒时间,实验期间小鼠掉落系统自动停止记录。
抓力实验用于检测小鼠的前肢肌张力,主要由抓力网格以及计算机检测系统组成。 实验时提起小鼠尾部,让小鼠前肢抓取网格,由上至下轻拉小鼠尾部拖动小鼠,记录拉力最大值,每只小鼠测试三次,取平均值。
Morris 水迷宫实验用于检测小鼠空间学习记忆行为。 设置水池内四个象限及隐藏平台。 操作者每次从不同象限放入小鼠,共训练7 d,第8 天撤掉平台,进行探索实验测试,记录小鼠穿越平台所在象限时间及次数。
条件恐惧实验用于评价小鼠对恐惧场景的记忆,包括场景性条件恐惧及线索性条件恐惧,通过记录小鼠僵直时间反应小鼠的恐惧程度。 实验分4 d 进行,第1 天为适应期,第2 天给予电击及声音刺激,第3 天无任何刺激,第4 天更换场景仅给予声音刺激。 第1 天设置光照强度为130 lx,将小鼠放入条件恐惧箱内适应10 min;第2 天设置光照强度为130 lx,电击强度0.5 mA,声音强度为80 db,刺激频率为5000 hz。 将小鼠放入条件恐惧箱内,3 min 后给予单一频率声音刺激(30 s),于声音刺激的最后2 s 给予电击刺激,每段间隔1 min,10 min 内给予5次声音及电击刺激,记录小鼠在恐惧箱10 min 内的僵直时间;第3 天设置光照强度为130 lx,无任何条件刺激,记录小鼠5 min 内的僵直时间。 第4 天更换场景,放置黑板遮光,并在其侧壁涂有带有气味的果汁。 光照强度、声音刺激及检测时间同第2 天,记录小鼠在恐惧箱内僵直时间。
1.3.3 免疫组化观察突触核蛋白/路易小体沉积,TH 细胞变化
1)TH 染色及α-synuclein 染色
PBS 洗脑片后置于3%过氧化氢封闭液室温孵育10 min,再次用PBS 冲洗3 次,每次10 min,置于BSA 孵育30 min,一抗(TH 抗体1 ∶5000 稀释;αsynuclein 抗体1 ∶1000 稀释)孵育过夜。 PBS 洗脑片后,二抗(兔抗1 ∶1000;鼠抗1 ∶1000)室温孵育30 min,PBS 洗脑片4 次,每次5 min,DAB 显色30 s。 取相同层面纹状体,黑质,海马贴片,烤片1 h,置于氯仿及酒精混合溶液(1 ∶1)过夜。
2)尼氏染色及计数
将玻片置于100%乙醇、95%乙醇梯度脱水各30 s,自来冲洗后甲酚紫染色,再用95%乙醇、100%乙醇梯度脱水各10 s,置于二甲苯30 s 后中性树胶封片。将染色后的黑质及纹状体置于显微镜下观察并画出黑质区域,用image J 软件计数TH 阳性细胞数。
1.3.4 电镜观察线粒体形态变化
生理盐水及多聚甲醛灌注后,取纹状体经2.5%的戊二醛固定过夜后用1%锇酸4℃固定2 h,蒸馏水冲洗后梯度乙醇脱水,环氧丙烷处理,树脂浸透,包埋,制备超薄切片,染色后置于电镜下观察。
1.4 统计学方法
实验数据采用GraphPad Prism 6 软件处理数据、作图,结果采用平均数±标准差(±s)表示,以P<0.05 为差异具有统计学意义。
2 结果
2.1 转基因阳性动物的鉴定
部分α-synuclein A53T 小鼠基因鉴定结果见图1,携带α-synuclein A53T 基因的阳性鼠可见清晰PCR 扩增条带,与目的片段大小相符,阴性鼠无条带(图1)。
2.2 α-synuclein A53T 转基因小鼠认知行为学改变
在旷场实验中,α-synuclein A53T 转基因小鼠表现为运动距离增加,但在中央区停留时间未见明显统计学差异(图2A~2C);在圆筒实验、转棒实验、抓力实验(图2D ~2E、图3)及水迷宫实验(图4A ~4C)中,α-synuclein A53T 转基因小鼠与Control 组小鼠相比均未见明显统计学差异;在条件恐惧实验中,α-synuclein A53T 转基因小鼠在第场景依赖条件恐惧(海马依赖,0~330 s)与线索依赖条件恐惧(杏仁核依赖,180 ~570 s)中表现为僵直时间缩短(图4D~4E),具有统计学差异。
2.3 免疫组化观察α-synuclein 沉积增多,TH 细胞减少
应用免疫组化染色评价α-synuclein A53T 转基因小鼠α-synuclein,TH 变化。 P-α-synuclein 显示α-synuclein A53T 转基因小鼠纹状体、黑质、梨状皮层及海马P-α-synuclein 沉积增多(图5A);Pα-synuclein 染色观察小鼠前额叶路易氏小体的沉积,LB 的典型外观是一个或多个嗜酸性球体,中间为致密核心,周边为晕圈[16]如箭头所示(图5 B),纹状体、黑质α-synuclein 增多(图6);TH 染色显示A53T 转基因小鼠黑质TH 阳性多巴胺能神经元减少(图7),结果表明A53T 转基因小鼠具有不同脑区α-synuclein 沉积及TH 细胞减少的病理特征。
2.4 电镜观察小鼠脑线粒体形态变化
文献表明α-synuclein 可以直接影响线粒体呼吸链复合物的活性,从而导致线粒体氧化应激损伤。 电镜结果显示α-synuclein A53T 转基因小鼠线粒体内容物,线粒体嵴结构不清;线粒体形态改变,裂变增多,提示α-synuclein 的沉积可以影响线粒体的结构及形态(见图8)。
3 讨论
α-synuclein A53T 相 关 小 鼠 模 型 具 有 αsynuclein 的聚集以及TH 细胞的减少,常被用做PD模型。 研究表明,不同外源启动子调控表达的αsynuclein A53T 小鼠模型的表型有所差别,朊病毒启动子主要在神经元表达[12];Teto 启动子主要在四环素诱导下表达[17];thy1 启动子主要在皮层以及皮层下神经元表达[18]。 此外,AAV1/2-A53T-α-synuclein诱导的小鼠模型,可在SN 中引起α-synuclein 的广泛过表达,从而导致多巴胺能纤维丢失和纹状体中多巴胺能神经递质的减少,早期可伴有运动障碍[19]。
本实验采用的小鼠为血小板源生长因子启动子(PDGF-h-α-Synuclein) A53T 突变小鼠,PDGF-β启动子可以在新皮层、嗅球、胶质细胞以及神经元中广泛表达,并且据报道该小鼠具有α-synuclein 的沉积以及进行性运动障碍[20]。
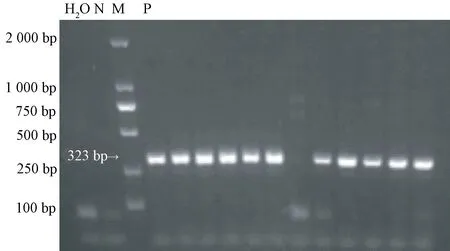
图1 部分α-synuclein A53T 小鼠PCR 鉴定凝胶电泳图Figure 1 PCR identification of α-synuclein A53T mice by gel electrophoresis

图2 α-synuclein A53T 小鼠焦虑样行为学表现Note. A, The experimental area of the open field test. B ~C, Comparison of distance moved and cumulative duration spent in zone C. D ~E,Comparison of grooming and rearing time in the Cylinder test.Compared with the control group,*P <0.05.Figure 2 Anxiety behavior in α-synuclein A53T mice
在α-synuclein A53T 转基因小鼠模型中,12 月龄A53T 小鼠可以出现明显的运动学障碍表现[21],此外,朊病毒启动子调控表达的α-synuclein A53T小鼠在6 月龄出现空间记忆障碍,以及减少的焦虑样行为,并且空间记忆缺陷随着月龄增长而发展[12]。 但对 于PDGF-β 启 动 子 调 控 表 达 的αsynuclein A53T 小鼠并未有系统的认知、运动及焦虑样行为学评价。
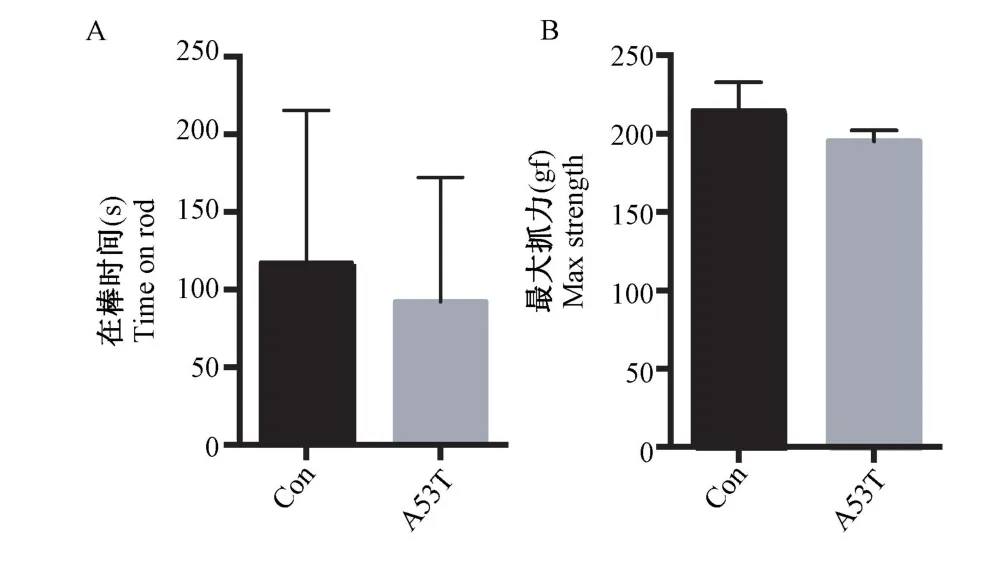
图3 α-synuclein A537 小鼠运动行为学表现Note. A, Comparison of duration in the rotating rod test. B,Comparison of maximum strength.Figure 3 Motor behavior in α-synuclein A53T mice
在本实验中,PDGF-β 启动子调控表达的αsynuclein A53T 小鼠运动距离增加,呈现过度活跃状态,同之前的研究相符[22];而焦虑样及运动学评价未显示明显统计学差异,表明10 月龄时α-synuclein A53T 转基因小鼠并未有焦虑症状以及明显运动学症状改变,在认知行为学评价中,海马及杏仁核依赖的条件孔恐惧记忆时间缩短,表明10 月龄αsynuclein A53T 转基因小鼠出现认知记忆障碍,但是对于水迷宫实验中空间学习记忆能力并未有明显改变,因此在PDGF-β 启动子调控表达的10 月龄αsynuclein A53T 小鼠模型中,行为学检测表现为条件恐惧认知功能障碍,并且其发生早于运动功能障碍,以及未见明显的焦虑样行为改变。 免疫组化实验中,在黑质、纹状体、梨状皮层、海马观察到P-αsynuclein 沉积,前额叶皮层中观察到LBs,并且研究表明,在突触核蛋白相关路易氏体疾病中,大部分α-synuclein 沉积在129 位丝氨酸是磷酸化的,而在正常人中仅有少部分是磷酸化的[23]。 此外,在αsynuclein 染色中黑质纹状体α-synuclein 有明显改变,TH 染色观察黑质中多巴胺能神经元减少,符合突触核蛋白相关路易氏体疾病中类似PD 的病理表现,并且电镜观察显示,与对照组相比,10 月龄αsynuclein A53T 转基因小鼠线粒体内容物不清,形态发生改变,裂变增多[24],以上实验结果符合突触核蛋白相关疾病(路易氏体痴呆/帕金森病痴呆)报道[1-2]。
综上所述,在本实验研究中,10 月龄PDGF-β启动子调控表达的α-synuclein A53T 小鼠在行为学表现为认知功能障碍先于运动功能障碍,在病理学表现为磷酸化突触核蛋白的沉积以及多巴胺能神经元减少,线粒体裂变增多,进而提出该小鼠可作为一种突触核蛋白相关认知障碍性疾病如(路易氏体痴呆/帕金森病痴呆)相关的动物模型,为αsynuclein 引起的认知障碍性疾病的机制研究与药物开发提供支撑。

图4 α-synuclein 小鼠认知行为学表现Note. A,Latency to find the hidden platform during 7 consecutive days of training. B-C,Time and frequency of crossing of the quadrant containing the platform. D-E, Freezing time in the context memory test and cued memory test.Compared with the control group, *P <0.05,**P <0.01.Figure 4 Cognitive behavior in α-synuclein A53T mice
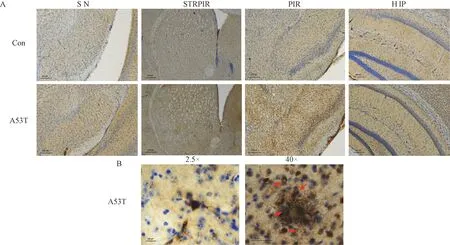
图5 不同脑区P-α-synuclein 沉积Note. A, P-α-synuclein accumulation in the substantia nigra (SN), striatum (STR), piriform cortex (PIR), and hippocampus (HIP) of αsynuclein A53T mice. B, Lewy-body (LBs) deposition in the prefrontal cortex.Figure 5 P-α-synuclein deposition in different brain regions in α-synuclein A53T mice

图6 黑质、纹状体中α-synuclein 沉积Figure 6 α-synuclein deposition in the SN and STR of α-synuclein A53T mice

图7 小鼠脑黑质多巴胺能神经元变化Note. A, Immunohistochemical staining showed TH expression in the SN. B, Quantification of TH-positive cells in the SN.Figure 7 TH expression in the SN of α-synuclein A53T mice

图8 电镜下小鼠脑线粒体变化Figure 8 Mitochondrial morphology in the amygdala of α-synuclein A53T mice

