利用Pdl1 敲除的巨噬细胞转录谱分析结核感染中PD-L1 作用相关的候选基因
石亚男,唐 军,李军丽,王 杰,占玲俊
(中国医学科学院医学实验动物研究所;卫健委人类疾病比较医学重点实验室;新发再发传染病动物模型研究北京市重点实验室;北京市人类重大疾病实验动物模型工程技术研究中心;中国医学科学院结核病中心,北京 100021)
结核病是由结核分枝杆菌(简称结核菌,Mycobacterium tuberculosis,Mtb)感染引起的慢性传染性疾病,是全球十大死因之一。 2019 年世界卫生组织(WHO)报告指出,2017 年全球结核病人数约为17 亿,其中新发结核病例1010 万人,结核病死亡人数约为157 万[1],WHO 呼吁2030 年终止结核,因此结核的防控研究尤为任重而急迫。
程序性死亡配体1(PD-L1)高表达与活动性结核紧密相关,PD-L1 表达于多种免疫细胞,如巨噬细胞、中性粒细胞、T 细胞和B 细胞[2]。 其中巨噬细胞是结核病肉芽肿形成的主要细胞[3],巨噬细胞作为效应细胞和抗原提呈细胞,在感染过程中通过吞噬杀伤、抗原提呈和分泌多种细胞因子等功能来调控机体炎症反应和免疫应答[4],是宿主控制Mtb 感染扩散的重要防御屏障。 体外Pdl1 敲低实验表明,PD-L1 可以通过PD-1: PD-L1/PD-L2 通路在结核感染中发挥免疫抑制作用[5-7],而体内作用机制不明,且体外作用的具体分子机制不明。 除了PD1:PD-L1 通路外,结核病中PD-L1 是否存在类似其他感染或肿瘤疾病中的其它配体和通路,目前还未见报道,其分子机制需要深入研究。
我们通过Cre-loxp 技术构建巨噬细胞特异性Pdl1 敲除小鼠[8],主要目的是在结核感染中,动物体内研究PD-L1 对巨噬细胞的作用机制。 本研究通过比较不同敲除水平Pdl1 的巨噬细胞感染Mtb后转录谱变化,从生物信息学筛选到的差异表达基因角度,分析结核菌感染中PD-L1 发挥作用的分子机制,为深入研究PD-L1 在结核感染发病中免疫作用和机制奠定基础。
1 材料和方法
1.1 实验材料
1.1.1 实验菌株
结核分枝杆菌标准株H37Rv(菌号为93009)为本室保存,使用前活化并将菌悬液浓度调整为1.0×107CFU/mL,-80℃保存备用。
1.1.2 实验动物
3 只4 ~6 周龄SPF 级雄性Pdl1Flox/-小鼠体重12~14 g,由中国医学科学院医学实验动物研究所基因工程平台采用CRISPR/Cas9 技术构建。 4 ~6周龄SPF 级野生型C57BL/6 小鼠购自北京维通利华[SCXK(京)2017-001],体重12 ~14 g,4 ~6 周龄SPF 级雄性Lyz2-iCre 小鼠由南京大学模式动物中心惠赠,体重12 ~14 g,均饲养于中国医学科学院医学实验动物研究所屏障环境动物房[SYXK(京)2014-0029],动物实验中涉及动物的操作程序已经得到本所实验动物使用与管理委员会(IACUC)的批准,批准号为ZLJ19003,所有动物按3R 原则予以关怀。
1.2 主要试剂
中性罗氏培养管(珠海贝索生物,中国);FBS、DMEM 培养基、RPMI-1640 培养基(Gibco,美国);TRIzol Reagent(Life Technologies,美国);DNA 提取试剂盒(EE101-02)购自北京全式金;PCR 引物由上海英潍捷基合成;1×RBC Lysis Buffer、Anti-mouse CD3e FITC(eBioscience,美国);PE/Cy7 anti-mouse CD19、APC anti-mouse CD4、FITC anti-mouse/human CD11b、APC anti-mouse F4/80、PE anti-mouse CD274(B7-H1,PD-L1)(Biolegend,美国)。
1.3 实验方法
1.3.1 巨噬细胞特异性Pdl1 敲除小鼠制备和繁育
巨噬细胞特异性Pdl1 敲除小鼠的设计利用了位点特异性重组酶系统Cre/loxp 原理,需要在Pdl1基因序列的两端各放置一个loxp 序列,得到Pdl1Flox/-小鼠。 将Pdl1Flox/-小鼠与巨噬细胞特异的Cre 小鼠交配繁殖,以获得在巨噬细胞内把Pdl1 基因敲除掉的小鼠,即巨噬细胞特异性Pdl1 敲除小鼠,具体方法如下:
Pdl1Flox/-小鼠构建成功后,与C57BL/6 小鼠进行杂交,得到的Pdl1Flox/-小鼠进行自交,进一步得到Pdl1Flox/Flox小鼠,将雌性Pdl1Flox/Flox小鼠和带有巨噬细胞特异性表达Cre 酶的Lyz2-iCre 雄鼠进行杂交,得到Pdl1Flox/--Cre 小鼠,最后将Pdl1Flox/Flox小鼠和Pdl1Flox/-- Cre 小 鼠 杂 交, 最 终 得 到 1/4 的Pdl1Flox/Flox- Cre 小鼠,即为巨噬细胞特异性Pdl1 敲除小鼠,同时获得1/4 的Pdl1Flox/--Cre 小鼠及1/2的同窝阴性Pdl1Flox/Flox小鼠。
1.3.2 小鼠基因型鉴定
剪脚趾标记出生幼鼠,收集脚趾并进行全基因组DNA 提取。 每管加入100 μL LB2 和20 μL 蛋白酶K,56℃金属浴孵育至完全裂解后参照DNA 提取试剂盒说明书进行,纯化后的全基因组DNA 储存于-20℃冰箱备用。 根据待鉴定样品数量配制所需的PCR 反应体系,同时设置阴性对照和阳性对照进行PCR 扩增。 其中Pdl1-loxp 上游引物序列为: 5’TGTAAACTATTAGACTGGCTGGAATGTAG 3’;下游引 物 序 列 为: 5’ GATGCAAGCTAGATAATATATT CCCAGTC 3’,目标片段大小为KI 1700 bp。 Cre 上游引物序列为:5’AGTGCTGAAGTCCATAGATCGG 3’;下游引物序列为5’CTGATTCTCCTCATCACC AGG 3’。 目标片段大小为543 bp。 待扩增完毕,分别进行2%和1% 琼脂糖凝胶电泳鉴定。
1.3.3 PD-L1 表达水平的检测
(1) 腹腔巨噬细胞PD-L1 表达水平检测:Pdl1Flox/Flox- Cre、Pdl1Flox/-- Cre、Pdl1Flox/Flox小鼠腹腔注射6%可溶性淀粉肉汤1 mL,3 d 后小鼠断颈处死,无菌分离腹腔巨噬细胞;1300 r/min、室温离心10 min,RPMI-1640 培养基洗涤巨噬细胞两次,1 mL PBS 重悬细胞,分别加入APC-F4/80、FITCCD11b 和PE-CD274 流式抗体,以同型对照PE-IgG为阴性对照,室温避光孵育15 min,1500 r/min,离心5 min,弃上清;2 mL PBS 洗涤细胞,1 mL PBS 重悬后进行流式细胞术分析以检测巨噬细胞PD-L1表达水平。
(2)T 细胞与B 细胞PD-L1 表达水平检测:无菌解剖Pdl1Flox/Flox- Cre、Pdl1Flox/-- Cre、Pdl1Flox/Flox小鼠,脾研磨液过70 μm 孔径筛网,1500 r/min,离心5 min,弃上清;每管加入5 mL 1×RBC Lysis Buffer,涡旋30 s,室温静置4 min;1500 r/min,4℃,离心5 min,弃上清,5 mL PBS 洗涤细胞3 次,1 mL PBS 重悬细胞,分别加入FITC-CD3e、APC-CD4、PE/Cy7-CD19 和PE-CD274 流式抗体,以同型对照PE-IgG为阴性对照,室温避光孵育15 min,同上进行流式细胞术分析以检测T 细胞与B 细胞PD-L1 表达水平。
1.3.4 感染与检测
取24 孔细胞培养板,每孔加入500 μL 新分离的Pdl1Flox/Flox- Cre、Pdl1Flox/-- Cre、Pdl1Flox/Flox小鼠腹腔巨噬细胞,浓度为1×106细胞/mL。 37℃、5%CO2贴壁培养2 d;弃上清,每孔补加500 μL DMEM完全培养基,按MOI 10 加入Mtb 进行感染,未感染对照组每孔加入等体积的DMEM 完全培养基;感染24 h 后,弃上清,1 mL PBS 洗涤贴壁细胞3 次,每孔加入1 mL TRIzol 并收集各组细胞裂解液,提取全基因组进行测序和数据分析。
1.4 统计学方法
基因组比对采用STAR(v2.5.2b)软件,差异表达分析采用DEGSeq(v1.12.0)软件,基因本体论(Gene Ontology,GO)富集分析采用GOSeq 软件(v1.22),京都基因和KEGG 富集分析采用KOBAS(v2.0)软件。
2 结果
2.1 巨噬细胞特异性Pdl1 敲除小鼠基因鉴定
繁育实验所需巨噬细胞特异性Pdl1 敲除小鼠,剪新出生小鼠脚趾,提取鼠趾基因组,用PCR 技术进行小鼠基因鉴定。 Pdl1Flox/Flox-Cre 小鼠(图中标号为7、10 小鼠)及Pdl1Flox/--Cre 小鼠(图中标号为3、4、6、8、12 小 鼠) 用 于 进 一 步 研 究,同 窝 阴 性Pdl1Flox/Flox小鼠(图中标号为9 小鼠)作为对照组,图中标号1、11 为野生型小鼠,2、5 为Pdl1Flox/-小鼠(图1)。
2.2 PD-L1 表达的检测结果
流式细胞仪检测发现:Pdl1Flox/Flox- Cre 小鼠腹腔巨噬细胞PD-L1 的表达量是显著偏低的,P <0.001(图2A - 1);三种亚品系Pdl1Flox/Flox-Cre、Pdl1Flox/--Cre、Pdl1Flox/Flox小鼠T 细胞与B 细胞PDL1 的表达量是大致相同的(图2B-1 与图2C-1)。因此巨噬细胞特异性Pdl1 敲除小鼠制备成功。
2.3 数据产出质量
测序后Pdl1Flox/Flox- Cre 感染组、Pdl1Flox/-- Cre感染组、Pdl1Flox/Flox感染组及其各自对应的未感染组数据质量通过过滤后的测序数据(Clean reads)大小、99.00%碱基正确识别率(Q20)和99.90%碱基正确识别率(Q30)来判定(表1)。 可见,测序质量能够满足后续分析的要求。
2.4 测序序列(reads)与参考基因组比对结果
各组样品reads 与参考基因组比对的总百分比(Total mapped reads): Pdl1Flox/Flox-Cre 感染组为98.66%,Pdl1Flox/--Cre 感染组为98.70%,Pdl1Flox/Flox感染组为98.57%, 未感染组分别为98.67%,98.69%和98.58%,均高于65.00%,表明参考基因组选择合适(表2)。
2.5 差异表达分析结果
差异表达结果的分析比较思路是:将每个亚品系的小鼠的感染组与未感染组相比,其差异基因认为是与Mtb 感染相关的候选基因,然后将每个敲除小鼠筛到的与Mtb 感染相关的候选基因与同窝阴性小鼠分别比较,其差异基因再结合Pdl1Flox/Flox-Cre 和Pdl1Flox/--Cre 小鼠共同的Mtb 感染相关基因分析,最终得到结核感染中PD-L1 特异性的基因。
与Pdl1Flox/Flox-Cre 的未感染组相比,Pdl1Flox/Flox-Cre 感染组差异表达的基因共有744 个(Q <0.005),其中上调表达基因415 个,下调表达基因329 个(图3A);与Pdl1Flox/--Cre 的未感染组比较,Pdl1Flox/--Cre 感染组差异表达的基因共有811 个(Q <0. 005),其中上调表达基因459个,下调表达基因352 个(图3B);与Pdl1Flox/Flox的未感染组比较,Pdl1Flox/Flox感染组差异表达的基因共有510 个(Q<0.005),其中上调表达基因332 个,下调表达基因178 个(图3C)。

图1 巨噬细胞特异性Pdl1 敲除小鼠基因鉴定Note. N, Negative control. P, Positive control. M, DNA marker.Figure 1 Genotype identification of macrophage-specific Pdl1 conditional knockout mice
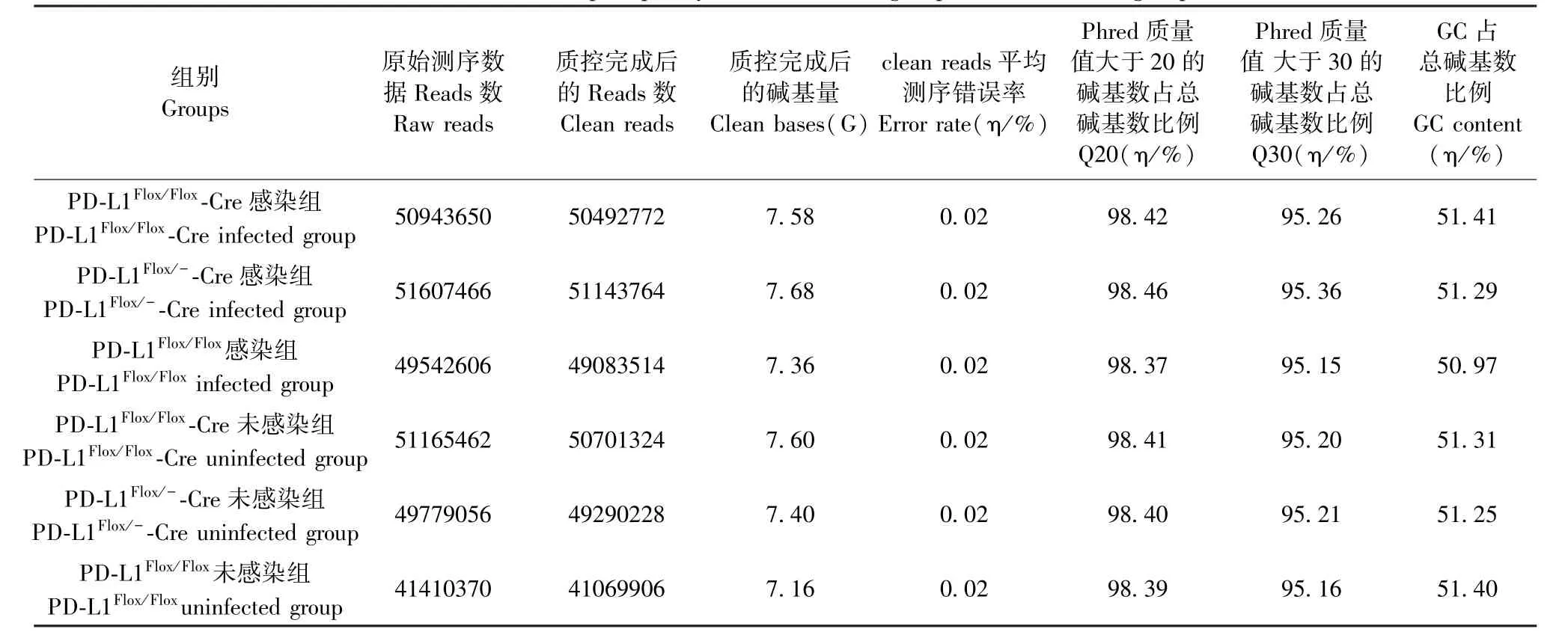
表1 感染组和未感染组数据产出质量Table 1 Data output quality list in infected group and uninfected group

图2 流式细胞术检测巨噬细胞、T、B 细胞上PD-L1 的表达Note. A, The above stands for the negative control of macrophages, and the below is the expression of PD-L1 in peritoneal macrophages of three sub-lineage mice. B, The above stands for the negative control of B cells, and the below is the expression of PD-L1 in B cells of three sub-lineage mice. C,The above stands for the negative control of T cells, and the below is the expression of PD-L1 in T cells of three sub-lineage mice. The blue peak represents Pdl1Flox/-with Cre mice, the red peak indicates Pdl1Flox/Floxwith Cre mice, and the green peak represents Pdl1Flox/Flox mice. Compared with the Pdl1Flox/Flox group,***P <0.001.Figure 2 The expression levels of PD-L1 on macrophages, T cells,and B cells were detected by flow cytometry
2.6 差异表达基因的GO 富集分析结果
与未感染组相比,Pdl1Flox/Flox-Cre 感染组,Pdl1Flox/--Cre 感染组,Pdl1Flox/Flox感染组最显著富集组份均为参与免疫反应的GO:0006955 (P <0. 01)与参与免疫系统过程的GO:0002376(P <0. 01),涉及差异表达的基因分别为18 个(表3),28 个(表4),20 个(表5),其中Pdl1Flox/Flox-Cre 感染组与Pdl1Flox/--Cre 感染组共有32 个差异表达基因,其中30 个基因表达上调,2 个基因表达下调。 这些共有的差异表达基因进一步与Pdl1Flox/Flox感染组进行比较,剔除相同基因,筛选出的候选基因初步定为结核感染中PD-L1 相关的特异基因,共17 个基因,其中13 个基因表达上调,4 个基因表达下调。
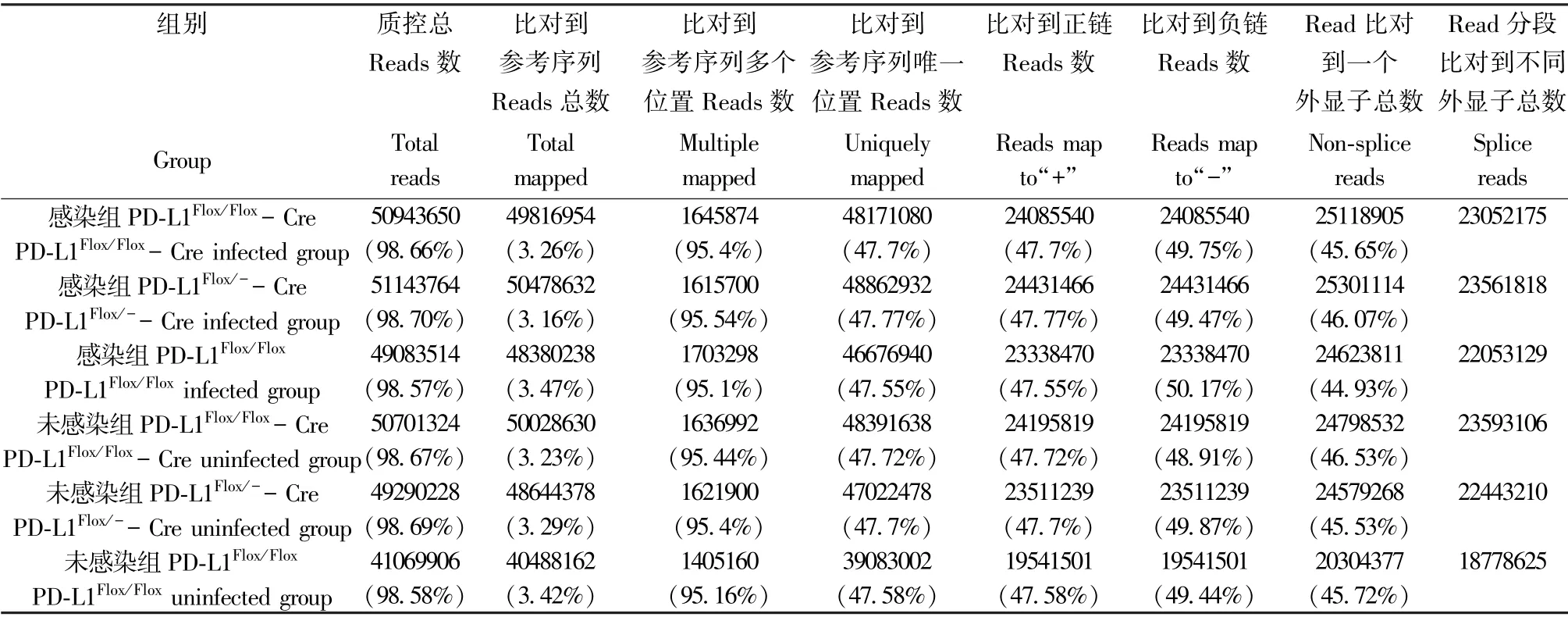
表2 感染组和未感染组reads 与参考基因组比对情况Table 2 Comparison of reads and reference genomes between infected group and uninfected group

图3 差异基因火山图Note, A, The Pdl1Flox/Flox with Cre infected group compared with the uninfected group. B, The Pdl1Flox/- with Cre infected group compared with the uninfected group. C, The Pdl1Flox/Floxinfected group compared with the uninfected group. The abscissa represents the fold change in gene expression in different samples,and the ordinate represents the statistically significant differences in gene expression.The significantly differentially expressed genes are represented by red dots (upregulation) and green dots (downregulation). Genes that were not significantly differentially expressed are indicated by blue dots.Figure 3 Differential gene volcano map

表3 PD-L1Flox/Flox-Cre 感染组与其未感染组相比差异表达基因GO 最显著富集分析的前2 项Table 3 Most two enriched terms of GO enrichment analysis of differentially expressed genes in PD-L1Flox/Flox-Cre infected group compared with its uninfected group

表4 PD-L1Flox/--Cre 感染组与其未感染组相比差异表达基因GO 最显著富集分析的前2 项Table 4 Most two enriched terms of GO enrichment analysis of differentially expressed genes in PD-L1Flox/--Cre infected group compared with its uninfected group
上调和下调表达基因名称及对应的变化倍数对数值[|log2(FoldChange)|]整理如下:上调表达的基因包括促炎因子趋化因子配体2(Ccl2,3.4677)、趋化因子配体7(Ccl7,8.1765)、白介素12a(Il12a,6.1789)、白介素6(Il6,9.0296)、趋化因子(C-X-C 模体)配体1(Cxcl1,6.1104)、趋化因子(C-X-C 模体)配体9(Cxcl9,1.9734)、组织相容性2,Q 区基因座5(Qa5,1.3648)、组织相容性2,M 区基因座2(Hmt,1.2766)、组织相容性2,T 区基因座23(Qa1, 1.1328)、 鸟苷酸结合蛋白4 (Gbp4,4.6111)、鸟苷酸结合蛋白8(Gbp8,2.8399)、鸟苷酸结合蛋白9(Gbp9,4.9383)、鸟苷酸结合蛋白11(Gbp11,6.649)。 下调表达的基因包括趋化因子(C-C 模体)配体9(Ccl9,1.3723)、白介素1 受体拮抗剂(Il1rn,1.9407)、补体成分1q 亚成分,α 多肽(C1qa,1.392) 和组织相容性2,K 区基因座2(H2k2,1.2708)。 上述基因表明Mtb 感染Pdl1 敲除的巨噬细胞24 h 后,可能通过上述免疫分子参与结核的特异性免疫反应。
2.7 差异表达基因的KEGG 富集分析结果
通过京都基因和基因组百科全书(Kyoto encyclopedia of Genes and Genomes,KEGG)富集分析,发现与未感染组相比,Pdl1Flox/Flox-Cre 感染组最显著富集的通路为Toll 样受体(Toll-like receptors)信号通路、核因子κB(nuclear factor kappa-B,NFκB)信号通路及缺氧诱导因子-1(HIF-1)信号通路(P<0.01,表6);Pdl1Flox/--Cre 感染组最显著富集的通路为肿瘤坏死因子(TNF)信号通路及NF-κB 信号通路(P<0.01,表7);Pdl1Flox/Flox感染组最显著富集的通路为TNF 信号通路及NF-κB 信号通路(P<0.01, 表 8)。 其 中 Pdl1Flox/Flox-Cre 感 染 组 与Pdl1Flox/--Cre 感染组富集的通路中共有16 个差异表达基因,表达均上调,这些共有的差异表达基因进一步与Pdl1Flox/Flox感染组进行比较,剔除相同基因,筛选出6 个基因,表达均上调,基因名称及变化倍数对数值[| log2(FoldChange)|]整理如下:CD40 抗原(Cd40,3.9838)、TNF 受体相关因子1(Traf1,2.2187)、 TNF 受体相关因子2 (Traf2,1.3572)、TNF 受体相关因子3(Traf3,1.3196)、前列腺素-内过氧化物合酶2(Ptgs2,7.7714)、Caspase募集结构域11(Card11,3.3684),上述基因初步定为结核感染中PD-L1 相关的特异基因。

表6 PD-L1Flox/Flox-Cre 感染组与其未感染组相比差异表达基因KEGG 最显著富集分析Table 6 Most enriched pathway terms of KEGG enrichment analysis of differentially expressed genes in PD-L1Flox/Flox-Cre infected group compared with its uninfected group

表7 PD-L1Flox/--Cre 感染组与其未感染组相比差异表达基因KEGG 最显著富集分析Table 7 Most enriched pathway terms of KEGG enrichment analysis of differentially expressed genes in PD-L1Flox/--Cre infected group compared with its uninfected group

表8 PD-L1Flox/Flox感染组与其未感染组相比差异表达基因KEGG 最显著富集分析Table 8 Most enriched pathway terms of KEGG enrichment analysis of differentially expressed genesin PD-L1Flox/Flox infected group compared with its uninfected group
3 讨论
巨噬细胞在宿主抗结核分枝杆菌的感染免疫中起关键作用[9],Mtb 通过抑制吞噬体成熟、抑制吞噬体和溶酶体融合、抑制巨噬细胞凋亡、干扰抗原呈递、抑制自噬等,逃逸巨噬细胞对Mtb 的杀伤[10],但其具体机制和过程尚未阐明。 研究发现在活动性结核病人中,PD-L1 在中性粒细胞(PMN)和单核/巨噬细胞(Mo/MΦ)表达升高最显著,PD-L1 表达下降与活动性结核的好转有密切关系[11],体外实验发现:PD-1/PD-L1 通路阻断后,巨噬细胞对Mtb的吞噬和胞内杀伤活性明显增强[12],然而具体分子机制不明。 此外,PD-L1 是否有其他受体配体通路,目前尚未证实,因此探讨PD-L1 在Mtb 感染的巨噬细胞中的作用对结核防治的基础研究有重要意义。
本研究通过Cre-loxp 技术构建巨噬细胞特异性Pdl1 敲除小鼠模型,通过PCR 和流式细胞术检测证实巨噬细胞特异性Pdl1 敲除小鼠构建成功。 分离腹腔巨噬细胞,对Mtb 感染前后的不同敲除小鼠的巨噬细胞进行RNA-Seq 及生物信息学分析,结果表明:Mtb 感染的Pdl1 敲除巨噬细胞中基因表达谱发生改变,通过GO 和KEGG 富集分析,初步筛选出23个PD-L1 相关的候选基因,其中某些基因在肿瘤和病毒感染中已有相关报道,在人卵巢癌和结肠癌中,阻断PD-1/PD-L1 信号通路,可促进Th1 型趋化因子CXCL9 的分泌[13],促进效应T 细胞和自然杀伤(NK)细胞浸润,增强抗肿瘤效应。 在神经胶质瘤、黑色素瘤微环境中,CCL2、CXCL1、PTGS2 及CD40 的表达与PD-L1 的表达呈正相关[14-17],阻断PD-1/PD-L1 信号通路,可促进肿瘤相关巨噬细胞(TAM)释放促炎细胞因子IL6,增强Th1 免疫应答和抗肿瘤作用[18]。 在人丙型肝炎病毒(HCV)感染中,阻断PD-1/PD-L1 信号通路,可增强低表达TRAF1 的特异性CD8+T 细胞反应[19]。 如前所述,在结核分枝杆菌感染中,抑制PD-1/PD-L1 信号通路可促进小鼠肺泡巨噬细胞释放炎性因子IL6,增强先天免疫反应[12]。
通过KEGG 富集分析,发现与PD-L1 有关的通路包括Toll 样受体信号通路、NF-κB 信号通路、HIF-1 信号通路及TNF 信号通路。 在Mtb 感染初期,Toll样受体作为天然免疫细胞活化的调节剂发挥着重要作用,随后,Toll 样受体及信号通路对特异性细胞免疫产生影响。 此外,Toll 样受体信号通路亦参与调控结核菌免疫逃逸的发生,是导致结核慢性感染的根源所在[20]。 NF-κB 是一类重要的核转录因子,其活化可激活下游众多的细胞因子的转录,NF-κB信号通路和NF-κB 依赖性细胞因子在遏制结核菌感染中至关重要[21]。 HIF-1 是一种重要的转录因子,是由HIF-1α 和HIF-1β 组成的异源二聚体,其中HIF-1α 为主要的调节亚基,在缺氧、肿瘤及炎症情况下可广泛表达[22],是抗结核分枝杆菌感染的重要介质[23]。 TNF 信号传导通路主要包括Caspase 家族介导的细胞凋亡、衔接蛋白TRAF 介导的转录因子NF-κB 和JNK 蛋白激酶的活化,在抗结核感染中发挥重要作用[24]。
本研究通过GO 富集分析发现的免疫反应有关的17 个候选基因与KEGG 富集分析发现的免疫及炎症相关代谢通路的6 个候选基因,可能是结核感染中PD-L1 作用相关的特异性分子,后期将对这23个基因进行细胞水平和动物体内的验证和功能机制研究,为结核防治的基础研究提供线索。

