甲烷水合物6分子14面体(4668)笼型结构
苏金昌
苏金昌1
(大庆水合物研究中心,黑龙江 大庆 163453)

水分子簇;甲烷水合物;可燃冰;氢能;氢气水合物;水分子;氢键

1 H2O分子的结构
一般认为,在O原子参与分子组成时,与基态O原子(1s22s22p4)最外层6个电子密切相关,所以将2s22p4称作O原子价电子组态,其中的6个电子称作价电子,6个价电子中未参与成键的电子(非键电子)被视为处于价层能量最高的非键轨道里.按照这样的观点,CO,NO分子结构中O原子的端基各有1对非键电子(孤对电子),而H2O分子的O原子价层有2对非键电子.这样一来,CO,NO分子结构中O原子将作为质子的受体,与H2O分子中作为质子给体的H原子能形成分子间氢键(O—H┄O),理论上CO,NO都应该是易溶解于水的气体.但是,实验事实是CO,NO都是难溶解于水的气体,说明对CO,NO分子结构的认识可能与实际情况不符.再从轨道能角度看,O原子基态2s与2p轨道能量分别为-32.4,-15.6 eV,相差1倍多,不可能发生2s与2p轨道的杂化(不符合能量相近的轨道才能杂化的观点),O原子2s轨道内的电子不但很难参与成键,一般也不会成为价层内能量最高的电子.这样从实验事实和轨道能两方面表明,将O原子2s轨道电子视为价电子有失合理性,不能根据O原子有6个价电子描述有关含氧分子的结构.
杂化轨道理论认为,在多原子分子里,中心原子能量相近的轨道发生轨道杂化能提高成键能力,有利于形成相对稳定的分子.为此,在分析H2O分子的价键结构时,基于轨道能相差1倍的2s与2p轨道之间发生sp3杂化有失合理性,考虑O原子2p与3s轨道杂化成为必然的选择.按照H2O分子里的O原子发生p3s不等性杂化(2p43s0→(p3s)2(p3s)1(p3s)1(p3s)0),O原子用2个各占有1个电子的杂化轨道分别与2个H原子占有1个电子的1s轨道重叠,形成2个O—H键,而O原子另外2个杂化轨道没有参与成键,即水分子中氧原子的价层里有1个占有2个电子的非键轨道和1个非键空轨道(见图1).这样的结构特点,使H2O分子既能作为电子的接受体,又能作为电子的给予体.长期以来,人们一直机械地套用C原子2s与2p轨道的杂化方式,认为H2O分子里的O原子价层有2对非键电子,而忽视了O原子基态2s与2p轨道能相差1倍的事实.

图1 H2O的三维结构(O发生p3s杂化)
对于2个原子的分子,其轨道重叠成键没有空间阻碍,一般无需考虑轨道杂化的需要.当把O2分子里的O原子看成价层只有4个电子时,2个O原子直接用各自的3个2P轨道彼此重叠,就能分析出其分子结构里有1个2电子的键和2个3电子的π23键,而没有能量最高的非键电子对.这样的结构说明其不是质子的受体,不能与水分子形成氢键,与氧气不易溶于水的事实吻合.其中,3电子π23键的存在与其有顺磁性吻合.同样,对于CO,NO,O原子3个2P轨道(4个价电子)与C原子3个2P轨道(2个电子)、N原子3个2P轨道(3个电子)重叠时,CO分子里有1个2电子的键和2个2电子的π22键、没有孤对电子,NO分子里有1个2电子的键和1个2电子的π22键、1个3电子π23键、没有孤对电子,不是质子的受体,它们都不能与H2O分子形成氢键,与它们很难溶于水的事实是吻合的.
有关O4分子结构的认识一直存在争论,无论是四边形还是四面体结构[4],用已有理论都难做出合理的解释.认为在一定的条件下,通过诱发O原子发生p2s等性杂化(2p43s0→(p1(ps)1(ps)1(ps)1),则能形成三角形构型的O4分子.在这样的O4分子里,位于三角形中心的O原子与位于顶点的3个O原子形成3个O—O键、1个∏44键.很明显,这样的结构有较好的稳定性,特定条件下可以人工合成稳定的O4分子.有了这种高密度的氧就能为航天火箭提供更高效的助推剂.所以,合成稳定的O4分子有非常重要的意义.
由此可见,O原子价层里有4个电子的观点,将影响到对有关含O原子的分子结构的认识,也将影响到对有关物质性质的解释和合成方法的选择.这个观点的理论意义在未来的相关研究和应用中或许能表现出来.
氢桥键[5]观点认为,1个分子的X原子的X—H键的1对电子能与另1个分子X原子的空轨道共用,形成3原子、2电子(3c-2e)的X—H—X氢桥键.按照这样的观点,由于H2O分子新结构中氧原子有空轨道,水的H2O分子之间也能形成3c-2e的O—H—O氢桥键.但是,文献[6]在介绍氢的新键型和非常规氢键都没有提到2个O原子作桥头的3c-2e的O—H—O氢桥键.这其中的原因或许是受到了O原子按照sp3不等性杂化给出H2O分子的价键结构有2对非键电子的传统认知所束缚,使O—H—O氢桥键一直没有被发现.

图2 的氢桥键结构(O发生p3s杂化)

图3 的氢桥键结构(O发生p3s杂化)
按照氢键理论,1个H2O分子周围最多能被4个H2O分子包围而形成5H2O分子的水分子团,而江颖[8]团队的研究拍摄到了4个H2O分子的聚集态.对于这种4个H2O分子的聚集态,用氢桥环结构观点解释更合理.


图4 6分子14面体(4668)笼型结构

图5 5分子10面体(4564121)笼型结构
4 结语

[1] 樊栓狮,赵勇.天然气水合物研究现状与发展趋势[J].中国科学院院刊,2001(2):106
[2] 张建平,赵林,王林双.水分子簇中氢键的作用[J].化学通报,2005(68):137-142
[3] P Sylwia,D Jozef,M Leszek.Formation of Water Dimers in Exp andingAir Flows[J].Vacuum,2003,70:403
[4] 张秀杰,吴礼清,张宗.氧分子O4的结构性能的密度泛函数理论研究[J].计算机与应用化学,2011(4):481-486
[5] 陈光亚,胡满成,魏朔.无机化学(下册)[M].北京:北京师范大学出版社,2011
[6] 周公度.氢的新键型[J].大学化学,1999(14):8-17
[7] 北京大学.无机化学[M].4版.北京:高等教育出版社,2003
[8] 江颖.我国科学家拍摄到水分子内部结构[EB/OL].北京:科学网(2014-01-14)[2019-06-12].http://news.sciencenet.cn/htmlnews/2014/1/287617.shtm
[9] 胡春.甲烷水合物生成动力学研究[D].杭州:浙江工业大学,2000
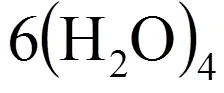
SU Jinchang
(Daqing Hydrate Research Center,Daqing 163453,China)

water cluster;methane clathrate;flammable ice;hydrogen energy;hydrogen hydrate;water molecule;hydrogen bon
O611.2
A
10.3969/j.issn.1007-9831.2020.04.015
1007-9831(2020)04-0069-05
2019-12-07
苏金昌(1962-),男,黑龙江哈尔滨人,研究员,从事气体水合物研究.E-mail:273638023@qq.com

