APPL1在心肌缺血再灌注损伤中作用的研究进展
赵 林,梁贵友
(1.遵义医科大学附属医院 心血管外科,贵州 遵义 563099;2.贵州医科大学,贵州 贵阳 550025)
体外循环 (Cardio-pulmonary bypass,CPB) 是临床上心脏外科心内直视手术必需的技术手段,心肌缺血再灌注损伤 (Myocardial ischemia reperfusion injury,MIRI) 是CPB后发生严重心功能障碍甚至死亡的主要因素之一,其主要表现为再灌注后心肌舒缩功能障碍、心律失常及因心功能障碍而引起的各种并发症。当缺血心肌恢复灌注时,称为再灌注,该过程中发生的心肌损伤,这种现象称MIRI[1]。其发生机制目前主要有心肌细胞凋亡、钙超载、心肌胰岛素抵抗、氧自由基(Reactive oxygen species,ROS)损伤等[2-7]。随着医学技术的不断提高,CPB术后心肌的保护措施不断完善,术后的并发症逐渐降低,但病死率仍然未达到临床所期,临床防治MIRI的效果仍需进一步提高。
APPL1 (Adaptor protein containing PH domain,PTB domain and Leucine zipper motif1) 是与脂联素受体1(AdipoR1)直接结合且重要的衔接蛋白,也是脂联素、脂联素信号传导通路中下游重要的传导介质, 脂联素诱导的AMPK途径必需将衔接蛋白APPL1与AdipoR1相结合后激活各种组织[8]。APPL1可以抑制心肌细胞凋亡、调节心肌的糖脂等能量代谢、增加胰岛素敏感性、减轻胰岛素抵抗的作用,而在心肌中发挥的这些作用可减轻MIRI[9-12]。因此,深入研究APPL1在缺血再灌注后心肌损伤中的保护作用显得尤为重要,APPL1或将成为MIRI预防及治疗的重要靶点。现就目前国内外文献有关APPL1在MIRI的作用及其机制作一综述。
1 APPL1的结构、分布及其生物活性特点
APPL1是Mitsuuchi在1999年发现的一种胞内结合蛋白,其人体的APPL1基因位于染色体3p14.3-21.1区,编码长度为709个氨基酸,APPL1有3个主要的功能区:Bar(Bin1 /amphiphysin/Rvs)结构域,Ptb(Phospho-tyrosine binding)结构域及Ph(Pleckstrin homology)结构域(见图1)[13]。它们主要参与转录抑制、凋亡以及分泌囊泡的融合、增强与GTP酶的结合、将蛋白锚定至特定的膜部位、衔接或支架的作用(见表1)。动物实验表明,APPL1的表达在心肌、脑、肝、骨骼肌、脂肪、肾脏等多种组织中都能检测得到[14-15]。

图1APPL1的结构
表1 APPL1的结构域及其作用

结构域主要作用BAR结构域感知和生成膜曲率、转录抑制、凋亡以及分泌囊泡的融合[15]PTB结构域在信号传导通路蛋白质结合过程中,发挥衔接或支架作用与AdipoR1/2结合,调节脂联素代谢[16]PH结构域与小GTP酶结合,在细胞内吞过程发挥作用[17]与BAR结构域相互作用,将蛋白锚定至特定的膜部位介导Reptin的核质穿梭,参与癌症的发生、发展[18]
2 APPL1通过抑制心肌细胞凋亡减轻MIRI
心血管外科体外循环术后MIRI过程中出现的心肌细胞凋亡也是加重MIRI的重要因素之一。ROS是诱发凋亡并引起缺血再灌注损伤的重要因素。MIRI主要通过三条途径产生氧自由基:黄嘌呤氧化酶途径、花生四烯酸代谢途径和线粒体呼吸链途径[19],线粒体是MIRI中ROS 产生的主要场所[20]。ROS的大量堆积导致心肌细胞膜上的脂质发生过氧化,膜蛋白和酶的功能及活性也受损,进而导致心肌细胞的凋亡。李波等[21]研究发现,脂多糖(LPS)处理心肌细胞后,APPL1信使RNA和蛋白的表达水平均显著降低、心肌细胞活力降低,细胞凋亡率增加、细胞调亡蛋白酶-3蛋白水平升高;而 APPL1过表达的心肌细胞活力增高、细胞凋亡减少,且氧化损伤较轻、抗氧化酶能力强且ROS水平低,因此,APPL1 可以降低心肌细胞的氧化损伤,减少细胞凋亡,从而减轻MIRI。
在细胞实验中需要构建人体心肌细胞缺血再灌注的基本模型,目前主要是由H9C2细胞通过缺氧后再复氧(Hypoxia-reoxygenation,HR)来实现[22]。正是利用这种模型,Park等发现APPL1发挥着抗细胞凋亡的作用,尤其是通过球状脂联素(Globular Adiponectin,gAcrp)介导的信号转导通路:在由HR引起的细胞内ROS中,抑制脂联素受体(AdipoR1)的表达后,APPL1与AdipoR1的结合率降低,显著抑制了APN(Adiponectin,脂联素)预防HR诱导ROS生成的能力;gAcrp通过AdipoR1/APPL1信号传导阻止细胞凋亡途径并增加抗氧化能力; gAcrp可阻止缺氧/再氧合诱导的ROS产生及细胞凋亡蛋白酶-3的活化,而沉默APPL1基因后gAcrp的上述表现发生显著减弱[23]。更有几项实验表明了APN可以明显地减轻MIRI以及慢性冠脉综合征所诱导的细胞凋亡[24-28]。孙冬冬等[12]研究发现,APN可上调APPL1的表达,在心肌缺血再灌注损伤过程中起到抗凋亡的作用,并促进心肌细胞存活。由此可见,APPL1可通过APN抗心肌细胞凋亡在MIRI中发挥保护心肌细胞的重要作用。
3 APPL1通过改善心脏微血管内皮功能障碍减轻MIRI
心脏微血管的内皮细胞是构成心肌微循环的最基本的结构,它不仅可以分泌内皮素,调节微血管直径以控制组织循环流量,而且还可通过旁分泌和自分泌功能,调节心肌的生长发育、组织代谢、收缩功能以及节律控制,当发生心肌缺血再灌注损伤时,还可分泌NO,保护心肌细胞[29];不仅如此,内皮细胞还表达AdipoR1,与脂联素直接结合,对胰岛素抵抗作用产生重要影响[30]。内皮素及NO主要由内皮细胞产生,内皮素的主要作用是收缩血管,而NO的主要作用是舒张血管,生理状态下,二者处于动态平衡,共同维持正常的内皮细胞功能[31]。血管内皮功能障碍表现为NO分泌减少,内皮依赖性血管舒张功能受损。血管通透性异常,血小板聚集,局部炎症反应,平滑肌增生及动脉粥样硬化等[32]。在体外循环心脏术后,发生的高血糖、高血脂刺激血管内皮时,NO释放减少或破坏增加而导致内皮功能紊乱,从而打破血管平衡稳态,最终导致一系列的心血管事件的发生,如心肌缺血再灌注损伤[31]。当心脏血流恢复时,在心肌细胞发生缺血再灌注损伤前,心脏微血管内皮细胞就已经受到了再灌注的损伤,也就是说,MIRI发生的第一步是心脏微血管内皮的损伤及功能障碍[33]。缺血和损伤的细胞释放大量的促炎介质,如白细胞介素、TNF-α等,使冠脉内皮细胞激活,激活的冠脉内皮细胞表面表达大量炎性黏附分子,介导白细胞的粘附反应和血小板的活化,从而加重心肌微循环障碍[34]。
心脏微血管内皮细胞表达AdipoR1,AdipoR1通过与脂联素结合后发挥作用[35],脂联素对血管内皮的急性功能障碍与慢性结构损伤均有保护作用[36]。而离体实验表明,在血管内皮细胞中,脂联素可抑制由高糖、高脂所诱发的炎症效应,逆转血管内皮的慢性结构损伤[35,37]。上述提及,AdipoR1作为APPL1上游的直接结合物,在体外循环心肌缺血再灌注损伤中发挥重要作用,且内皮功能障碍也是导致MIRI的重要原因,虽然目前国内外尚无文献报道APPL1与内皮功能障碍之间的直接关系,但我们可以推测,APPL1很可能通过改善心脏微血管内皮功能障碍,从而减轻MIRI。
4 APPL1通过调节糖、脂代谢减轻MIRI
脂联素(Adiponectin,APN)是一种改善胰岛素敏感性的增敏剂,其受体主要包括脂联素受体1(AdipoR1)、脂联素受体2(AdipoR2)及T-钙粘蛋白(T-Cadherin),在心肌细胞中AdipoR1是APN的主要受体,APPL1是AdipoR1的关键结合蛋白[38]。位于APPL1功能区的PTB 结构域可与AdipoR1的胞内段直接结合[39]。多项实验研究发现,AdipoR1与APPL1相互作用,可介导APN 在多种细胞内的多条信号的转导途径(见图2)[38-41]。
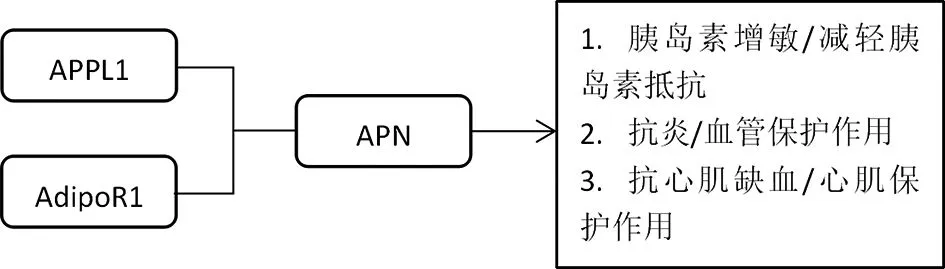
图2 APPL1与AdipoR1及APN的关系
APN的降糖作用是通过抑制糖异生来发挥效应,具体包括以下几点:促进葡萄糖和脂肪酸的消耗、增加乳酸的生成和乙酰辅酶A羧化酶的磷酸化[42]。AdipoR1和APN结合后调节糖代谢,而过氧化物酶增殖物激活受体α(PPAR-α)和AMP活化后的蛋白激酶(AMPK)在这个过程发挥了重要的作用;AMPK是一种蛋白激酶,在能量代谢中如同传感器,高度依赖AMP发挥作用[43]。AMPK参与了β氧化及葡萄糖的摄取过程,通过影响APN受体下游的信号通路,也可导致胰岛素抵抗[44]。在心肌组织中,APN可通过降低甘油三酯的水平、消耗葡萄糖、脂肪酸和ATP来改善胰岛素的敏感性[9]。在PPAR-α信号通路中,APN上调下游蛋白乙酰辅酶A氧化酶和CD36的表达,加快了脂肪酸的转运,并调节糖代谢,进而减轻了胰岛素抵抗[10]。
本课题组研究也发现,CPB后心肌损伤严重及心脏舒缩功能发生障碍,但通过补充APN后,AMPK的表达及磷酸化增加,心肌葡萄糖摄取率增加,心肌细胞损伤减轻;相反,特异性的抑制了AMPK的活性,APN的上述功能也受到了抑制[11]。因此,我们认为APPL1可通过APN增加AMPK活性的作用,增加心肌胰岛素敏感性并减轻胰岛素抵抗,进一步促进心肌对葡萄糖的摄取,从而减轻MIRI。具体的机制作用仍需进一步探索。
5 展望
越来越多的证据表明APPL1对心肌具有保护作用,当体外循环术后,刺激内源性APPL1的表达可能成为减轻MIRI的预防及靶向治疗方向。细胞实验证明了APPL1在MIRI中通过发挥抗凋亡作用保护心肌细胞[24,26];而且动物实验证明,APPL1的表达受到抑制后,APN减轻心肌缺血/再灌注损伤的作用显著减弱,主要体现在心肌梗死面积的扩大及左心室射血分数的降低[45]。此外,APPL1在脂肪组织中还可以通过与HDAC3相互作用,缓解胰岛素抵抗[46],但其与HDAC3在心肌中的胰岛素抵抗作用尚无相关研究。APPL1 在心力衰竭和糖尿病心肌病损伤中也发挥着重要的心肌保护作用[47-49]。但APPL1在人体心肌细胞中的作用,仍然有很多问题需要解决,主要有以下几个方面:① APPL1通过何种方式参与APN对AMPK的活化过程,怎样识别AdipoR1等机制并不清楚; ② 无论APPL1是在心肌能量代谢、胰岛素抵抗的作用,还是在抗心肌细胞凋亡中的作用,皆因其通过APN而发挥作用,是否APPL1还有其它途径来改善MIRI,目前国内外研究甚少;③ APPL1在MIRI中的作用及其机制,目前国内外的研究仍然停留在细胞和动物实验阶段,APPL1在人体内心肌缺血再灌注损伤中的表达及其作用并无相关研究。可见,想要更加细致的了解APPL1在人体心脏中的生物作用及其机制,并将其转化为预防及治疗MIRI的靶点,还有很长的路要走。随着在细胞、动物及人体中的研究不断的深入,APPL1或将成为防治MIRI潜在的药物作用的关键靶点,为心血管外科CPB术后并发症的临床治疗提供新的思路。

