黄芪多糖通过ANXA3诱导人结肠癌HT-29细胞凋亡
付远虹,吴 敏
(湖北省恩施土家族苗族自治州中心医院 手术室, 湖北 恩施 445000)
结肠癌(Colon cancer)是世界上最常见的恶性肿瘤之一,其发病率和死亡率均较高[1]。一般认为,结肠癌的发病机制主要与癌基因的激活和抑癌基因的失活有关[2]。以往研究表明,信号传导在结肠癌的病理过程和细胞存活中起着关键作用,通过调节局部免疫反应、炎症反应和巨噬细胞功能参与肿瘤的发生和发展[3]。膜联蛋白A3(ANXA3)在肿瘤细胞的形成、增殖、凋亡和信号转导中发挥重要作用;ANXA3表达水平的改变对肿瘤发生、发展、耐药性和转移有着重要的影响[4-5]。早期研究已提出,ANXA3在结肠癌细胞中高表达,并且还可作为诊断结肠癌的标志物[6-7],而其在结肠癌中的作用机制尚不清楚。寻找能够治疗结肠癌的药物已迫在眉睫。目前,已证实较多中药天然成分具有明显的抗肿瘤活性,并且引起的不良反应较低,其中包括豆科植物的提取物。
黄芪多糖(RSP)提取于豆科草本植物黄芪,具有抗肿瘤的药理活性[8]。RSP可通过抑制p38和JNK信号传导,进而诱导肿瘤细胞凋亡[9]。另外,ANXA3沉默还可抑制其下游信号JNK和p38传导,进而抑制肿瘤细胞增殖,诱导其凋亡[10-11]。因此,对ANXA3/JNK和p38信号传导进行抑制,可能成为治疗肿瘤的靶点。RSP对结肠炎具有显著的改善作用[12],但是其对结肠癌的影响尚未见报道。因此,本研究探讨RSP对人结肠癌HT-29细胞增殖和凋亡的作用,并观察其对ANXA3/JNK和p38信号通路的影响。
1 材料与方法
1.1 主要药品试剂 黄芪多糖(批号:C10297500)、HY-N0168(批号:MP50S)和MPT0B392(批号:RB392)均购自美国Sigma公司;Annexin V-FITC/PI(批号:KGA107)和CCK-8试剂盒(批号:WST-87)购自江苏碧云天生物技术研究所;Caspase-glot-3/-9活性测定试剂盒(批号:C1157)购买于美国Promega公司;BrdU试剂盒(批号:ab126572)购自上海Roche Diagnostics公司;total-PARP(t-PARP,批号:ab0128098)、Cle-PARP(批号:ab1028765)、Cle-caspase 3(批号:ab0032786)、ANXA3(批号:ab1100938)、p-p38(批号:ab2102946)、p38(批号:ab1126094)、p-JNK(批号:ab1109847)、JNK(批号:ab0918274)和β-actin(批号:ab0012893)购自英国Abcam公司。
1.2 主要仪器 单人超净台(苏州华新空调净化有限公司);细胞培养箱(上海医用分析仪器厂);Victor3 1420 Multilable Counter酶标仪(DX540,美国);SDS-PAGE凝胶电泳仪(型号DYCZ-24DN,北京六一仪器厂);成像系统(BIO-RAD,美国),FACS-Calibur流式细胞仪(BD公司,美国)。
1.3 HT-29细胞培养与药物干预 采用含10%胎牛血清的DMEM培养基培养,培养箱条件设置为5%CO2、37 ℃恒温,显微镜观察细胞生长至90%左右时,便传代培养进行后续实验。待细胞处于对数生长期时,采用RSP(0.5、1.0、2.0、4.0 mg/mL)、p38激动剂HY-N0168(2 μg/mL)和JNK激动剂MPT0B392(0.5 μg/mL)处理细胞后,进行后续实验。
1.4 ANXA3质粒转染 ANXA3 mimics和ANXA3 inhibitor质粒由武汉巴菲尔生物有限公司合成,采用Lipofectamine 2000试剂转染质粒至HT-29细胞,具体操作步骤严格按照说明书进行。将细胞分为4组:对照组、RSP组、RSP+ANXA3 mimics组和RSP+ANXA3 inhibitor组。
1.5 CCK-8实验 将对数期HT-29细胞接种于96孔板,每孔1×104个细胞,培养过夜,然后加入0.5、1.0、2.0、4.0 mg/mL的RSP处理细胞24、48、72、96 h后,弃去旧培养液,每孔加入100 μL含10 μL的CCK-8试剂的DMEM培养液,放入培养箱中继续孵育1.5 h,在酶标仪450 nm波长处检测细胞吸光度OD值,并计算细胞相对活力。计算公式如下:细胞相对活力(%)=OD实验组/OD对照组×100%。
1.6 细胞克隆数分析 将对数期HT-29细胞接种于6孔板,每孔1 000个细胞,培养过夜,然后加入0.5、1.0、2.0、4.0 mg/mL的RSP处理细胞6 d后,每2 天更换1次含RSP的新鲜培养液;然后对克隆细胞进行染色并计数。
1.7 BrdU ELISA实验 将对数期HT-29细胞接种于96孔板,每孔1×104个细胞,培养过夜;0.5、1.0、2.0、4.0 mg/mL的RSP处理细胞48 h后,加入BrdU试剂孵育12 h;再采用ELISA试剂盒检测BrdU偶联的细胞,操作步骤严格按照说明书进行。最后在酶标仪405 nm处测定其吸光度OD值。
1.8 流式细胞术 收集各组细胞,PBS清洗2次,收集细胞,采用2.0 mg/mL的PI染液和RNase I染色30 min,流式细胞仪立即检测细胞周期分布情况。另外,收集细胞,PBS重悬后,分别加入Annexin-V FITC和PI处理细胞(按照试剂盒操作说明书进行),最后用流式细胞仪检测细胞凋亡情况。
1.9 蛋白表达分析 收集各组细胞,每组加入200 μL的裂解液,置于冰上充分裂解30 min,4 ℃、12 000 rpm离心,收集上清。BCA法检测了上清中总蛋白浓度,每孔上样40 μg进行电泳分离,恒压70 V,电泳3 h。然后在恒流275 mA条件下电转70 min,5%脱脂牛奶封闭1 h后,将目的条带放入对应的一抗溶液(稀释比1∶1 000)中,4 ℃摇床孵育过夜。TBST洗膜3次,每次10 min,再把条带放入盛二抗(稀释比1∶3 000)的平皿中室温孵育1 h,TBST洗膜3次,每次10 min。加入4 mL的ECL显影液显色3 min,凝胶成像系统曝光。
1.10 Caspase活性试验 收集各组细胞,采用Caspase-glot-3/-9活性测定试剂盒检测Caspase-3/9活性,操作步骤严格按照说明书进行,酶标仪在405 nm处测定其吸光度值。
1.11 统计学分析 采用SPSS 19.0统计软件进行统计分析,组间比较采用单因素方差分析检验,两两组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 ASP降低HT-29细胞生长 与0 mg/mL的RSP组相比,不同浓度RSP处理细胞48、72、96 h后,细胞相对活力显著降低,并表现出时间和浓度依赖性(P<0.05,见图1A)。1.0、2.0、4.0 mg/mL的RSP干预HT-29细胞48 h后,细胞克隆数和BrdU ELISA吸光度值相比于0 mg/mL的RSP组显著降低(P<0.05,见图1B、C)。进一步对细胞周期分析发现,RSP诱导G1期细胞数明显增高,而S期和G2期细胞数则明显减少(P<0.05,见图1D)。
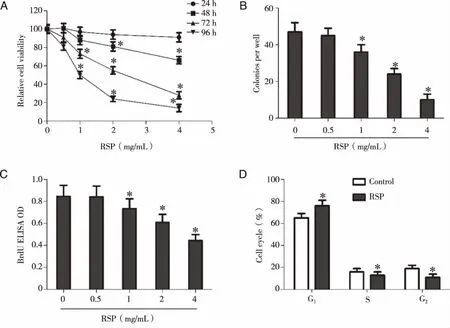
*:与0 mg/mL的RSP组或对照组比较,P<0.05。图1 RSP抑制HT-29细胞增殖
2.2 RSP诱导HT-29细胞凋亡 0.5、1.0、2.0、4.0 mg/mL的RSP干预HT-29细胞48 h后,能降低抗凋亡蛋白t-PARP表达水平,诱导促凋亡蛋白Cle-PARP和Cle-caspase 3表达(见图2A);Caspase-3和Caspase-9活性随着RSP浓度升高而增强(见图2B);与0 mg/mL的RSP组相比,1.0、2.0、4.0 mg/mL的RSP干预HT-29细胞48 h后,Histone DNA水平和细胞凋亡率显著升高,表现出剂量依赖性(F=7.564,P<0.05,见图2C、D)。
2.3 RSP抑制ANXA3/p38和JNK信号通路活化 与对照组相比,2 mg/mL的RSP处理HT-29细胞48 h后,其中ANXA3表达水平及p38和JNK磷酸化水平则显著降低,差异比较有统计学意义(P<0.05);然而,p38和JNK蛋白表达水平相比于对照组差异没有显著性(P>0.05,见图3)。
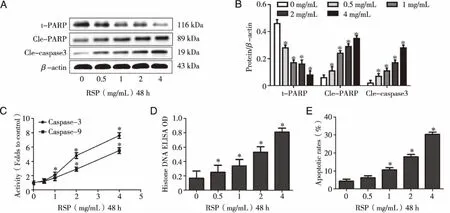
*:与0 mg/mL的RSP组比较,P<0.05。图2 RSP诱导HT-29细胞凋亡
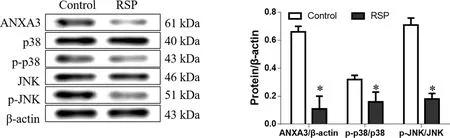
*:与对照组比较,P<0.05。图3 RSP对ANXA3/p38和JNK信号通路的影响
2.4 p38和JNK激动剂降低RSP对HT-29细胞生长的抑制作用 采用p38激动剂HY-N0168(2 μg/mL)和JNK激动剂MPT0B392(0.5 μg/mL)与RSP(2.0 mg/mL)共同处理HT-29细胞48 h后,发现RSP+HY-N0168和RSP+MPT0B392组细胞活力相对于单纯RSP组明显升高,而相比于对照组明显降低(P<0.05,见图4A);另外,RSP+HY-N0168和RSP+MPT0B392组细胞凋亡率相对于单纯RSP组明显降低,而相比于对照组明显升高(P<0.05,见图4B)。提示HY-N0168和MPT0B392能部分逆转RSP对HT-29细胞增殖的抑制作用。
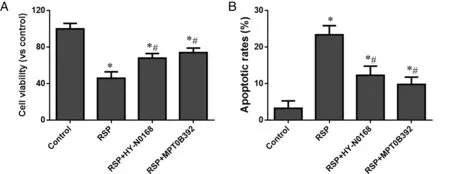
*:与对照组比较,P<0.05;#:与RSP组比较,P<0.05。图4 HY-N0168和MPT0B392对HT-29细胞增殖和凋亡的影响
2.5 ANXA3沉默和过表达改变RSP对HT-29细胞的影响 ANXA3 mimics和ANXA3 inhibitor质粒转染HT-29细胞,ANXA3 mimics能明显诱导ANXA3蛋白过表达,而ANXA3 inhibitor则显著沉默ANXA3蛋白表达(见图5A、B)。相比于单纯RSP组,RSP+ANXA3 mimics组p-p38和p-JNK表达水平明显升高,细胞活力明显升高,细胞凋亡率显著降低(P<0.05);RSP+ANXA3 inhibitor组p-p38和p-JNK表达水平明显降低,细胞活力明显降低,细胞凋亡率显著增高(P<0.05)。相比于对照组,RSP+ANXA3 mimics组p-p38和p-JNK表达水平明显降低,细胞活力明显降低,细胞凋亡率显著升高(P<0.05);RSP+ANXA3 inhibitor组p-p38和p-JNK表达水平明显降低,细胞活力明显降低,细胞凋亡率显著升高(P<0.05)。
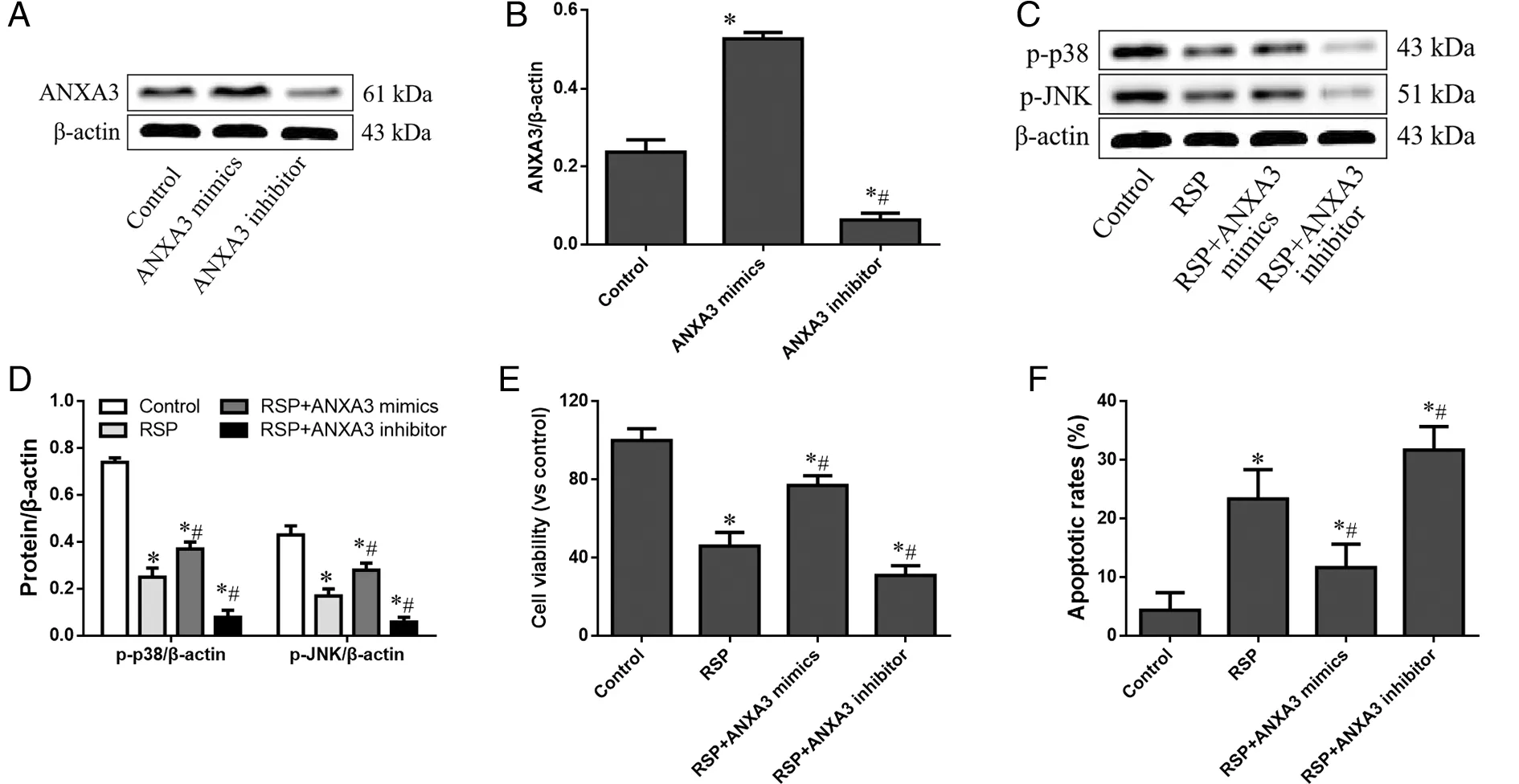
*:与对照组比较,P<0.05;#:与RSP组比较,P<0.05。图5 RSP通过ANXA3调节HT-29细胞生长
3 讨论
膜联蛋白(Annexins)是一种结构相关的钙依赖性磷脂结合蛋白,约占细胞总蛋白的2%[13]。膜联蛋白参与了膜输送和膜表面发生的一系列钙调素依赖性活动,包括囊泡的运输、胞吐过程中的膜融合、信号转导和钙通道的形成;另外,还可以调节炎症反应、细胞分化和细胞骨架蛋白之间的相互作用。膜联蛋白在肿瘤的发生发展过程中,可介导细胞信号通路、细胞运动、肿瘤侵袭转移、血管生成、细胞凋亡和耐药性等[14]。
Annexins A3(ANXA3)是膜联蛋白超家族成员,ANXA3基因位于染色体4q13-q22上,蛋白质由323个氨基酸残基组成[15]。ANXA3表达水平的变化可能对肿瘤的发生发展、耐药性和转移有重要影响。研究表明,ANXA3在胰腺和大肠癌组织中的表达明显高于良性组织,在前列腺癌组织中的表达明显低于良性前列腺组织[16]。这些发现表明,ANXA3可以作为一个潜在的肿瘤诊断、治疗和预后的生物标志物。另外,p38和JNK信号分子与结肠癌的发生发展密切相关,它们主要参与细胞增殖、迁移、分化、凋亡及炎症[17]。研究发现ANXA3可通过激活肝癌干细胞中JNK信号通路活化,进而促进肿瘤的形成[18];ANXA3沉默还可抑制其下游信号p38传导,进而诱导肿瘤细胞凋亡[11]。
RSP具有较强的抗肿瘤活性,但对结肠癌的相关研究较少。本文实验结果提示,RSP能抑制HT-29细胞增殖、诱导其凋亡。对其作用机制研究发现,RSP降低抗凋亡蛋白t-PARP表达、诱导促凋亡蛋白Cle-PARP和Cle-caspase3表达,还降低了Caspase-3/9活性,最终阻滞HT-29细胞生长,促使其凋亡发生。早期也有研究提示,RSP可通过诱导Caspase-3和Caspase-9蛋白表达,促使肝癌细胞凋亡[19]。既往研究提出,RSP可通过抑制JNK信号传导起着抗炎的作用,还可通过抑制p38降低caspase依赖的细胞凋亡[9]。本文发现,RSP可抑制HT-29细胞中p38和JNK磷酸化,发挥抗结肠癌的药理活性。本实验进一步采用p38激动剂、JNK激动剂与RSP共同干预HT-29细胞,发现它们可以部分逆转RSP对细胞增殖的抑制作用及对细胞凋亡的诱导作用,说明RSP可通过p38和JNK信号通路调节结肠癌细胞生长。
ANXA3作为p38和JNK的正向调节子,其高表达可降低RSP对p38和JNK磷酸化的抑制作用;对ANXA3进行沉默可增强RSP对p38和JNK磷酸化的抑制作用。说明RSP通过抑制ANXA3表达,进而降低p38和JNK信号传导。ANXA3过表达还可部分逆转RSP对HT-29细胞增殖的抑制作用,导致其凋亡的降低;ANXA3沉默则促进RSP对细胞增殖的抑制作用,导致其凋亡的增高。
综上所述,RSP可通过抑制ANXA3/p38和JNK信号通路诱导结肠癌细胞的凋亡,为结肠癌的治疗提供了新思路。

