TGF-β1调控哺乳动物睾丸发生的研究进展
王婷婷,张继东
(遵义医科大学 免疫学教研室暨贵州省基因检测与治疗特色重点实验室,贵州 遵义 563099)
睾丸形成及精子发生是一个精细、复杂的过程,需要各种细胞之间复杂的信号通路进行调控,包括各种基因、蛋白、激素、细胞因子的相互作用[1]。Wnt、TGF-β、Notch、Hedgehog均能够调控睾丸发育和精子发生,而且TGF-β1与上述四条经典通路密切相关[2-3]。TGF-β1信号通路中的许多配体在哺乳动物睾丸形成以及精子发生过程中发挥关键作用。新生期睾丸中,包括Nodal、TGF-β、Activins和BMP在内的几种配体在调节雄性生物学功能、生殖细胞增殖以及睾丸血管形成等起到重要作用,其中TGF-β1在胚胎期睾丸的形成以及发育中可调节睾丸生殖细胞的增殖和分化,也可通过调节支持细胞增殖和分化来决定睾丸的大小。Sarraj等利用 Tgfbr3(TGF-β共受体)敲除小鼠研究发现,睾丸生精小管的基膜非常薄而且不具有连续性,由此可以说明TGF-β1对睾丸生精小管的形成起着重要的作用[4]。此外,TGF-β1超家族信号传导对于睾丸形成不可或缺,当TGF-β1信号通路发生异常后,会导致睾丸病变,而且也会导致男性生育能力的降低[5-6]。
1 TGF-β1信号通路
TGF-β信号通路超家族包括30多种不同配体类型的TGF-β/Activin/Nodal和BMP蛋白家族,以旁分泌或自分泌方式激活Ⅰ型和Ⅱ型受体丝氨酸/苏氨酸激酶(分别为TGF-βRI/II and BMP-RI/II)典型信号后,通过激活SMAD转录因子(R-SMADs)相应的通路进行传导,这些通路与其他受体系统一起形成广泛的信号转导通路。在典型的信号传导中,I型受体参与R-SMADs的磷酸化,包括SMAD2/ SMAD3/TGF-β/ Activin/ Nodal信号通路和BMP信号通路中的SMAD1/5/8。R-SMADs与SMAD4相互作用进行核移位,并与不同的DNA结合转录因子相互作用,这些途径调控多种细胞的生长、发育以及生理过程[7]。TGF-β1是一种调节多种细胞活动和病理生理过程的多效性细胞因子[8]。
众所周知,TGF-β1/SMAD诱导的经典信号通路中,TGF-β1首先直接与TβR-2结合形成相应的复合物,然后TGF-β1构象可以发生改变,被TβR-1识别之后,结合形成了TβR-2-TGF-β-TβR-1的一个三聚体的复合物,其中复合物中的TβR-1可以被TβR-2磷酸化,其底物将信号放大,并且进一步向下游传递,此为配体与受体的重要结合方式,由此称之为募集式[9]。当在细胞膜上的TβR-1和TβR-2受体同时表达时,他们与配体的亲和力能够达到最大的作用效果[10]。如图1所示,该信号通路是通过配体与TGF-βII 型受体结合而启动后,活性TNβRI激酶催化TGF-β/激活素受体调节的SMAD(AR-SMAD:即SMAD2和SMAD3)磷酸化。这两个磷酸化的AR-SMAD与SMAD4形成三元的复合物,然后转移到细胞核中,形成的该复合物,可以与其它相应的几种辅助因子以及转录因子共同彼此作用,用来调控TGF-β1的靶基因[10-12]。在生命活动中,TGF-β1信号通路调控众多细胞间作用,发挥重要的生物学效应,包括细胞增殖、分化、凋亡以及迁移等[13]。
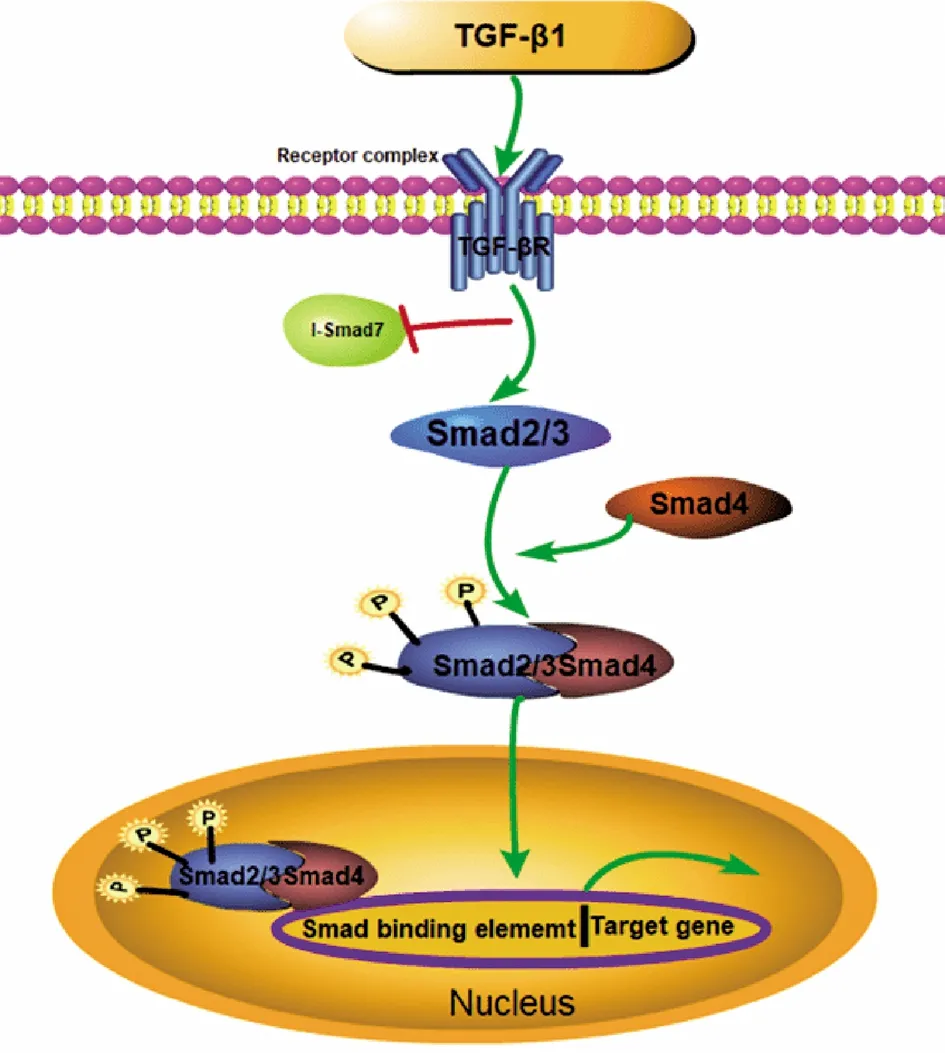
图1 TGF-β1信号通路图示意图
2 TGF-β1信号通路介导的生物学功能
TGF-β1及其下游分子 SMAD 可以调节大鼠睾丸的功能,而且对大鼠精子的发生、发育及其成熟的过程都起着关键性的作用,TGF-β1表达于大鼠睾丸体细胞中的支持细胞的胞质、早期精母细胞以及圆形精子细胞,而且有研究表明TGF-β1及其受体在哺乳动物睾丸中的表达具有种属特异性,表达水平根据睾丸的不同发育阶段不同,并与生精上皮发育的周期性有关[14-18]。成年羊驼睾丸的TGF-β1表达于体细胞中的支持细胞、睾丸间质细胞、管周肌样细胞以及各级生精细胞,并且能够调控羊驼精子发生以及睾丸发育是通过旁分泌和自分泌的形式进行的,而且对维持生精小管的结构与功能也起着关键的作用[19]。在睾丸组织中,TGF-β1调节多种细胞过程,包括睾丸间质细胞和支持细胞的激素分泌功能、管周肌样细胞功能蛋白的表达、睾丸发育及精子发生[20]。生精小管示意图(见图2)。
2.1 TGF-β1对支持细胞的作用 支持细胞(Sertoli细胞)位于生精小管内皮,它是组成生精上皮的极其关键成分,它的细胞基部与生精上皮的基底相互连接,顶部可伸长至腔面。Sertoli细胞的数量决定了雄性生殖细胞的产量,每个支持细胞支持固定数量的生殖细胞[21],也能将精子形成过程中产生并被遗弃的胞质残余部分进行吞噬与清除,位于Sertoli细胞间的重要结构,即:紧密连接(TJ),主要由相连的支持细胞形成,直接参与血-睾屏障(blood-testis barrier, BTB)的构成[22],BTB能够将一些有毒有害物质隔离在生精小管外部,防止其进出生精上皮而产生精子抗原,避免启动体内免疫系统所产生自身免疫反应,因此为生精细胞的发生、发育、成熟建立了一个相对安全且稳定的微环境[23],同时提供必须的营养和结构支持,TGF-β1对大鼠支持细胞增殖、分化、凋亡及紧密连接相关蛋白表达也具有促进作用[24]。
支持细胞一直被描述为精子发生的关键细胞[25-26],睾丸支持细胞是TGF-β1作用的靶细胞[27],TGF-β1在调节未成熟睾丸细胞发育过程中呈现时间-浓度依赖性,表明TGF-β1与正常生精上皮发育是有密切关系的,Sertoli细胞被卵泡刺激素(FSH)作用后,在功能上呈剂量依赖性。加入TGF-β1后则降低了它的促性腺激素的作用[28],TGF-β1能够明显减少Sertoli细胞中FSH诱导的cAMP水平[29-31],Sertoli细胞TGF-β1调节的机制远比最初想象的复杂,支持细胞中的TGF-β1水平的减少,能够阻碍生殖细胞发育[32]。胚胎期支持细胞中SMAD4的缺失,可以抑制精小管索的形成,导致胚胎期睾丸索发育不全和成年期轻度睾丸发育不全,如睾丸变小、部分生精小管发育不全、精子产生量低等疾病的发生[33-34]。进一步的研究则需要从遗传模型来揭示TGF-β1信号通路对调节睾丸发育的完整性和形态学的机制进行研究。
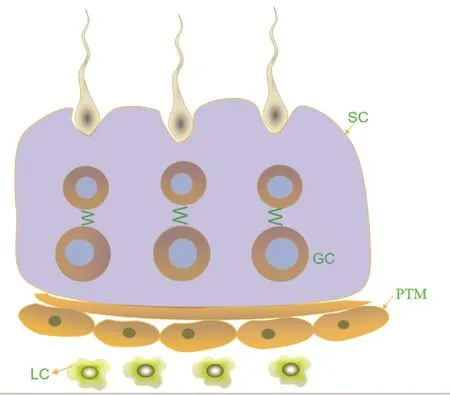
支持细胞 (Sertoli cell,SC );生殖细胞(Germ cell, GC);管周肌样细胞( Peritubular myoid cell,PTM);睾丸间质细胞(Leydig cell,LC);TGF-β1可以促进SC cells增殖、分化、凋亡及紧密连接相关蛋白和基因的表达;TGF-β1对性腺发育中GC具有促进作用;TGF-β1对LC调节雄性激素水平有作用;TGF-β1可以促进PTM cells对曲细精管基底层的调节。图2 生精小管结构示意图
2.2 TGF-β1对管周肌样细胞的作用 管周肌样细胞(PTM)定位于内皮细胞的内腔侧和外膜成纤维细胞的腔侧,分别覆盖着不同的小血管和大血管[1],并且沿着血管形成。超微结构研究表明,管周肌样细胞缺乏致密体,而且肌丝较少,通过TGF-β1对PTM细胞增殖和DNA合成H-脱氧胸腺嘧啶摄入的实验分析发现,TGF-β1虽然不能促进管周肌样细胞的增殖,但可通过抑制TGF-β1引起管周肌样细胞DNA的合成,此外,TGF-β1主要通过Ⅰ型受体的介导,促进细胞外基质(extra-cellular matrix,ECM)沉积[35],从而来激活PTM的 PAI-1(plasminogen activator inhibiter-1)。管周肌样细胞分泌的 PAI-1 与支持细胞分泌的 PA(plasminogen activator)发挥协同作用,共同调节血睾屏障的形成和功能。TGF-β1也可通过对管周肌样细胞的刺激来增加功能蛋白的产生,包括蛋白聚糖、胶原蛋白以及纤粘连蛋白。其能够增加细胞外基质,并且这些物质是构成基底膜的关键构成组分,由此可以说明TGF-β1能够参与、调节管周肌样细胞对曲细精管基底层的作用[36]。
2.3 TGF-β1对睾丸间质细胞的作用 睾丸间质细胞(Leydig 细胞)的主要作用就是调节雄性激素水平,大约98%的雄性激素都是间质细胞所调控的。雄性激素的产生不仅取决于间质细胞的功能,而且还取决于间质细胞的数量。在大鼠中,睾丸间质细胞的发育过程中可以分为四个阶段:干细胞(在整个生命周期内)、祖细胞(在出生后第21天)、未成熟细胞(在出生后第28~35天)和成年间质细胞(在出生后第56天之后)[37]。哺乳动物睾丸间质细胞的分化从胚胎期11.5 d开始,这也需要TGF-β1信号通路的调控。利用显微注射技术将TGF-β1受体抑制剂注射入模型大鼠睾丸间质内,可以有效阻断TGF-β1在模型大鼠睾丸间质细胞的表达[38-39],同时抑制剂明显减少了大鼠精子密度和降低了精子活力以及快速前向运动精子率(A级)、快速运动精子率(B级),并且在高倍镜下观察发现,抑制剂组模型大鼠睾丸TGF-β1表达减少,精子生成的数量减少,TGF-β1受体表达可以提高精子质量,同时也能够增加血清性激素水平[40],TGF-β1可以调节成年大鼠睾丸间质细胞雌二醇(E2)的合成[39]。TGF-β1在衰老圆形精子细胞中的表达随着时间的延长而增加。出生35天小鼠中Leydig细胞表达TGF-β1较弱,而出生50天Leydig细胞TGF-β1表达较强,出生75天间质细胞表达下降。在Leydig细胞中,TGF-β1依赖于信号传导途径中的I型受体发挥刺激和抑制作用[41],其在小鼠睾丸功能和生殖细胞发育中起重要作用[42]。TGF-β1同时也参与了睾丸间质细胞周期的调控,在小鼠睾丸间质细胞中,TGF-β1与孕酮协同作用可促进细胞增殖,其中低剂量的TGF-β1与孕酮协同参与了睾丸间质细胞肥大、增生的过程,因此TGF-β1的表达与一些男性不育的睾丸病理疾病密切相关,如:精子生成不足,就与睾丸间质细胞的增生和肥大有关[43-44]。
哺乳动物睾丸间质细胞在分泌生长因子和激素方面起着重要作用,也在促进睾丸生殖功能和调节睾丸局部微环境具有关键性作用,睾丸间质细胞产生的睾丸激素对男性生殖系统的发育和维持男性一生的生殖功能至关重要,成人睾酮缺乏导致的症状包括对情绪障碍相关神经递质的影响,体脂增加和疲劳,以及肌肉质量、认知功能和免疫反应减少,睾酮也具有抗抑郁和抗焦虑作用,睾酮水平较低与严重抑郁障碍的患病率增加有关,睾酮治疗还可能增加心血管并发症、睡眠呼吸暂停、红细胞增多症和前列腺癌的风险[45-46],低睾酮的临床表现包括性欲丧失、勃起功能障碍和继发性特征改变[47]。睾酮的合成量与黄体生成素(LH)和绒毛膜促性腺激素(HCG)的量呈正相关。TGF-β1介导了未成熟的大鼠睾丸间质细胞的LH的生成量,将TGF-β1加入到胚胎期小鼠睾丸间质细胞的培养液中,可使睾酮的基础产量减少,同时 LH 诱导产生的睾酮量也降低[48]。TGF-β1对猪和大鼠原代培养的睾丸间质细胞睾酮含量影响的研究,发现睾酮合成的抑制作用主要发生在细胞膜上,并且可以抑制LH与HGG 诱导的cAMP产生 ,同时抑制 cAMP介导的睾酮生物合成。而且TGF-β1可以通过抑制睾酮的分泌来影响类固醇合成,能够抑制 Leydig 细胞的增殖,此外还参与调控 Leydig 细胞由未成熟状态向成熟状态转变的细胞分化过程,是其对睾丸 Leydig 细胞功能调控的一种重要机制。
2.4 TGF-β1对其他细胞的作用 TGF-β1 是免疫系统重要的调控因子,也是代表性的抗炎和免疫抑制细胞因子,可促进肿瘤细胞的免疫逃逸[49-50]。在前列腺癌组织中,间充质干细胞分泌 TGF-β1,导致免疫细胞抑制,诱导肿瘤细胞的发生[51]。在睾丸局部感染时,通过改变TGF-β1分泌的量和作用方式,来调节睾丸间质细胞使其发挥免疫调节作用。TGF-β1通过体内和体外实验模型证明在性别特异性生殖系的分化中起作用[52]。睾丸间质主要包括睾丸间质细胞、树突状细胞、巨噬细胞及其他免疫细胞[53]。形态学分析表明 TGF-β1也表达于睾丸间质中的巨噬细胞,巨噬细胞可通过分泌TGF-β1参与睾丸免疫微环境及正常生精的调控[54]。TGF-β1在精子顶体后区、颈部及尾中部均有所表达[55-56]。TGF-β1对睾丸细胞的抗氧化防御机制的调节中起着关键作用[57]。TGF-β1敲除小鼠睾丸生殖细胞数量减少,因其在性腺发育中对生殖细胞具有一定作用且TGF-β1对睾丸生殖细胞瘤与精子减少症具有影响[58-59],当TGF-β1表达异常是可致睾丸损伤,影响雄性发育功能[60]。
3 展望
TGF-β1在生理和病理过程中必不可少,转录后调控基因表达发挥功能,如细胞增殖、分化、凋亡、伤口愈合、纤维化、炎症以及组织的发育、分化和修复等均受TGF-β1调控[61-62]。越来越多的证据表明,TGF-β1与人类众多疾病的发生发展密切相关,它与睾丸形成和精子发生异常的各种疾病相关,包括不孕症、性发育障碍和睾丸发育不全综合症的易感性TGF-β1信号通路调控。因此,阐明 TGF-β1的信号传导通路在睾丸发育及精子形成中的调节作用及机制,有助于不孕不育诊断、严重程度判断和预后评估,并成为其潜在的治疗靶点。我们课题组在三维立体培养体系中可以选择TGF-β家族受体抑制剂(SB431542、Alk5 inhibitor)进行研究TGF-β信号通路中的smad2,smad3以及smad5分子之间的关系。目前缺乏可以阻止或逆转睾丸生殖疾病进展的有效治疗方法。提高对TGF-β1信号通路分子机制的认识,亦将有助于发现生殖疾病治疗的新策略。

