183个耳聋高危家庭孕前致聋基因变异分析及遗传咨询
李琼 梁鹏飞 王淑娟 李薇 王剑 邱建华 查定军
空军军医大学西京医院耳鼻咽喉头颈外科
耳聋是一种常见的出生缺陷,我国新生儿先天性耳聋的发生率约为1/1000-3/1000[1,2]。2006年,第二次全国残疾人抽样调查数据显示,我国听力言语残疾者人数为2780万[3],耳聋严重影响我国出生人口素质及患者生活质量,给患者家庭与社会带来沉重的负担。遗传因素、环境因素或者两者共同作用导致耳聋的发生,其中遗传因素占50%以上[4,5]。因此,如果在婚前或孕前对有生育需求的育龄夫妇进行遗传性耳聋基因检测及相关遗传咨询,可以明确遗传学病因,为该家庭的生育计划进行风险评估,有效预防聋儿出生。
1 研究对象和方法
1.1 研究对象
选取2009年3月至2018年7月在空军军医大学第一附属医院耳鼻咽喉头颈外科聋病基因诊断中心就诊的183对夫妻,共366个受检者。其中男183例,女183例,均为育龄且有生育需求的家庭。每位自愿接受基因检测的患者,明确其非综合征性感音神经性耳聋诊断,经知情告知并签署知情同意书后,进行纯音听阈测试、声导抗、耳声发射(DPOAE)、听性脑干反应(ABR)、言语识别率、眼震电图(ENG)、前庭诱发肌源电位(VEMP)以及颞骨CT扫描等多项检查,按照要求采集患者基本信息、耳聋病史、母亲孕产期情况、耳毒性药物使用史、头部外伤史、传染病史、家族史等相关信息,建立详尽的病历档案,进行标本采集,行孕前耳聋基因检测。
1.2 研究方法
1.2.1 外周血采集与处理
采集受试者外周静脉血2-3mL,2.0mg/mL EDTA.K2抗凝,统一编号,无菌保存待检。所有血样使用康为世纪血液基因组非柱式提取试剂盒CW0544M进行DNA提取,使用博奥生物有限公司微型分光光度计检测DNA浓度及纯度。置于-20℃冰箱保存备用,避免反复冰融。
1.2.2 耳聋基因测序
根据NCBI提供的相关基因标准序列,针对GJB2基因全序列、SLC26A4基因编码区内的20个外显子及剪切位点和线粒体DNA 12S rRNA含1494和1555位点的序列,运用Primer 5.0软件设计引物[6],对目的DNA片段进行PCR扩增(PCR反应程序、温度、时间等参数设置参考文献[7]),并送至西安擎科泽西生物科技有限责任公司进行Sanger测序。
1.2.3 测序结果分析
应用SeqMan软件将测序结果与NCBI提供的人类SLC26A4、GJB2及线粒体DNA 12S rRNA的标准序列进行比对,并利用Chromas软件结合测序峰图,分析是否存在变异位点。若发现变异位点,重新进行PCR扩增、反向测序以及序列比对,进行验证。确定变异位点后,在http://deafnessvariationdatabase.org/以 及 http://davinci.crg.es/deafness/网 站 上进行比较,明确变异位点是否为已知致病变异。
2 结果
在183对受检夫妻中,124对夫妻检测到致聋基因变异,占67.76%(124/183);90对夫妻有生育耳聋患儿的风险,占49.18%(90/183)。
2.1 研究对象统计
所有受检者均为单纯耳聋或听力正常人员,不合并其他疾病,排除了综合征性耳聋及感染所致耳聋。受检者年龄分布在17~46岁之间,通过参看听力学报告并结合语声测试法评估受检者听力情况,聋人 62 例,占16.94%(62/366),非聋人304例,占83.06%(304/366)。受检者家族史及生育史等相关信息如表1所示。
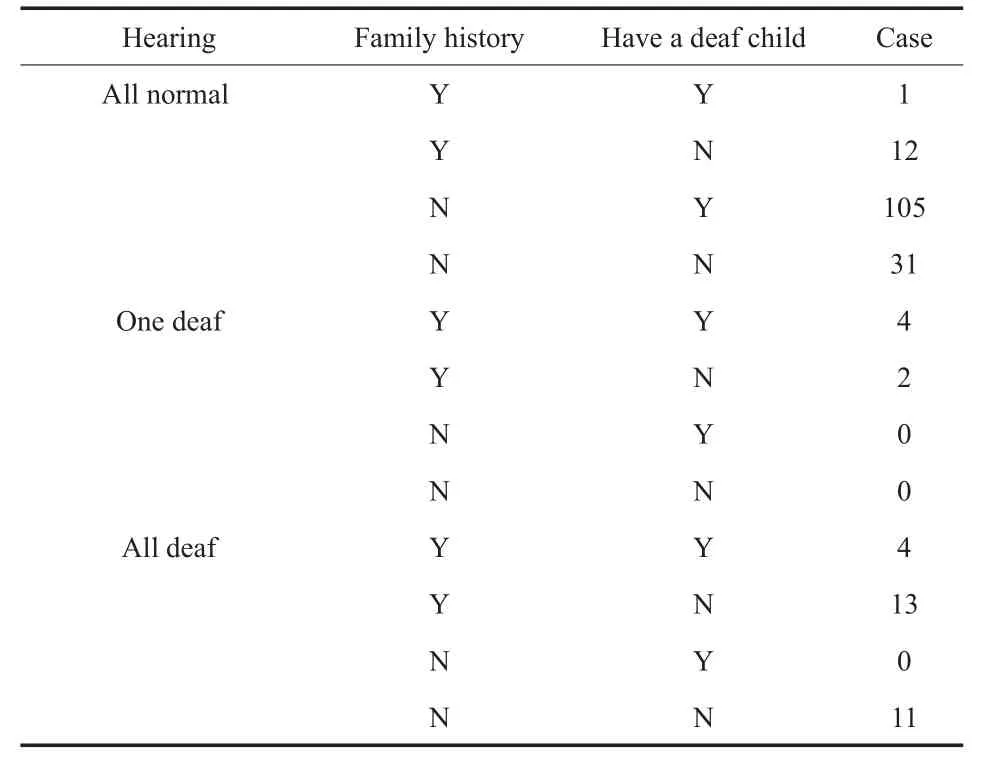
表1 受检者听力情况、家族史及生育史Table 1 Subject's hearing,family history and birth history
2.2 GJB2基因变异检测结果
本研究共检出17种GJB2基因变异方式;有64对夫妻携带GJB2基因致病性变异,占34.97%(64/183);有43对夫妻有生育GJB2双等位基因变异耳聋患儿的风险,占23.49%(43/183);有21对夫妻虽携带GJB2基因致病变异,但并无生育耳聋患儿的风险,其后代仅为GJB2基因致病变异携带者,占11.48%(21/183)。
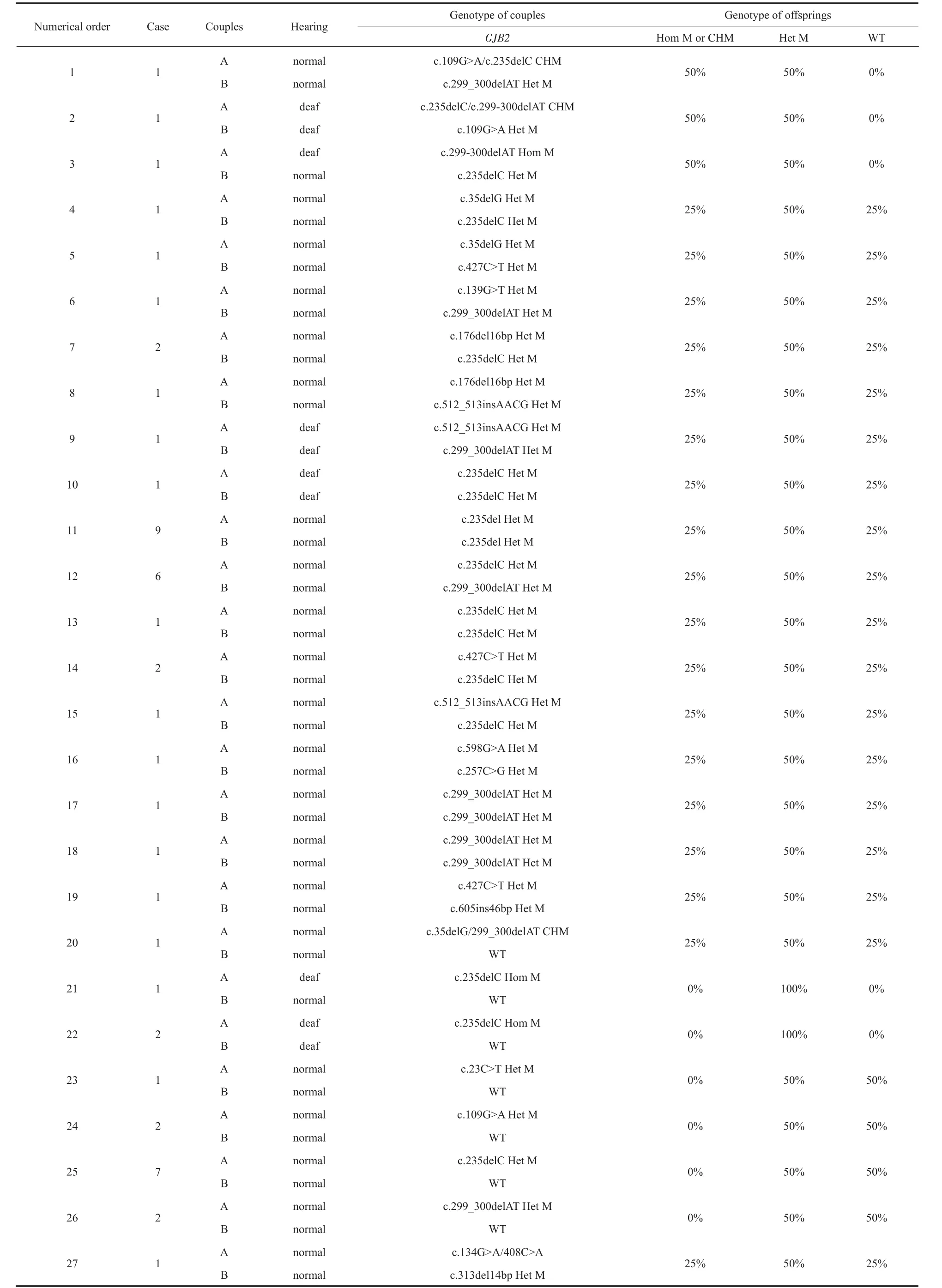
表2 GJB2基因变异检测结果Table 2 GJB2 genetic variation test results
2.3 SLC26A4基因变异检测结果
本研究共检出41种SLC26A4基因变异方式;有68对夫妻携带SLC26A4基因致病性变异,占37.16%(68/183);有44对夫妻有生育SLC26A4双等位基因变异耳聋患儿的风险,占24.04%(44/183);有24对夫妻虽携带SLC26A4基因致病变异,但并无生育耳聋患儿的风险,其后代仅为SLC26A4基因致病变异携带者,占13.11%(24/183)。
2.4 线粒体12S rRNA基因变异检测结果
本研究共检出6对夫妻有线粒体12SrRNA m.1555 A>G均质变异,占3.28%(6/183);有4对夫妻,其妻子为m.1555 A>G均质变异,后代将遗传此突变,占 2.19%(4/183);有 2对夫妻,仅丈夫为m.1555 A>G均质变异,此突变将不会遗传给后代1.09%(2/183)。
2.5 多个基因共同变异检测结果
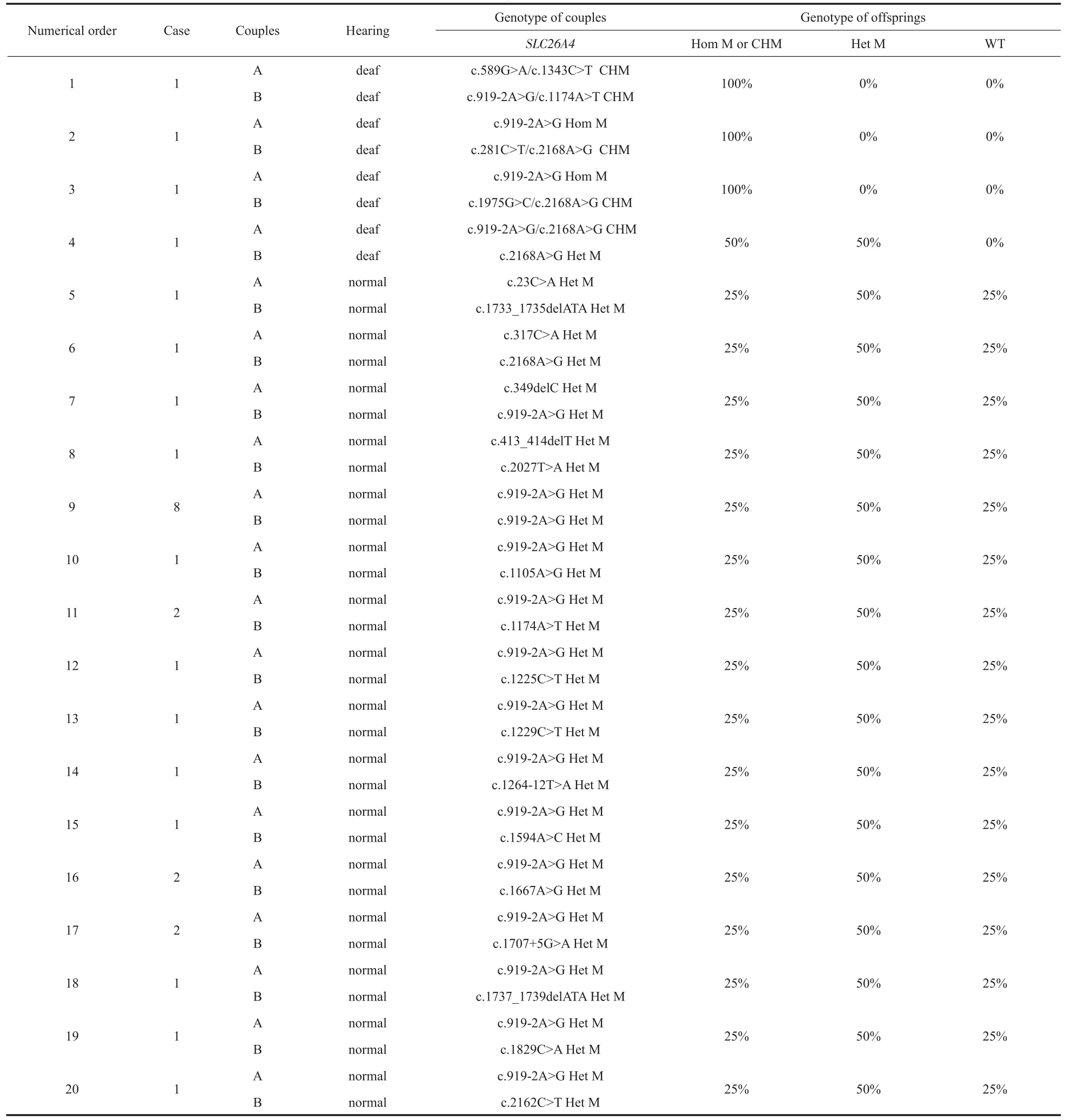
表3 SLC26A4基因变异检测结果Table 3 SLC26A4 genetic variation test results
本研究共有14对夫妻同时携带两种基因的变异。其中,有12对夫妻同时携带SLC26A4及GJB2基因变异;有1对夫妻同时携带SLC26A4及线粒体12SrRNA基因变异;有1对夫妻同时携带GJB2及线粒体12SrRNA基因变异。在这14对夫妻中,有10对夫妻有生育耳聋患儿的风险,有4对夫妻虽携带多个基因的致病变异,但并无生育耳聋患儿的风险,其后代仅为SLC26A4或/及GJB2基因致病变异携带者。

表3 下半部分
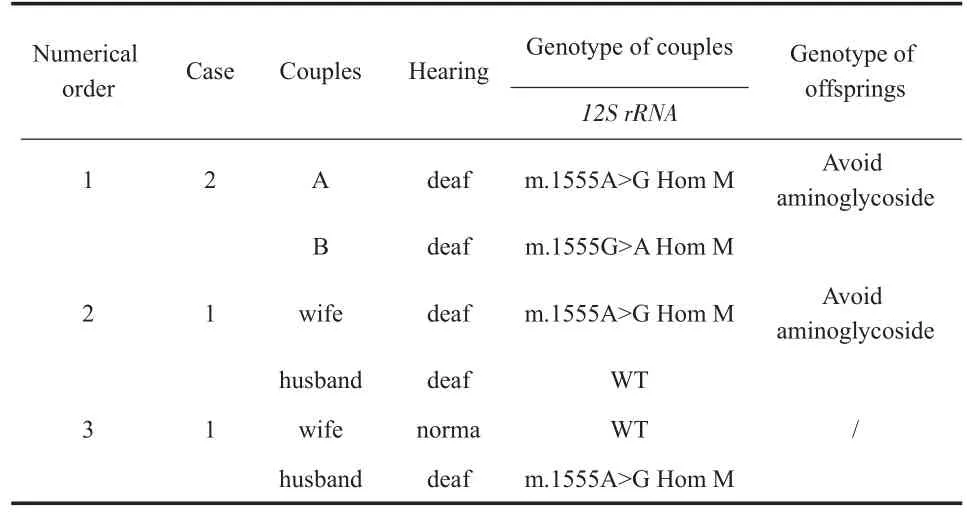
表4 线粒体12S rRNA基因变异检测结果Table 4 Mitochondria 12S rRNA genetic variation test results
3 讨论
遗传性耳聋包括综合征性耳聋(syndromic hearing loss,SHL)和非综合征性耳聋(non-syndromic hearing loss,NSHL)两大类,我国自2003年开始的全国大范围聋病分子流行病学调查研究数据显示,GJB2、SLC26A4、线粒体12SrRNA(m.1555A>G和m.1494C>T)是导致我国非综合征性耳聋患者发病最常见的三个基因[8,9],在耳聋人群中的携带率分别为 21%[10]、14.5%[11]、3.4%和 0.6%[12]。本中心前期调查研究结果显示,陕西省GJB2、SLC26A4和线粒体12SrRNA致病变异发生率分别为23.88%、18.88%和2%[7],与全国及西北地区流行病学调查数据相比较为一致。
GJB2基因编码缝隙连接蛋白26(connexin 26,Cx26),在信息传递及物质交换中起着重要作用,若发生变异会使钾离子无法回流至内淋巴液,导致耳聋[13]。该基因大部分变异方式表现为隐性遗传,约50%的非综合征性常染色体隐性遗传性耳聋患者携带GJB2基因变异[14],是非综合征性耳聋最常见的遗传基因。本研究中,64对夫妻检出GJB2致病变异,其中46对夫妻检出GJB2 235delC变异,占71.88%(46/64);43对夫妻有可能生育GJB2双等位基因变异的后代,其中14对夫妻有生育GJB2 235delC纯合变异后代的风险,占32.56%(14/43),符合235delC为中国地区最常见GJB2基因变异的结论[15-17]。
SLC26A4基因编码Pendrin蛋白,若发生变异会使Pendrin蛋白的合成和功能受到影响,引起Pendred综合征[18]及前庭导水管扩大[19]。前庭导水管扩大患者联系内耳和颅腔的通道异常肿大,感冒、碰撞等可引起颅内压变化的因素,均会导致患者听力下降,在这类患者中SLC26A4基因变异检出率高达97%。本研究中,68对夫妻检出SLC26A4致病变异,其中42对夫妻检出919-2A>G变异,占61.76%(42/68),符合c.919-2A>G变异在SLC26A4基因变异中最常见的报道[20,21]。
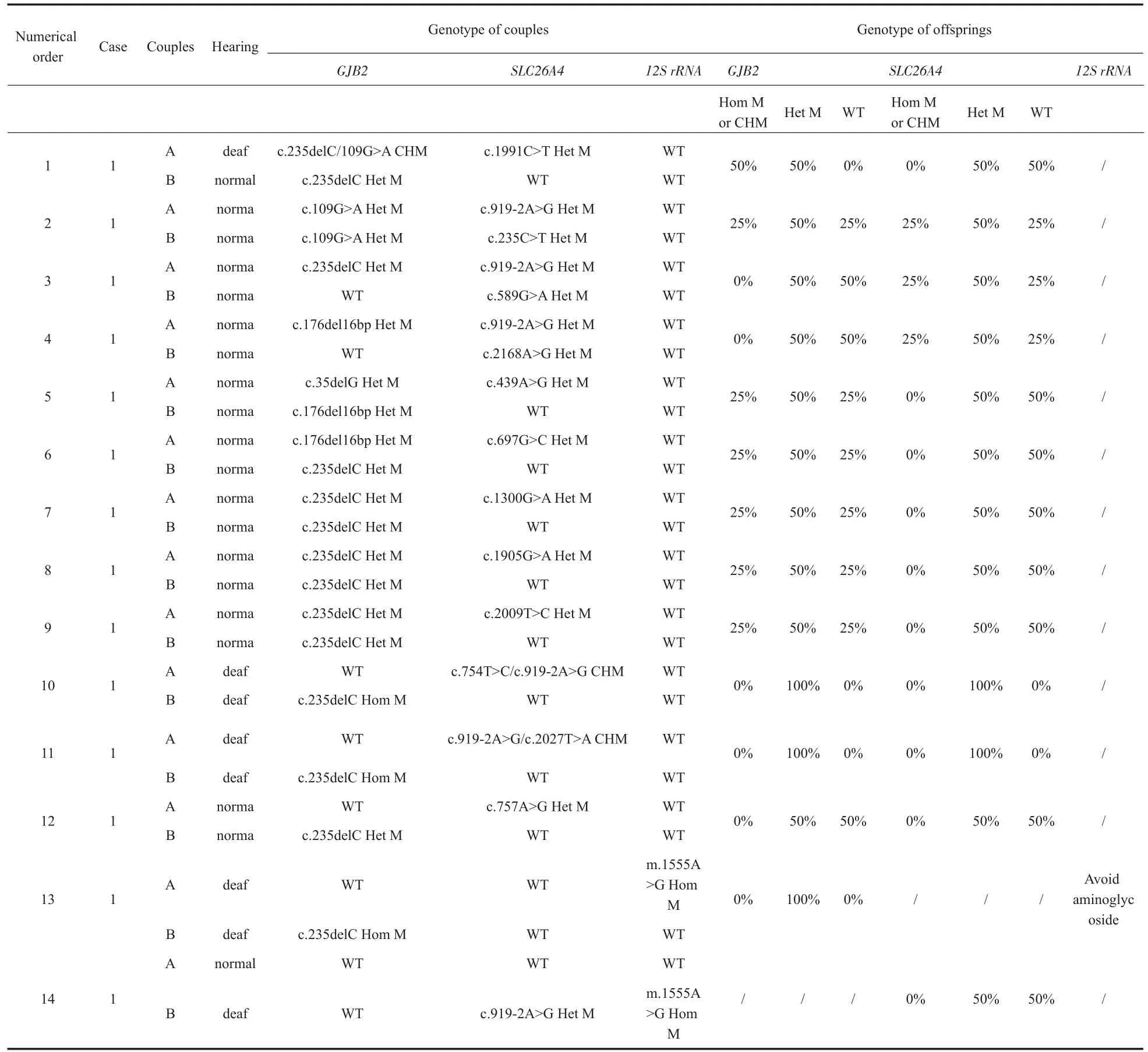
表5 多个基因共同变异检测结果Table 5 Multiple gene common variation test results
线粒体12S rRNA m.1555A>G及m.1494C>T阳性个体变异后,对氨基糖苷类抗生素异常敏感,药物耳毒性不呈现剂量依赖,极少用量即可致聋[22]。该变异具有母系遗传特征[23],可通过母亲传给后代,后代中女性将变异继续传至下一代。
目前,耳聋基因检测常采用手段有耳聋基因芯片、Sanger测序以及高通量测序等。随着技术的发展更新和耳聋基因及致病位点的逐步明确,耳聋基因检出率不断提高。耳聋基因芯片法具有快速、高效、成本低、准确率高等优点,在耳聋基因检测中广泛应用。本研究采用Sanger测序法对GJB2、SLC26A4及线粒体12SrRNA的1494和1555位点等进行耳聋基因检测,共检出59种致聋基因变异,覆盖的位点远高于最常用的基因芯片法的9个位点。所有受检者中,共有62例聋人,其中37例检出耳聋基因变异,检出率为59.68%(37/62);共有304例非聋人,其中180例检出耳聋基因变异,检出率为59.21%(180/304),高于利用基因芯片法对耳聋高危人群进行检测的致聋基因检出率,如张旭等报道的43.6%[24]、胡煜等报道的44.1%[25]和王荷溪等报道的55.2%[26]。
本研究通过耳聋基因检测,明确有生育需求的夫妻双方耳聋基因的变异类型,以此为依据,分析其生育耳聋患儿的风险,提供精准恰当的遗传咨询,防止耳聋患儿出生,降低遗传性耳聋发病率[26]。值得注意的是,本研究进行的孕前耳聋基因诊断以及生育风险评估,均基于夫妻双方已经明确的耳聋基因变异。导致耳聋的因素众多、病因复杂且目前已知的耳聋基因成百上千。若受检者GJB2、SLC26A4及线粒体12SrRNA三种基因均正常,并不能代表该受检者不携带耳聋基因,也不能代表其后代无耳聋风险。需进一步进行家系调查、环境因素调查并扩大进行其他耳聋基因变异的检测,以防漏诊。
例1:表2中的1号家庭,受检者为夫妻双方,男方29岁,女方26岁,陕西西安人,二人均为极重度感音神经性耳聋患者,且颞骨CT均显示双侧前庭导水管扩大。检测结果显示,男方为SLC26A4c.589G>A/c.1343C>T复合杂合变异,女方为SLC26A4 c.919-2A>G/c.1174A>T复合杂合变异。告知该夫妻SLC26A4基因的遗传规律,预测其后代必定为SLC26A4复合杂合变异,即二人生育的后代100%面临耳聋风险。不建议该夫妻进行生育,或可选择供精方式生育后代。
例2:表5中的11号家庭,受检者为夫妻双方,男方30岁,女方29岁,陕西渭南人,二人均为极重度感音神经性耳聋患者,男方诊断为双侧前庭导水管扩大。检测结果显示,男方为SLC26A4c.919-2A>G/c.2027T>A复合杂合变异,女方为GJB2 c.235delC纯合变异。告知该夫妻SLC26A4基因及GJB2基因的遗传规律,预测其后代必定为SLC26A4及GJB2基因杂合变异携带者,但并不影响听力,可生育听力正常后代。其后代成年后进行婚配时,其对象需进行耳聋基因检测,避免同证婚配生育耳聋患儿。
例3:表5中的13号家庭,受检者为夫妻双方,男方30岁,女方32岁,陕西西安人,二人均为极重度感音神经性耳聋患者,男方先天性耳聋,女方4岁前听力正常,因使用氨基糖苷类药物致聋。检测结果显示男方为GJB2 c.235delC纯合变异,女方为线粒体12SrRNA m.1555A>G均质变异。告知该夫妻GJB2基因及线粒体DNA的遗传规律。预测其后代必定为GJB2基因杂合变异,且线粒体12SrRNA m.1555A>G为母系遗传,线粒体基因及环境因素等共同作用决定后代的听力状况,线粒体DNA无法通过产前诊断预测胎儿表型,其后代需要谨慎使用氨基糖苷类药物,并密切观察听力变化。
例4:表2中的27号家庭,受检者为夫妻双方及第一胎聋儿,男方37岁,女方35岁,陕西渭南人,夫妻二人听力正常,育有一子为极重度感音神经性耳聋。检测结果显示,聋儿为GJB2 c.134G>A/408C>A/c.313del14bp变异,男方为GJB2c.313del14bp杂合变异,女方为GJB2 c.134G>A/c.408C>A双位点变异。女方虽携带有2个已知的GJB2致病性变异,但由于2个变异位于同一条DNA链上,等同于GJB2单杂合变异,所以听力正常。告知该夫妻GJB2基因的遗传规律,预测若生育二胎,25%几率为GJB2野生型,50%几率为GJB2杂合变异携带者,25%几率为GJB2双等位基因变异,即有25%几率生育聋儿。
我国每年约有2000万孕龄夫妇生育,估算每年新增聋儿3万以上,对家庭和社会均造成沉重负担,防聋治聋工作形势严峻,任务艰巨。为减少出生缺陷,WTO提出了三级预防策略。以此策略为理论基础,构成了先天性耳聋的三级防控体系[28]。目前新生儿听力及耳聋基因筛查[29,30]、听障儿童听觉言语康复(三级预防)和耳聋基因产前诊断(二级预防)研究较多,先天性耳聋防控已取得一定的效果。对重点怀疑和高危人群的耳聋基因筛查及婚育指导(一级预防)需进一步加大推进力度,对耳聋高危人群进行基因筛查与诊断、提供个性化的遗传咨询以及婚育指导,可有效实现遗传性耳聋的一级预防[31],从根本上降低先天性耳聋患儿的出生率,杜绝遗传性耳聋的发生,最终实现优生优育。

