新型PET心肌灌注显像剂18F-MyoZone对大鼠心肌细胞的摄取作用及其机制
王雅雯,赵祚全,韩凯,张宗耀,方纬
北京协和医学院中国医学科学院阜外医院核医学科,北京 100037
随着我国老龄化进程的加快,冠心病的发病率及死亡率持续上升[1]。美国心脏病协会(American Heart Association,AHA)及欧洲心脏病学会(European Society of Cardiology,ESC)均将核素心肌灌注显像作为冠心病诊断、危险分级及治疗决策的重要方法[2-3]。随着正电子发射断层显像(positron emission computed tomography,PET)技术的逐步推广普及,对新型PET心肌灌注显像药物的发展也提出了新的要求[4]。
目前, 常用的P E T 心肌灌注显像剂为15O-H2O、13N-氨水及82Rb,三者半衰期分别为2 min、9.96 min及76 s,必须配备昂贵的回旋加速器或正电子核素发生器,成本高,难以推广普及。18F的半衰期较长(约109.8 min)、能量适中、空间分辨率高、便于进行商业化配送,是较为理想的正电子标记核素。目前,国内外评价最高的18F标记心肌灌注显像剂为18F-Flurpiridaz,由于其心肌摄取较高、邻近非靶器官摄取较好,且在整个血流范围内能达到线性的心肌摄取[5-11],被誉为心肌灌注显像领域里程碑式的发现,现已进入Ⅲ期临床试验阶段。本研究的新型心肌灌注显像剂18F-MyoZone与18F-Flurpiridaz同属于哒螨灵衍生物,相比于18F-Flurpiridaz,18F-MyoZone水溶性更强,从而降低了血液本底及心脏邻近非靶器官的摄取[12-13]。 该类显像剂通过被动扩散富集于心肌细胞的线粒体中,达到特异性评价心肌血流的目的[14]。但目前18F-MyoZone与心肌细胞的作用机制尚未经过系统性研究。本研究通过体外放射自显影、心肌细胞摄取实验及酶活性测定验证了18F-MyoZone为线粒体复合体Ⅰ(mitochondrial complex Ⅰ,MC-Ⅰ)抑制剂,为进一步阐明18F-MyoZone的作用机制提供实验依据。
1 材料与方法
1.1 实验仪器、试剂及材料 SpectraMax 190微孔板酶标仪(Molecular Devices公司),CM1850冷冻切片机(Leica公司),CRC-55tR活度计(CAPINTEC.INC公司),Cyclone Plus放射自显影仪(PerkinElmer公司),2480 WIZARD自动伽马计数仪(PerkinElmer公司),CO2细胞培养箱(Thermo公司)。线粒体复合体Ⅰ活性检测试剂盒(Cayman MitoCheck® Complex Ⅰ Activity Assay),鱼腾酮(北京伊诺凯科技有限公司),哒螨灵(上海阿拉丁生化科技股份有限公司),19F-Flurpiridaz(北京先通国际医药科技股份有限公司),19F-MyoZone(北京先通国际医药科技股份有限公司;19F-MyoZone不具有放射性,其他性质与18F-MyoZone一致,非放射性实验研究采用19F-MyoZone)。新生大鼠原代心肌细胞(北京爱思益普生物科技股份有限公司)。
1.2 研究药物制备 制备18F-MyoZone的18F离子由原子高科股份有限公司提供,MyoZone前体由北京先通国际医药科技股份有限公司提供,18F-MyoZone的标记、纯化、质量鉴定按照文献[15]的方法进行。
1.3 实验动物 SPF级健康成年SD大鼠,雌性,5周龄,由北京维通利华实验动物技术有限公司提供。动物许可证号:SCXK(京)2016-0006;合格证编号:No.1100111911069732。饲养条件:温度24~26 ℃,湿度约56%,通风换气,自由进食饮水。本实验动物处置流程获得阜外医院伦理委员会审核批准。
1.4 方法
1.4.1 抑制线粒体呼吸链酶活性机制的研究 使用Cayman MitoCheck® Complex I Activity Assay试剂盒,以不同浓度的19F-MyoZone(起始浓度15 μmol/L, 3倍稀释,稀释12个点)与试剂盒中线粒体复合物混合物室温(25 ℃)孵育20 min后,再与线粒体复合物酶活性反应底物混合物混匀,置于酶标仪读板机中,在Kinetic模式下读取340 nm吸光度(OD)值(25 ℃,每隔30 s读一次,连续读15 min),获取线粒体复合物酶活性反应率,测定其抑制线粒体呼吸链酶活性的半数抑制率(IC50)。数据分析以吸光度值为Y轴、时间为X轴做直线图,斜率为反应率,结果以线粒体呼吸链酶复合物的活性表示,采用以下公式计算,并采用Graph Pad prism软件进行统计分析及绘图。
线粒体呼吸链酶复合物活性(%)=(实验孔反应率/对照孔反应率)×100%。
1.4.2 与MC-Ⅰ结合的放射自显影研究 ①4种抑制剂的竞争结合实验:大鼠心肌组织切片用生理盐水或不同的抑制剂(4 μmol/L鱼藤酮、4 μmol/L19F-Flurpiridaz、4 μmol/L19F-MyoZone及4 μmol/L哒螨灵)100 μl孵育30 min后,除去孵育溶液,再加入100 μl18F-MyoZone溶液(10~30 kBq,20 nmol/L)孵育30 min。清洗切片后,置于暗室中经储磷屏曝光5~20 min。上述实验平行重复一次。②竞争结合剂量依赖实验:采用鱼藤酮及19F-MyoZone作为抑制剂,设为两组(一组为鱼藤酮抑制剂组,一组为19F-MyoZone抑制剂组)。每组抑制剂浓度采用0、20 μmol/L、2 μmol/L、200 nmol/L及20 nmol/L。 每张组织切片上加100 μl体积的上述抑制剂溶液进行孵育30 min。然后除去上述溶液,在切片上均加入60 μl18F-MyoZone溶液(约12 kBq,20 nmol/L)孵育30 min。清洗切片后,置于暗室以储磷屏显影10 min,扫描曝光后胶片的显影结果采用ImageJ 1.52a软件进行分析。将每组的平行对照放射性计数率(counts per minute,CPM)视为100%,按以下公式计算抑制剂各浓度的抑制率。抑制率(%)=(1-CPM抑制剂/ CPM对照)×100%。
1.4.3 鱼藤酮抑制心肌细胞对18F-MyoZone的摄取研究 体外培养新生大鼠原代心肌细胞,以不同浓度的鱼藤酮(0、0.1、0.3、1、3、10、30 nmol/L及0.1、0.3、1、3、10 μmol/L)孵育15 min。完成后加入18F-MyoZone(约17 kBq)50 μl,孵育30 min。收集裂解液,对其进行放射性计数,计算鱼藤酮的抑制剂量。采用Graph Pad prism软件进行统计分析及绘图。
1.4.4 心肌细胞的外流实验 体外培养新生大鼠原代心肌细胞,加入18F-MyoZone(约37 kBq)500 μl,孵育30 min后弃去上清液并清洗,再加入500 μl培养基后置培养箱中孵育。依照各时间点(0、10、20、30、60、90、120、150 min)依次收集细胞上清液及裂解液,测定放射性计数,计算心肌细胞外流的放射性占比。数据分析以细胞上清液中的放射性计数为细胞外流的药物,细胞裂解液中的放射性计数为细胞内的药物,两者之和为放射性总量。按以下公式计算细胞的胞内及胞外放射性占比。每组数据3个复孔。采用Excel软件进行统计分析及绘图。胞内占比(%)=[CPM裂解/(CPM上清+CPM裂解)]× 100%;胞外占比(%)=[CPM上清/(CPM上清+CPM裂解)]× 100%。其中,CPM裂解=细胞裂解液的计数率;CPM上清=细胞上清液的计数率。
2 结 果
2.118F-MyoZone的制备 制备的18F-MyoZone注射液无色澄清,制备总时长为70 min,校正的放射化学产率为47%~58%,产物的放射化学纯度>98%。
2.2 抑制线粒体呼吸链酶活性机制的研究19F-MyoZone对线粒体呼吸链酶活性的抑制结果显示,19F-MyoZone可作用于线粒体MC-I,影响线粒体呼吸链酶活性。孔板1-5中,线粒体酶活性受到不同程度的抑制;随着加入19F-MyoZone浓度的增高,抑制程度加重;孔板6-12中较低浓度的19F-MyoZone对线粒体酶活性的抑制不明显(表1)。19F-MyoZone对线粒体呼吸链酶复合物的酶活性抑制曲线(图1)显示,随着19F-MyoZone浓度的增高,线粒体呼吸链酶活性呈现降低趋势,两者之间存在剂量依赖性;19F-MyoZone抑制线粒体复合物酶活性的IC50为229.9 nmol/L。
2.318F-MyoZone与MC-Ⅰ结合的放射自显影研究 ①4种抑制剂的竞争结合实验结果显示,未加任何抑制剂的对照组大鼠心肌组织切片上均有明显的放射性浓聚,表明18F-MyoZone可与心肌组织结合。而加抑制剂组(不同的抑制剂+18F-MyoZone孵育)均出现了放射性摄取的减少,4种抑制剂均可竞争18F-MyoZone与MC-Ⅰ的结合,抑制率为13.2%~52.2%(图2)。②鱼藤酮及19F-MyoZone剂量依赖性的竞争抑制结果显示,改变鱼藤酮或19F-MyoZone的浓度,心肌组织切片上的放射性摄取随着抑制剂浓度的升高而减少,鱼藤酮对18F-MyoZone与心肌组织结合的抑制率随着浓度的增加而增大(0%~51.5%),19F-MyoZone对18F-MyoZone与心肌组织结合的抑制率也随着浓度的增加而增大(0%~40.2%),均呈剂量依赖关系(图3)。
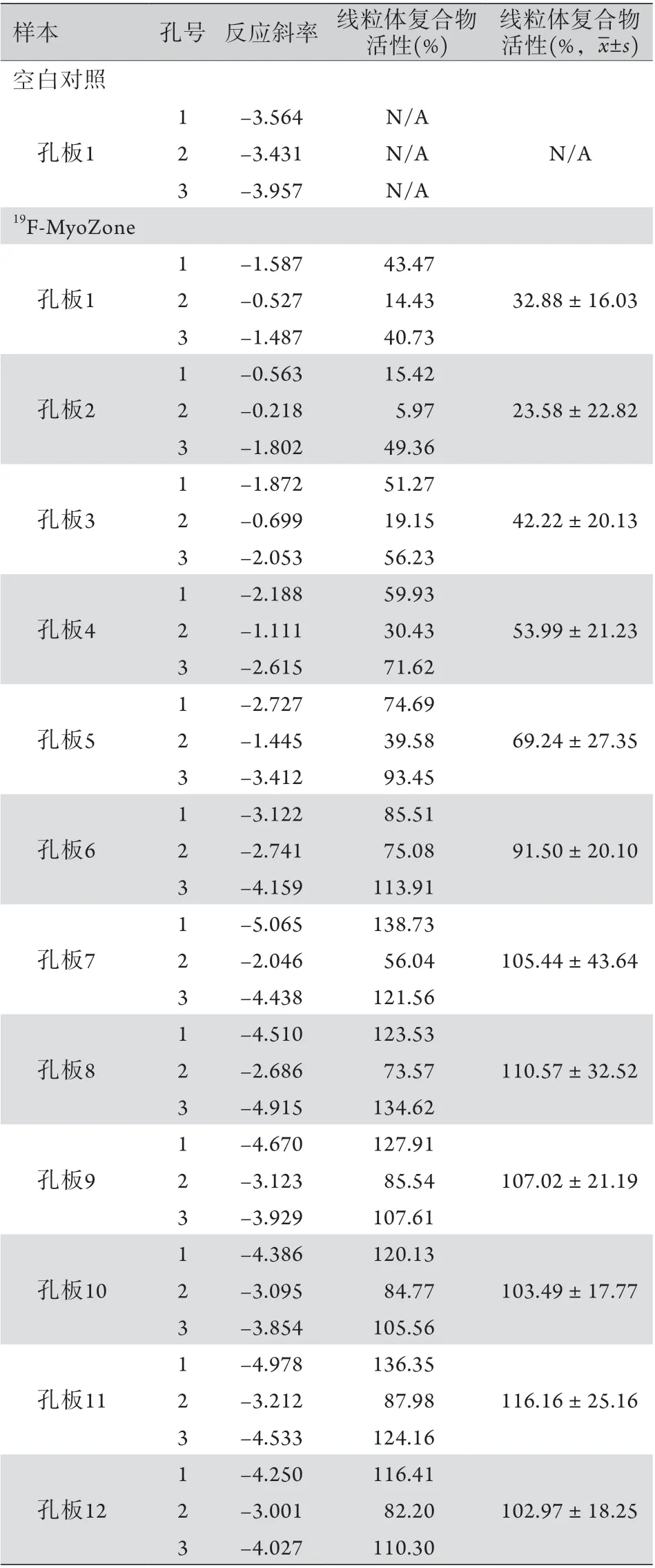
表1 19F-MyoZone反应斜率及线粒体呼吸链酶复合物活性Tab.1 Slopes of 19F-MyoZone reaction and activities of mitochondrial respiratory chain enzyme complex

图1 19F-MyoZone对线粒体呼吸链酶复合物的酶活性抑制曲线Fig.1 The enzyme activity inhibition curves of 19F-MyoZone on mitochondrial respiratory chain enzyme complex
2.4 鱼藤酮抑制心肌细胞对18F-MyoZone的摄取研究 鱼藤酮对心肌细胞摄取18F-MyoZone的实验结果显示,未加抑制剂的心肌细胞中有较高的放射性摄取值,随着抑制剂浓度的升高,心肌细胞中的放射性摄取值逐渐减少(表2),表明18F-MyoZone可被大鼠心肌细胞摄取,该摄取可被鱼藤酮所抑制,并且呈剂量依赖性。计算得出抑制剂的IC50为7 nmol/L (图4)。
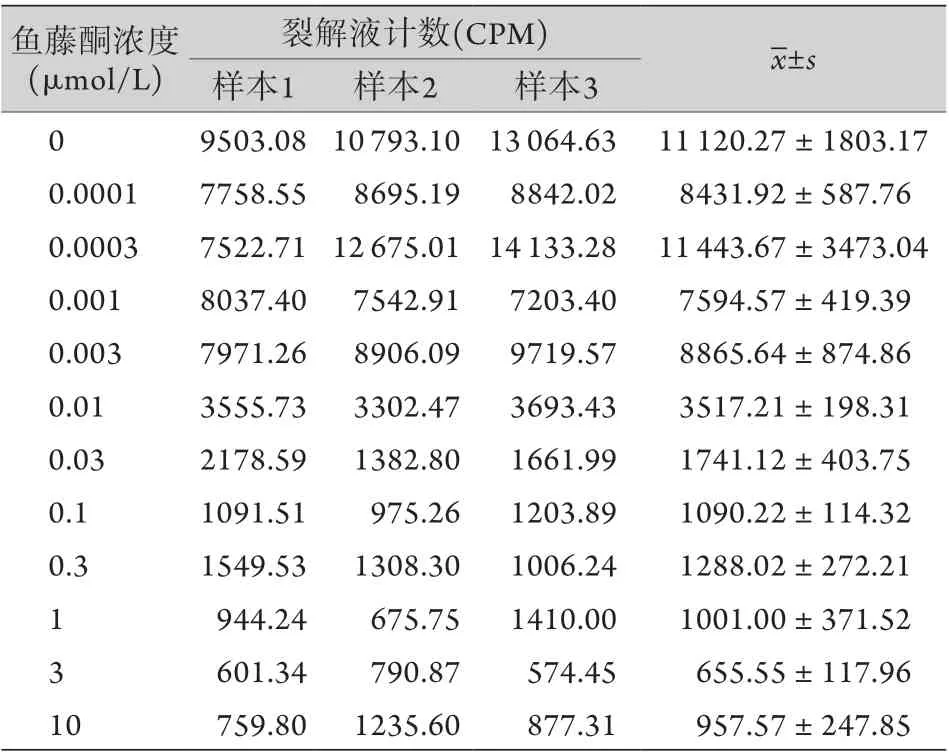
表2 鱼藤酮对心肌细胞摄取18F-MyoZone的抑制作用Tab.2 Inhibition effect of rotenone on uptake of 18F-MyoZone in cardiomyocytes
2.518F-MyoZone心肌细胞的外流实验 结果显示,18F-MyoZone可被大鼠心肌细胞快速摄取,并可在心肌细胞内滞留。在0~30 min,大鼠心肌细胞中的18F-MyoZone有持续外流现象,随着时间的延长而增加,随后在60~150 min,心肌细胞内的放射性组分保持稳定,约为总摄取量的20%(图5)。
3 讨 论
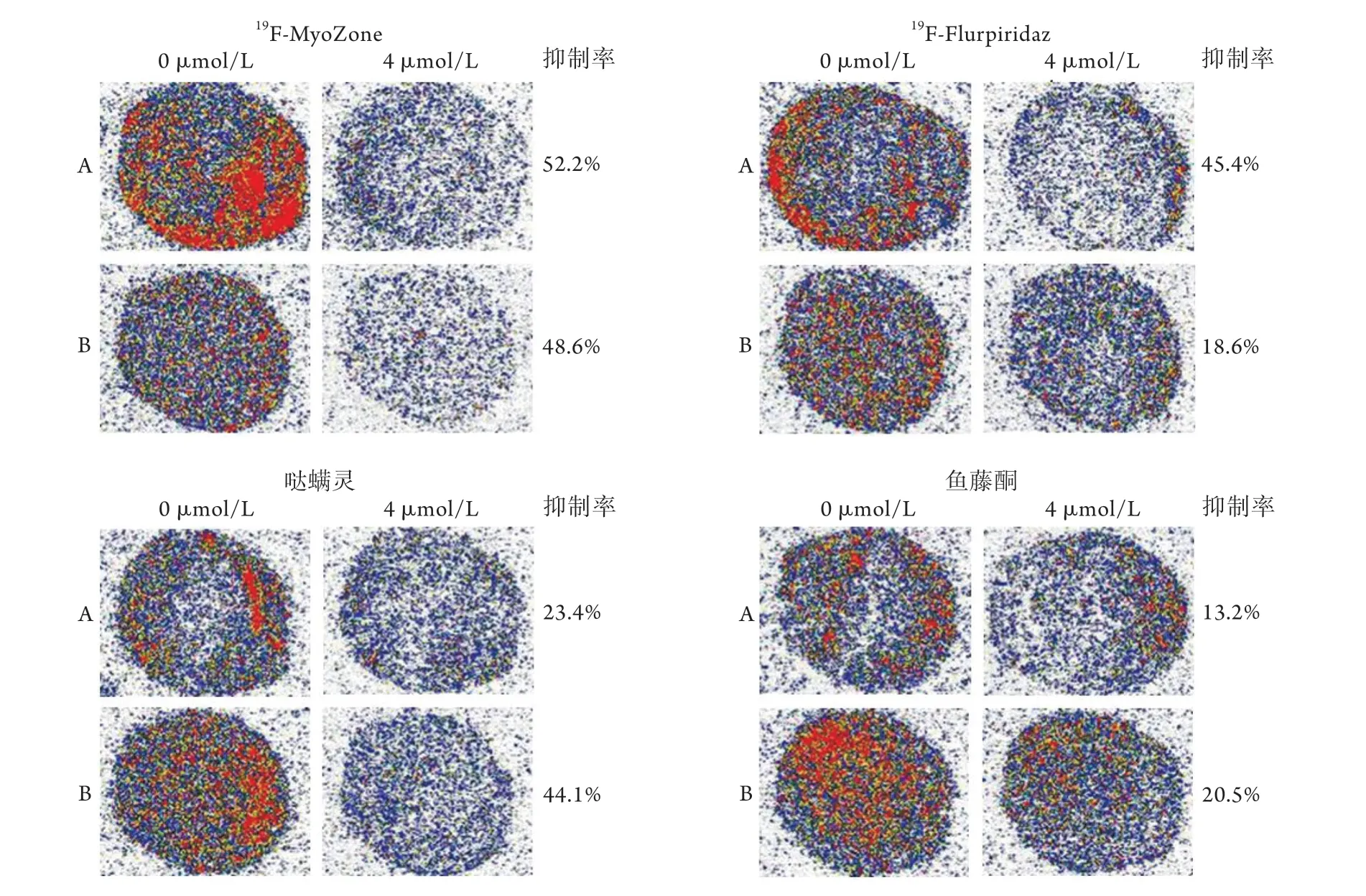
图2 18F-MyoZone大鼠心肌组织切片放射自显影图Fig.2 Autoradiography of 18F-MyoZone in myocardial tissue sections of neonatal rat

图3 鱼藤酮及19F-MyoZone抑制心肌组织对18F-MyoZone的摄取图像Fig.3 Inhibition effect of rotenone on uptake of 18F-MyoZone in cardiomyocytes

图4 鱼藤酮竞争曲线Fig.4 The rotenone competition curve CPM. 每分钟放射性计数
理想的心肌灌注显像剂需要满足注射后心肌细胞摄取快且滞留时间长、心脏外组织器官摄取低且本底清除快、显像图像清晰、时间及空间分辨率高、不需要现场加速器生产等条件。无论是传统的SPECT心肌灌注显像剂(如99mTc-MIBI、201Tl等),还是目前常用的PET心肌灌注显像剂(如15O-H2O、13N-NH3·H2O及82Rb)均不具备这些特性,研发18F标记的正电子显像剂才能最大程度地满足理想心肌灌注显像剂的要求。

图5 18F-MyoZone在大鼠心肌细胞的外流Fig.5 Outflow rates of 18F-MyoZone in rat cardiomyocytes
目前国内外研究较多的18F标记心肌血流灌注显像剂主要分为两大类:第一类是以18F-TPP[15]、18F-FBnTP[16]、18F-FERhB[17]为代表的亲脂性阳离子类显像剂,该类显像剂主要通过跨膜被动扩散进入心肌细胞内[18],心肌细胞摄取特异性较差,摄取率相对较低,显像效果并不十分理想。另一类是以心肌细胞线粒体内MC-Ⅰ为靶点进行结合显像的MC-Ⅰ抑制剂类显像剂。线粒体为心脏提供大量动力,占心肌细胞内体积的20%~30%。MC-Ⅰ位于线粒体内膜,其结构极其复杂,有40多个亚基,分子量约为1000 kD,因此,针对MC-Ⅰ的分子可在心肌中富集[19-20]。这类显像剂主要包括18F-FPOP、18F-FDHR、18F-RP1003/04/05、18F-Flurpiridaz[21-23]。本研究发现,MyoZone是一种强效的MC-Ⅰ抑制剂。酶活性抑制实验显示,随着加入19F-MyoZone溶液浓度的增加,MC-Ⅰ酶活性受抑制程度亦随之增大,其IC50为229.9 nmol/L。 然而在实验过程中,不同19F-MyoZone浓度组中3个平行孔,2号孔皆显示出比1、3号孔较低的测量数值,导致平行样本间实验结果出现较大的偏差,其原因可能是实验过程中的仪器对于2号孔数据读取偏差,考虑在未来的研究中,应该重复该部分实验,以获得样本组间差异较小、均匀性较高的一致性结果。鱼藤酮、哒螨灵是MC-Ⅰ的经典抑制剂,而18F-Flurpiridaz是目前最成功的MC-Ⅰ抑制剂类心肌灌注显像剂,三者的IC50相似,分别为(18.2±6.7) nmol/L、(19.8±2.6) nmol/L、 (16.6±3.0) nmol/L[20]。本文通过细胞学研究发现,18F-MyoZone与心肌细胞的结合受到鱼藤酮的抑制,且抑制效应随鱼藤酮浓度的增高而增大。组织学研究进一步证实,心肌摄取18F-MyoZone的程度受到鱼藤酮、哒螨灵、19F-Flurpiridaz的竞争性抑制。由此可知,18F-MyoZone与心肌细胞内MC-Ⅰ的结合为特异性结合,18F-MyoZone属于MC-Ⅰ抑制剂类显像剂,其结合位点与已知的MC-Ⅰ抑制剂鱼藤酮、哒螨灵、19F-Flurpiridaz一致。由于MC-Ⅰ在线粒体能量生成中起重要作用,18F-MyoZone作为新型MC-Ⅰ抑制剂类显像剂是否会影响心肌细胞能量代谢需要进一步实验证实。既往研究显示,浓度为0.2~1.0 μmol/L的不同MC-I抑制剂(包括鱼藤酮、哒螨灵、19F-Flurpiridaz)孵育细胞45 min~18 h,细胞活力未受明显影响[24]。然而在高浓度(1.0 mmol/L)鱼藤酮的长时间(48~72 h)孵育下,大鼠心肌细胞活性受到明显影响[25-26]。本研究中的MyoZone亦作用于心肌MC-I位点,属于MC-Ⅰ抑制剂,细胞学实验中采用的MyoZone浓度在20 nmol/L~20 μmol/L,孵育时间约30 min,此浓度范围的MyoZone是否会影响线粒体酶活性进而影响心肌细胞活力,有待后续实验进行检测。
心肌细胞的外流实验被广泛用于研究显像剂的心肌细胞滞留情况。本研究结果显示,在0~30 min,大鼠心肌细胞中的18F-MyoZone有持续外流现象,随后在60~150 min,心肌细胞内的放射性组分保持稳定。18F-MyoZone可以在心肌细胞中稳定保留超过150 min,具备的优良心肌灌注显像剂的条件。
综上所述, 本研究通过体外实验证实18F-MyoZone为一种MC-Ⅰ抑制剂类显像剂,通过与线粒体内MC-Ⅰ特异性结合实现心肌摄取。18F-MyoZone在150 min的较长时间内均有比较稳定的心肌细胞滞留,具有良好的心肌灌注显像潜能。

