缺氧诱导基因2诱导甘油三酯堆积稳态失衡促进肝癌发生的研究
刘咏真,康静波,杜 锐,郑 伟
肝细胞癌(hepatocellular carcinoma,HCC)是临床上最常见的恶性肿瘤之一,全世界范围内统计其发病率占全身肿瘤的第5位,死亡率占全身肿瘤的第3位[1]。临床上治疗方法主要为手术切除,然而治疗效果不甚理想[2]。绝大多数HCC患者的死亡源于肝癌的转移,因此对参与HCC细胞转移的调控因子功能进行相关研究,具有重要的意义。癌症的发生和进展受行为和环境导致的脂质稳态失衡影响[3]。肿瘤脂肪代谢给快速增长的肿瘤细胞提供增殖所需要的能量,并且脂质的再生已经成为HCC的重要标志。过度营养和肥胖是肝脏肿瘤发生的危险因素,主要是通过促进有利于癌症生长的炎症环境。
缺氧诱导基因2(hypoxia-inducible gene 2,HIG2),也称为缺氧诱导型脂滴相关蛋白,在多种缺氧性肿瘤组织出现[4]。HIG2增强Wnt通路和脂质代谢激活[5],促进了胶质瘤的发生[6]。另外,HIG2通过抑制细胞凋亡可以促进肿瘤细胞生长[4]。但是,HIG2在HCC中的意义尚不清楚。本研究旨在探讨HIG2在HCC发生发展中的作用和意义。
1 材料与方法
1.1 实验材料 QZG、HepG2和SMMC7721细胞购于中国科学院上海细胞库;收集2016年3月—2018年12月中国人民解放军总医院第六医学中心手术切除的30例HCC患者的肿瘤组织样本及对应癌旁组织,其中男性19例,女性11例,年龄36~64岁,平均年龄48.5岁。患者均已知情,并通过伦理审查。羊抗兔HIG2抗体(英国Abcam公司,ab78349)、β-actin(北京博奥森生物技术有限公司);羊抗兔IgG-HRP(美国Santa Cruz 公司);1640培养基(美国HyClone公司);胎牛血清(浙江天杭生物科技股份有限公司);Lipofectamine 3000转染试剂(美国Invitrogen公司);免疫组化试剂盒(北京中杉金桥生物技术有限公司);HIG过表达质粒(上海吉凯基因化学技术有限公司);Trizol试剂(生工生物工程股份有限公司);实时定量荧光PCR(real-time quantitative PCR,qRT-PCR)检测试剂盒(日本Takara公司)。
1.2 方法
1.2.1 细胞培养 细胞采用含10%胎牛血清的1640培养基进行培养,消化传代如常。以1×105接种于25 cm2培养皿,生长至70%~80%时,Lipofectamine 3000转染试剂进行质粒转染,48 h收集细胞。
1.2.2 qRT-PCR 使用Trizol试剂提取总RNA,用TaKaRa逆转录试剂盒逆转录。将等分的cDNA用作PCR的模板,引物由Primer 5.0软件设计。HIG2基因上游引物序列为5′-GCACGACCTGGTGTGACTGT-3′,下游引物序列5′-CCAGCACATAGAGGTTCAGCAT-3′;内参β-actin上游引物序列为5′-TGGCACCCAGCACAATGAA-3′,下游引物序为5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。使用实时LightCycler快速热循环仪检测,PCR反应条件为:95 ℃预变性15 min,95 ℃变性10 s,58 ℃退火31 s,72 ℃延伸40 s。共进行40个循环。
1.2.3 Western Blot法检测 HIG2蛋白表达:含蛋白酶抑制剂的RIPA裂解液裂解细胞,随后4 ℃下12 000 r/min离心20 min,取上清。留取30 μL采用BCA法检测蛋白含量,其余加入5×上样缓冲液,于100 ℃加热变性。加各组蛋白上样液进行SDS-PAGE凝胶电泳,转膜,将膜与第一抗体在4 ℃温育过夜:抗HIG2(1∶1 000),β-actin(1∶1 500);次日二抗孵育1 h,然后使用增强的化学发光系统扫描条带,并通过Image J软件定量。
1.2.4 划痕实验和侵袭实验 灭菌的marker在6孔板背后,用灭菌的直尺比着,均匀地划横线,每隔0.5~1 cm一道,横穿过孔。每孔至少穿过5条线,孔中铺约5×105个细胞,次日用枪头比着直尺,垂直于背后的横线划痕。用PBS洗细胞3次,去除划下的细胞,加入无血清培养基,放入37 ℃ 5% CO2培养箱中培养。当细胞增殖到孔板表面的100%左右时,在每个孔中划出1 mm宽的划痕,在划痕实验0和24 h显微镜(型号:EVOS M7000,美国Thermo Fisher公司)观察记录拍照。用Image J软件计算划痕的距离,比较0和24 h的划痕的空白宽度,表示细胞相对移位率。
使用涂有Matrigel的聚碳酸酯膜过滤器(8 μm孔径)(美国Sigma公司)的Transwell小室在体外测量细胞侵袭量。通过显微镜下在200个放大倍数下每个孔中的10个随机视野上计数穿透细胞来确定侵袭能力,实验重复3次。
1.2.5 甘油三酯含量检测 加入pH7~7.4P PBS或生理盐水0.2~0.3 mL冰水浴条件下进行超声破碎匀浆,加入对氯酚,生成的醌类化合物于510 nm波长的吸光值与甘油三酯的含量成正比,于510 nm波长分别测定标准管和样本管的吸光度值,计算甘油三酯含量。
1.2.6 细胞增殖检测 HepG2细胞接种到96孔板中,通过细胞计数,每孔接种50 000个细胞,分别培养24、48、72和96 h后,将10 μL CCK8反应混合物(美国APExBIO公司)添加到每个孔中,孵育2 h后,酶标仪(型号:Multiskan GO,美国Thermo Fisher公司)调整波长至450 nm,检测每孔的吸光度。每个时间点的吸光度可以代表该时间的细胞存活率,然后比较每个样品的吸光度趋势即可作为测定结果。

2 结果
2.1 HIG2在人肝癌组织、癌旁组织和肝癌细胞系中表达情况 采用qRT-PCR检测30例肝癌组织和对应肝癌癌旁组织中HIG2基因的表达,结果显示,与肝癌癌旁组织比较,肝癌组织中HIG2基因的丰度增加,差异比较具有统计学意义(P<0.05)(图1A)。通过Western Blot方法分别检测肝癌癌旁组织、肝癌组织和正常肝细胞(QZG)、肝癌细胞系(HepG2、SMMC7721)HIG2蛋白的表达水平。结果显示,与肝癌癌旁组织比较,肝癌组织中HIG2蛋白表达水平增加,差异比较具有统计学意义(P<0.05)(图1B);与正常肝细胞系比较,肝癌细胞系中HIG2蛋白表达水平增加,差异比较具有统计学意义(P<0.05)(图1C)。免疫组织化学方法检测肝癌癌旁组织和肝癌组织中HIG2蛋白水平,结果显示HIG2蛋白在肝癌组织中高表达,并且主要在胞浆中(图1D)。
2.2 正常肝细胞系和肝癌细胞系的甘油三酯含量检测 通过甘油三酯检测试剂盒检测每6×106个正常肝细胞系QZG和2个肝癌细胞系HepG2和SMMC7721甘油三酯含量,结果显示,HepG2和MMC7721甘油三酯含量[(16.94±0.33)mg/dL,(16.04±1.02)mg/dL]均高于正常肝细胞系QZG[(4.90±0.39)mg/dL](P<0.05)(图2)。
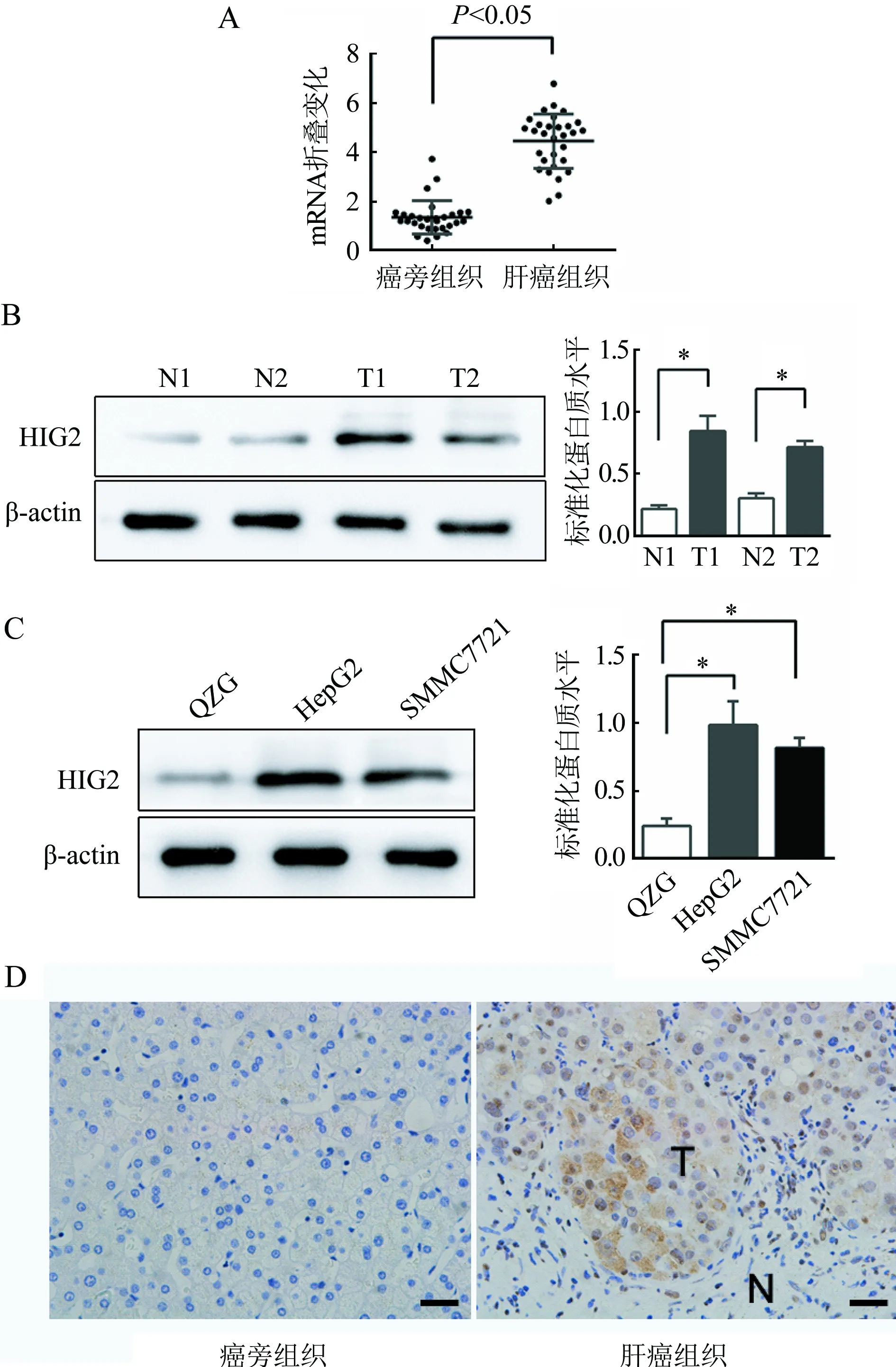
注:A.qRT-PCR分析30例肝癌组织和30例肝癌癌旁组织中HIG2基因的丰度;B.Western Blot方法检测2例肝癌癌旁组织和2例肝癌组织中HIG2蛋白的表达水平;C.Western Blot方法检测正常肝细胞系QZG和肝癌细胞系HepG2和SMMC7721的HIG2蛋白表达水平,与QZG比较,*P<0.05;D.免疫组织化学方法检测肝癌癌旁组织(normal liver tissue)和肝癌组织(T:tumor tissue癌组织;N:paired peritumoraltissue癌旁)中HIG2的蛋白水平(图中标尺代表50 μm)图1 HIG2在人肝癌组织、癌旁组织和肝癌细胞系中表达情况
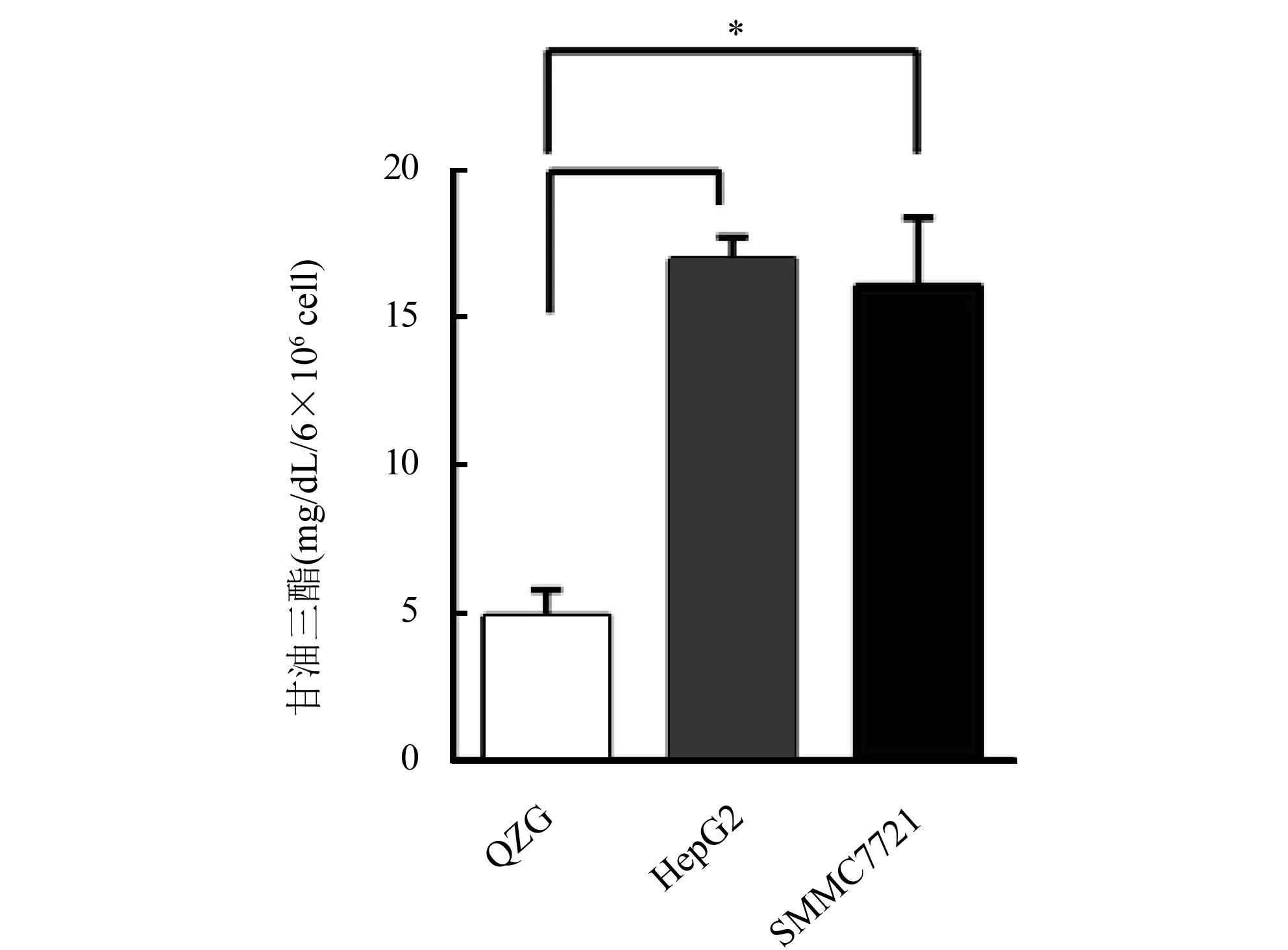
注:甘油三酯检测试剂盒检测每6×106个正常肝细胞系QZG和肝癌细胞系HepG2和SMMC7721的甘油三酯含量,与QZG比较,*P<0.05图2 甘油三酯检测试剂盒检测正常肝细胞系和肝癌细胞系甘油三酯含量
2.3 HIG2的过表达质粒影响肝癌细胞的侵袭和转移情况 使用涂有Matrigel的聚碳酸酯膜的Transwell小室测定细胞侵袭和迁移能力,结果显示HIG2的过表达质粒显著增加了HepG2细胞的迁移率(P<0.05)(图3A)。通过划痕实验比较转染了对照质粒以及转染了HIG2过表达质粒的HepG2细胞的细胞迁移率,在划痕实验0和24 h显微镜观察记录图片,用Image J软件分析0和24 h细胞进入划痕区域的相对距离。与对照组比较,HIG2过表达组细胞的划痕缝隙显著变小,愈合程度显著增加(P<0.05)(图3B)。
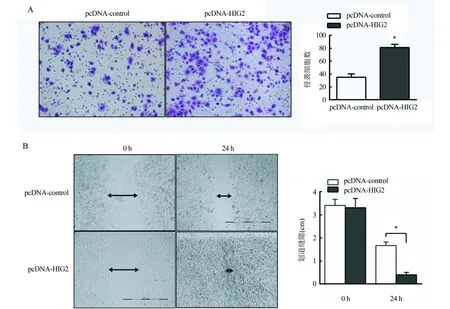
注:A.Transwell实验分析转染对照质粒(pcDNA-control)和HIG2基因的过表达质粒(pcDNA-HIG2)的HepG2细胞的迁移能力;B.划痕实验分析转染了pcDNA-control以及转染了pcDNA-HIG2的HepG2细胞,测量0和24 h细胞进入划痕区域相对位移率,来评估细胞迁移,右侧柱状图显示0和24 h划痕空隙的宽度变化,与pcDNA-control组比较,*P<0.05图3 Transwell实验和划痕实验分析HIG2的过表达质粒影响肝癌细胞的侵袭和转移情况
2.4 HIG2影响肝癌细胞的增殖情况 通过甘油三酯检测试剂盒检测转染了对照质粒以及转染了HIG2过表达质粒的HepG2细胞,结果显示HIG2基因的过表达质粒转染组的HepG2细胞的甘油三酯含量[(106.20±7.56)mg/dL]比转染了对照质粒的HepG2细胞的甘油三脂含量[(23.40±2.66)mg/dL显著增加(图4A),细胞增殖率显著增加(图4B)。HepG2细胞转染了HIG2基因的小干扰(siRNA)质粒甘油三酯含量[(10.59±0.61)mg/dL]比转染对照质粒的HepG2细胞的甘油三酯含量[(26.17±2.37)mg/dL]显著降低(P<0.05)(图4C),细胞增殖率下降(图4D)。
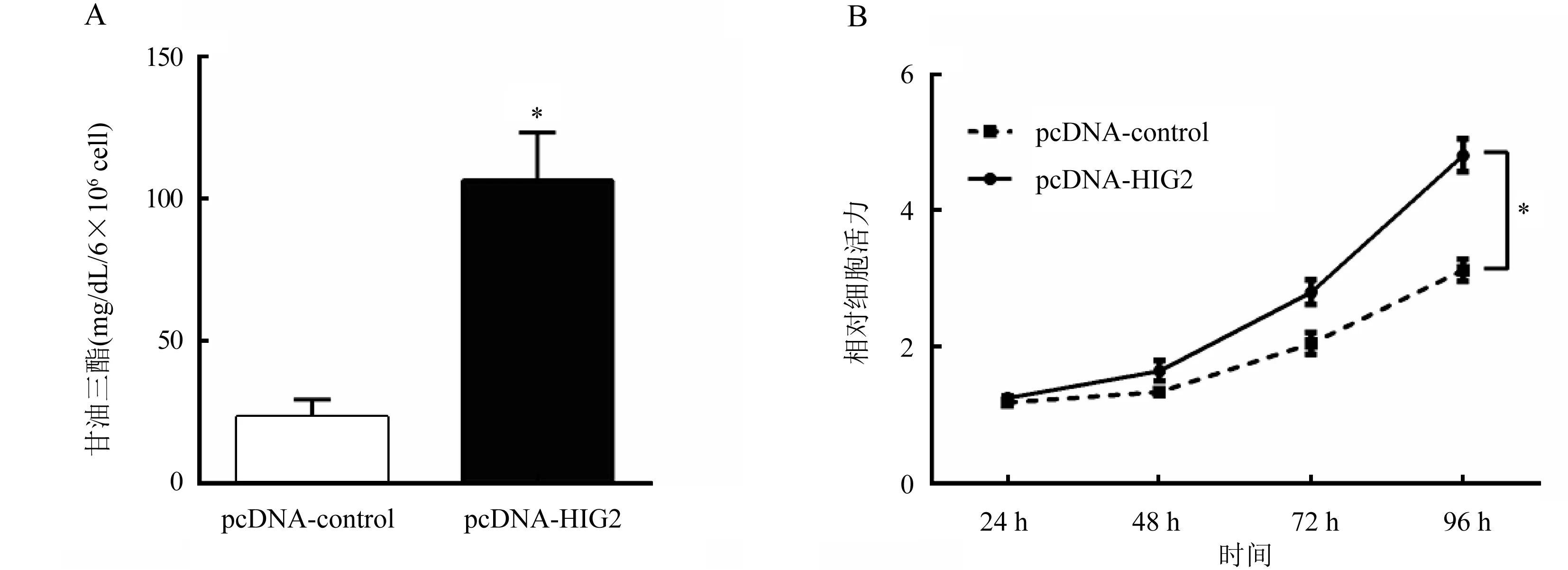
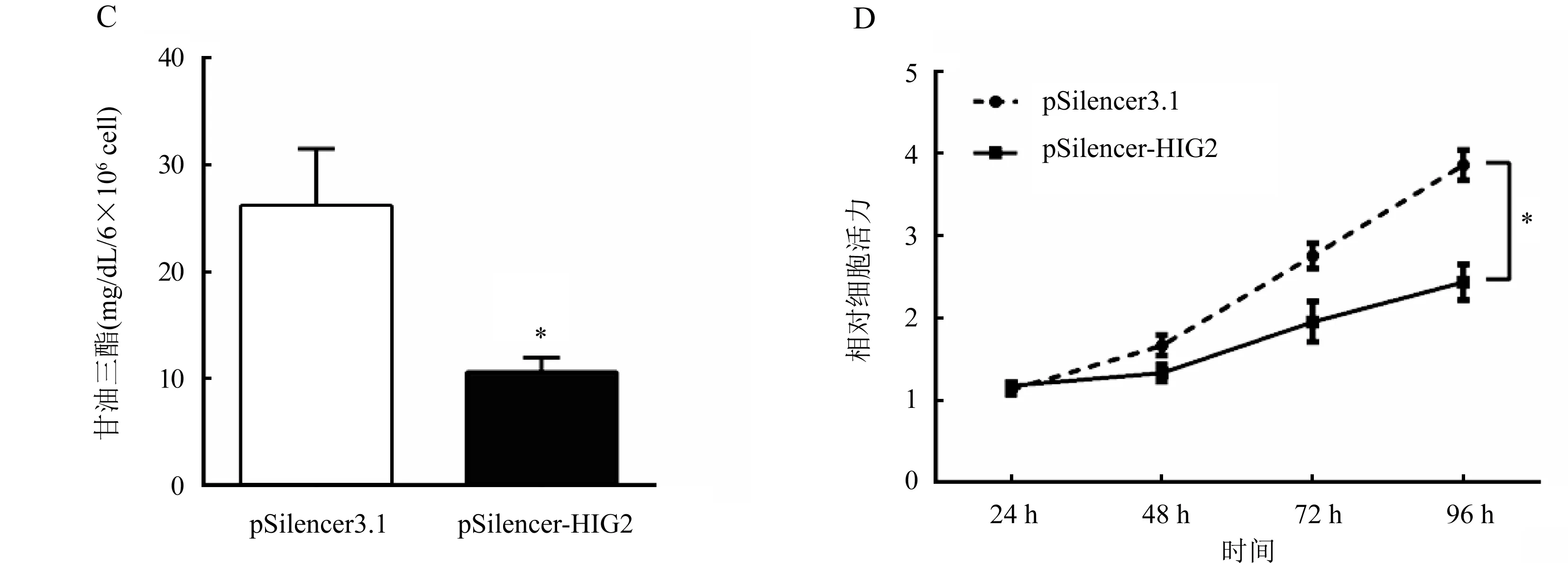
注:A.甘油三酯检测试剂盒检测每6×106个转染对照质粒(pcDNA-control)和HIG2基因的过表达质粒(pcDNA-HIG2)的HepG2细胞的甘油三酯含量,与pcDNA-control组比较,*P<0.05;B.CCK8检测转染对照质粒和HIG2基因的过表达质粒的HepG2细胞24、48、72和96 h的增殖率,与pcDNA-control组比较,*P<0.05;C.甘油三酯检测试剂盒检测每6×106个转染对照质粒(pSilencer3.1)和HIG2基因的siRNA质粒(pSilencer-HIG2)的HepG2细胞的甘油三酯含量,与pSilencer3.1组比较,*P<0.05;D.CCK8检测转染对照质粒和HIG2基因的siRNA质粒的HepG2细胞24、48、72和96 h的增殖率,与pSilencer3.1组比较,*P<0.05图4 甘油三酯检测试剂盒检测HIG2影响肝癌细胞的增殖情况
3 讨论
HCC是世界上最常见的肿瘤之一,已成为中国癌症相关死亡的第二大原因[7]。虽然在诊断和手术治疗方面取得了很大进展,但HCC的复发率和转移率仍然很高。此外,HCC患者在初步诊断时通常处于晚期阶段,HCC晚期疾病患者的预后仍不理想[8]。尽管在调控HCC的分子机制研究方面取得了重大进展,但阐明肝癌发生的精确调控仍需要付出巨大努力。寻找特异性的HCC标志物用于临床诊断,具有重要的意义。
包括HCC在内的多种肿瘤均处在缺氧微环境中[9]。肿瘤细胞中细胞存活、细胞增殖、血管生成和脂代谢关键的基因在缺氧微环境中异常表达[10]。实体瘤中的癌细胞是处于低氧环境的,低氧会激活低氧诱导因子(hypoxia inducible factor,HIFs),激活的HIFs促使细胞的代谢方式发生改变以适应低氧环境[11]。近期研究发现,低氧环境下癌细胞中的脂肪酸代谢异常对肿瘤的生长和转移也发挥着重要的作用。脂肪酸作为能量贮存主要有2种形式:一是以甘油三酯的形式存在,甘油三酯被合成贮存在脂滴中,当细胞需要其生成能量时,会利用一系列酶解反应将其分解;二是以胆固醇形式储存在脂滴中,胆固醇协助细胞信号传导通路的正常运行[12]。贮存甘油三酯的脂滴,有抵抗活性氧毒性的作用。研究发现,抑制肿瘤细胞内甘油三酯的储存,降低对活性氧毒性的抵抗作用,促进了肿瘤细胞的损伤,抑制肿瘤细胞的生长[13]。HCC是所有癌症中受肥胖影响最大的肿瘤。肝脏脂代谢的调控机制十分复杂,与多条信号通路及关键靶点有着密切的关系。HIG2是一种特异性的缺氧诱导基因,首次被Denko等发现,其cDNA全长1 372个核苷酸[14]。HIG2作为缺氧诱导基因,在肿瘤缺氧微环境下异常表达,并且作为一种新型脂滴蛋白质可以诱导细胞内甘油三酯积累,具有重要的临床意义[15]。哺乳动物的细胞在营养过剩时,将甘油三酯储存在细胞的脂滴中,当细胞处在饥饿或生理活动下,细胞内脂解的过程将甘油三酯水解为游离脂肪酸和甘油,用于进一步进入线粒体进行β氧化产生能量以及脂质和生物膜的合成。细胞内甘油三酯的分解和聚集精密调控着细胞能量稳态的维持。甘油三酯聚集和水解过程的失调导致各种病理变化,包括代谢综合征,动脉粥样硬化,脂肪肝,肝癌。因此,我们推测肝癌细胞中甘油三酯的水解失调是促进HCC进展的关键。研究表明HIG2在结直肠癌,胶质瘤,肾细胞癌和子宫癌中均有发现[16],并且HIG2-9-4肽疫苗在肾细胞癌的治疗中取得了一定疗效[17]。本研究发现HIG2的表达在HCC组织中有明显增加,免疫组织化学检测显示HIG2蛋白主要在肝细胞胞浆中高表达。并且通过过表达HIG2,可以显著诱导肝癌细胞的甘油三酯的堆积,同时促进了肝癌细胞的侵袭和转移潜力。
综上所述,HIG2通过甘油三酯的堆积在HCC的发生发展过程中发挥重要的作用,然而其具体分子机制还尚不清楚,这也是我们接下来要研究的重点。随着HIG2基因基础及临床研究的逐步深入,HIG2基因必将成为一种有效的肿瘤治疗手段并为筛选HCC临床诊断的肿瘤标志物以及分子药物治疗的靶标提供了理论依据。

