基于ISO 20387:2018标准生物样本库文件构建
李天君,汪德海,于 磊,张桂福,高建恩,高华方,马 旭
2018年8月,ISO 20387:2018标准《生物技术—生物样本保藏—生物样本库通用要求》由国际标准化组织正式发布[1]。中国合格评定国家认可委员会于2019年5月开展了全球第一家生物样本库的ISO 20387:2018认可,开创了生物样本库体系化管理的新纪元[2-3]。如何保障我国生物样本材料和信息的可信性和可靠性,保障生物样本库的安全和质量是重点内容。体系文件建设是生物样本库质量管理体系(quality management system,QMS)运行的基础。依据ISO 20387:2018标准构建生物样本库QMS文件,可以进一步提升生物样本库质量管理能力。
1 生物样本库管理现状
我国的生物样本资源保藏、利用和研究工作发展迅速,但与之对应的监管机制和管理办法还有待健全[4]。《中华人民共和国人类遗传资源管理条例》自2019年7月1日起施行,这为我国的生物样本资源管理从法规上奠定了基础[5]。但一些规范性的文件和制度还需要进一步修订和补充。如原卫生部制定的《人类遗传资源管理暂行办法》、《涉及人的生物医学研究伦理审查办法(试行)》需要修订。中国医药生物技术协会组织生物样本库分会的《生物样本库标准(试行)》,中华民族健康与疾病遗传资源共享平台、中国人类遗传资源平台等平台技术文件不具有强制性。在构建我国生物样本资源库质量管理的法律体系上,《中华人民共和国人类遗传资源管理条例》作为上层行政法规,需要建立相应的部门规章和标准,构建体系化的生物样本库管理制度。
我国生物样本库建设得到相关部门的高度重视,以人群为基础的生物样本库发展较快。一些国家级、地区级的重大人类遗传资源项目建设和保藏能力不断提升。但由于没有国家相关的质量管理规范和标准,相关部门一般都是借鉴国外相关标准和规范,采用其他行业标准对生物样本库进行管理。在QMS文件建设方面,部分生物样本库采用美国血库协会《细胞治疗服务标准》[6]、ISO 9001:2015标准[7]、细胞疗法认证基金会《脐带血采集、储存、分布和应用管理国际标准》[8]等标准进行管理,但生物样本专业文件内容不明确。部分生物样本库依据行业内规范和要求,建立了自己的操作规程和管理制度,但体系化的QMS文件还不完善。一些样本库的文件形式重于内容,不能用于指导日常业务操作[9]。相关业务记录管理未体系化,可追溯性证据不能保持[10-11]。
2 ISO 20387:2018标准文件信息要求
体系文件是构建QMS的基础工作。最初的体系文件理念来源于ISO 9000标准,在ISO 9001:2015版本中,淡化了相关文件和记录的要求,在建立QMS过程中给予了标准更多的弹性和灵活性。ISO 20387:2018标准文件要求包括国家QMS文件、信息和记录,与我国相关生物样本库的行业标准、规范相比,更具有全面性和体系化,ISO 20387:2018标准与《生物样本库标准(试行)》、中国医药生物技术协会《细胞库质量管理规范》、药品生产质量管理规范(good manufacturing practice,GMP)文件要求比较见表1。ISO 20387:2018标准附录A和附录B都是对文件的要求。附录A是强制性要求,规定了生物样本库建立文件的要求,包括总则、获得、运输、制备/保存、测试、储存、分发和弃用全业务过程文件要求,系统规定了生物样本库的文件要求,比其他文件的规定都要具体和规范。附录B是参考性要求,更加细化了文件编写指南,并对所有文件进行举例,使生物样本库运行有据可依。
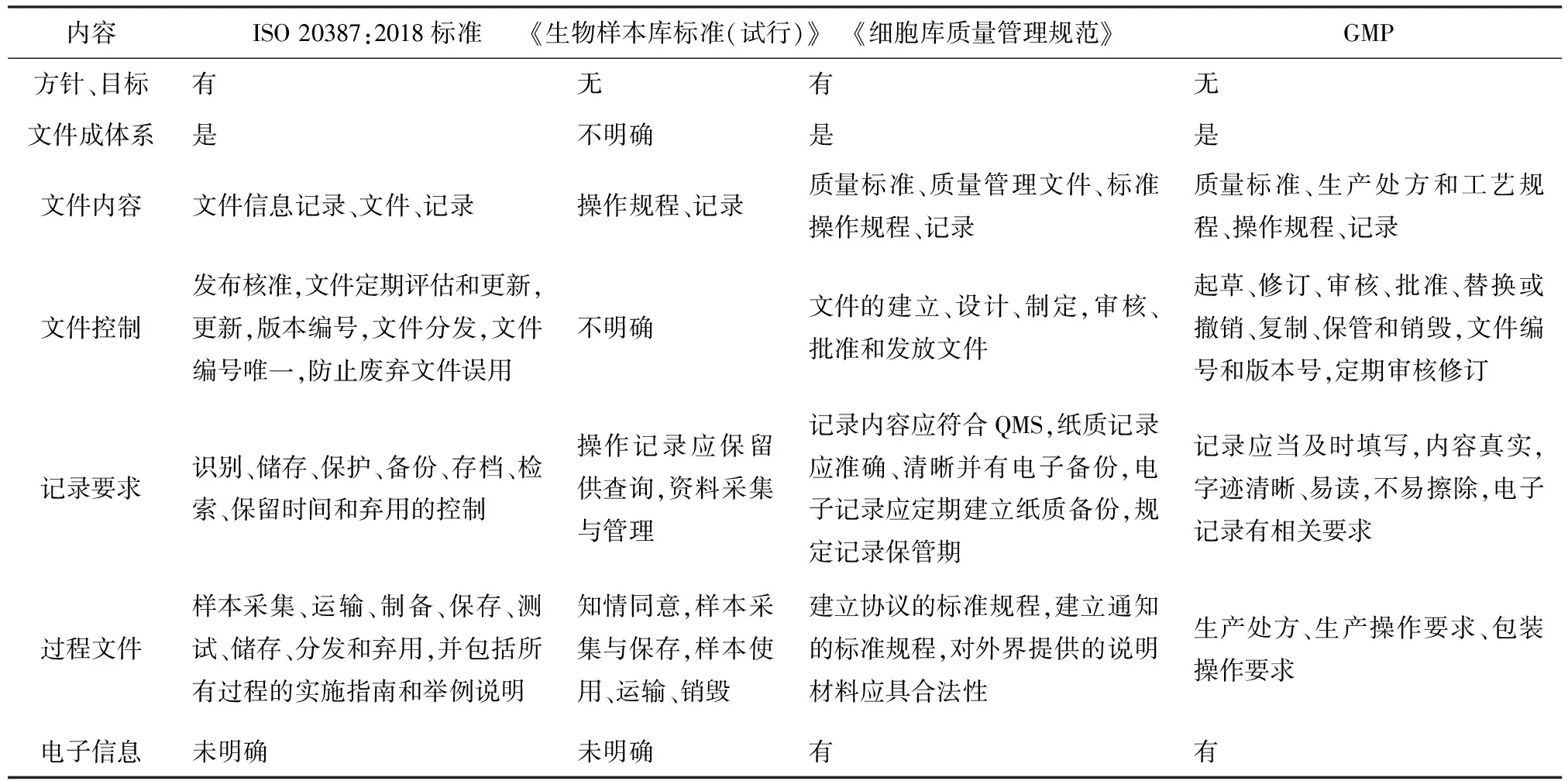
表1 ISO 20387:2018标准与其他标准文件要求比较
3 ISO 20387:2018标准文件构建实践
3.1 文件架构 在ISO 9001:2015标准以前的各种标准、规范要求下,一般的体系文件分为质量手册、程序文件、操作规程和记录四级[12-13],它们是呈金字塔结构,每层文件对上下文件都是依附关系。现在,我们制定文件以实用性为主,尽量将操作人员从大量的形式化的文件中脱离出来,不再强制要求四层的文件架构,也不再强制要求必须编制质量手册等专有文件。参照ISO 9001:2015标准,依据ISO 20387:2018标准,结合我国生物样本库管理特点,建立生物样本库文件架构(图1)。此架构体现了新标准文件由金字塔结构变成了扁平状结构,强调文件自身的科学性和实用性。在我们的文件框架中,质量手册是纲领性文件,程序文件、操作规程、应急预案等过程类文件同属于质量手册下的二级文件。程序文件与操作规程等二级文件之间没有层次关系,省去了相互之间的引出和被引用关系。不同文件性质和编写方法不一样,格式和体例也不尽相同,编制人员也是根据实际情况选择,生物样本库QMS文件分类和性质见表2。
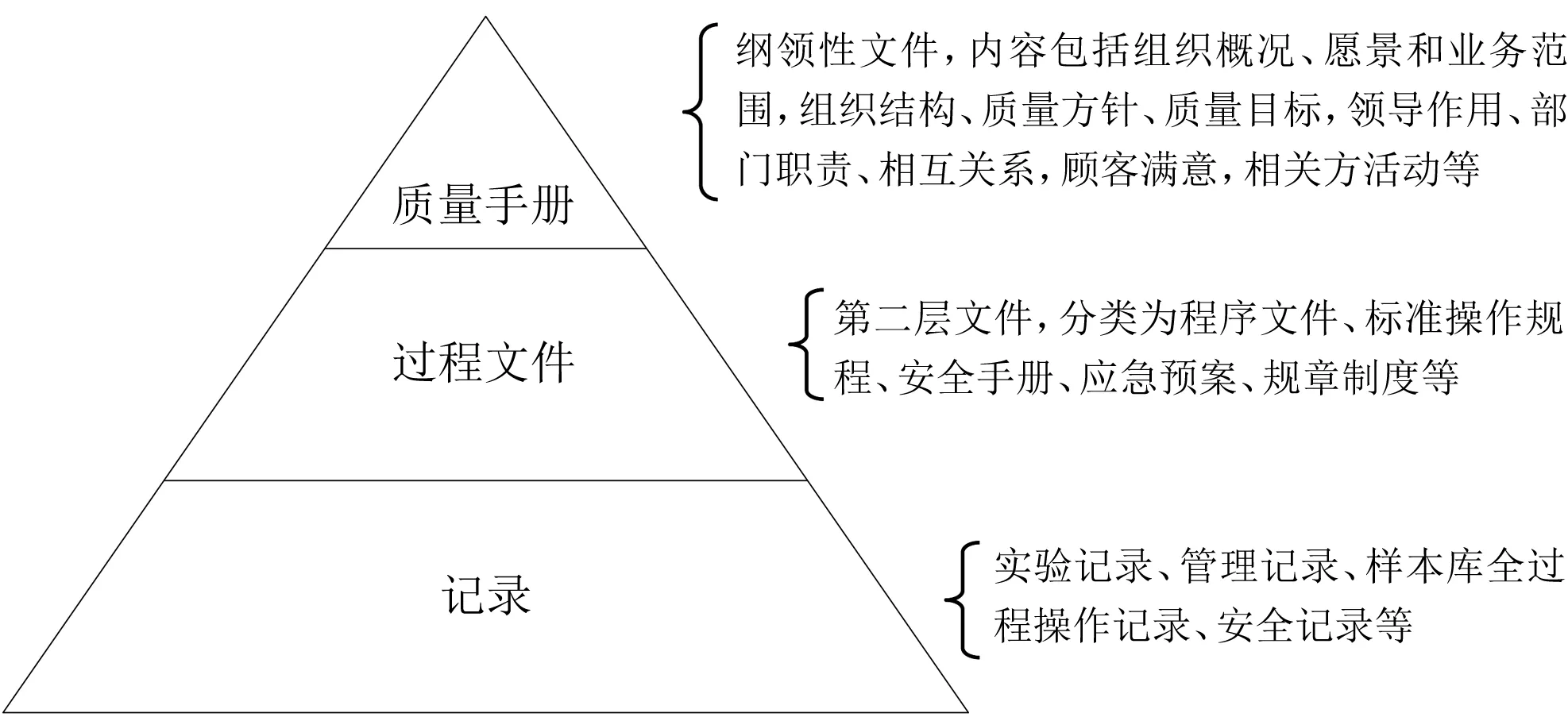
图1 基于ISO 20387:2018标准生物样本库文件架构

表2 生物样本库QMS文件分类和性质
3.2 文件编制
3.2.1 质量手册编制 质量手册体例格式参照ISO 20387:2018标准标准结构和目录,基本上要包括ISO 20387:2018标准的结构:前言,1范围,2规范性引用文件,3术语和定义,4通用要求,5结构要求,6资源要求,7过程要求,8管理要求,附录。编制人员一般为样本库管理人员,需熟练掌握ISO 20387:2018标准、ISO 9001:2015标准涵义和相关法律法规规范,将本单位实际情况与ISO 20387:2018标准有机融合,确保每一条款和内容涵义准确、描述清楚。质量手册编写过程中要关注与过程类文件的相容和区分,不能将所有的内容都归入到质量手册中,对相关过程类、管理类的方法、技术要归入到相关程序文件或操作规程中,质量手册和其他类型文件所描述的内容要合理区分,不能互相混淆。同时要在质量手册中引出相关的程序文件、操作规程等过程类文件。质量手册要起到在单位内、与相关方、与上级主管部门和第三方检查机构的宣传引导作用。质量手册体现出单位的愿景和方针,明确样本库的战略意愿和工作目标。
3.2.2 程序文件编制 程序文件的特点是对多接口的活动进行规定,一般要求相关主管部门和质量管理部门共同编写。程序文件是过程类文件,要详细描述过程的5W1H(谁在何时何地做了何种工作)。程序文件分为2种类型,一种是管理类,如内部审核控制程序、管理评审控制程序、标本管理程序等,另一种是操作类,如室内质量控制程序、室间质评能力验证程序、医疗废物管理程序等。结构基本上是目的、范围、职责、程序、参考文件、相关记录。在程序文件中还可包括流程图。在编制程序文件的时候,要确定本程序文件的主体内容,一般按过程方法的模式进行编写。如医疗废物管理程序,要编写出医疗废物产生、分类、标识包装、交接、运输、暂存、外包收集全过程的具体要求。内部审核程序要编写出样本库QMS内审的计划、准备、首次会议、现场审核、审核组内沟通、末次会议、纠正措施改进等全过程要素。
3.2.3 操作规程编制 操作规程是样本库最为广泛的一类文件,涉及到样本库业务的全过程,一般由熟悉该活动的人员编写。ISO 20387:2018标准附录A和附录B详细规定了生物样本库全过程所要建立的操作规程,有很强的参考和指导价值。日常开展业务的样本获得、运输、制备、测试、分发、弃用等全部要编制相关具体的操作规程,一些项目的方法、仪器等也应编制操作规程。操作规程要独立编制,一件活动编制一个操作规程,尽量不把几个活动合起来编写成一个操作规程。如样本采集操作规程与样本运输操作规程不合并编写(一些简单小规模样本库可依据实际情况合并编写)。对于检验项目,可以编写项目检测操作规程,同时要编写仪器操作规程,如HBsAg酶联免疫检测操作规程,全自动酶免分析仪检测HBsAg操作规程。
3.3 记录管理 记录是生物样本库业务运行的证据,是文件的一种类型,ISO 20387:2018标准规定了生物样本库应实行对其记录的识别、储存、保护、备份、存档、检索、保留时间和弃用的控制。记录是在文件中产生的,所以每一个记录要对应相关的文件,同时在编制文件时要产生相关的记录表单。记录可以是图片、符号、电子信息等任何形式的媒介。记录管理分为2方面:①表单设计,表单是一个载体,它是没有填写实际信息的文件,表单由对应编制文件的人员或实际业务操作的人员进行设计,表单设计遵从简单全面的原则,文件尽量简练无歧义,易于操作人员填写;②记录管理,在表单上填写上相关信息,就是记录,记录的最大特点是及时性和客观性,要求操作人员在操作过程中或操作过程后详细填写所做的相关业务操作。如电子记录或其他原因不能现场进行填写表单时,应在其他记录本中做好详细记录并及时补录。记录填写应按规则进行,客观体现操作人、操作地点、操作日期和时间,使用的仪器、方法、物料和试剂等。
3.4 文件评审和改进 文件编制完成后,需要经过相关部门操作人员的确认,反复修改后,进行审核批准发布。由全体人员分层次分类型对新文件进行学习,考核合格后开始运行。在QMS文件运行过程中,文件要根据实际情况进行评审,文件评审一般分为定期评审和随机评审。定期评审一般每年开展一次,安排相关人员对所有文件进行客观评价,并进行修订。随机评审是依据样本库业务工作的需要进行评审,评审的时机包括国家相关法规标准规范的发布更新,部门业务流程的改变,新项目新方法的使用等[14]。文件评审的过程实际上就是文件改进的一种方式。文件改进还包括日常不符合项、内审不符合项等引起的需要修改相关文件的方面。文件改进是文件管理过程的重要环节,只有持续改进文件的不合理不符合之处,才能提高样本库工作效率和减少业务差错。在每次的文件评审和修改后都要经过相关人员审核批准后重新发布。
文件是QMS建立、运行的载体,生物样本库的QMS运行是从实施QMS文件开始的。一般情况下,过程的改进都要进行文件的修订,同时修订文件会促进样本库QMS的改进。持续改进是QMS永恒的目标,文件的更改和评审始终贯穿在持续改进的过程中。
生物样本库是转化医学和精准医学的基础,生物样本库的质量和信任能力是生物科技发展前提条件。标准化是生物样本库发展的必由之路,在生物样本库质量管理建设中必须将体系文件的标准化建设放在重要位置[15]。ISO 20387:2018标准为生物样本库构建体系文件提供了框架和思路。相关生物样本库要提升质量管理能力,借助中国合格评定国家认可委员会ISO 20387:2018标准认可是当前较为理想的举措。由于ISO 20387:2018标准不是强制性标准,它只能供生物样本库选择和参考使用。建议相关部门尽快出台全国性的生物样本库质量管理法规和标准,进一步保障我国生物样本库健康发展[16]。

