乳香与醋乳香对溃疡性结肠炎大鼠抗炎作用的对比研究*
梁东蕊,宋志前,宁张弛,王 淳,马新玲,万晓莹,刘振丽
(中国中医科学院中医基础理论研究所 北京 100700)
乳香来源于橄榄科植物乳香树Boswellia carterii Birdw.及同属植物Boswellia bhaw-dajiana Birdw.树皮渗出的树脂,主治胃脘疼痛,癥瘕腹痛,痈肿疮疡[1-2]。始载于《名医别录》,具有活血行气化瘀、消肿止痛的功效[2]。国外临床研究显示,乳香醇制剂对溃疡性结肠炎(Ulcerative Colitis,UC)有很好的疗效,80%患者服用后病情得到缓解[3],其对慢性结肠炎II级和III级患者有效率分别为100%和60%[4]。UC是炎症性肠炎(Inflammatory bowel disease,IBD)的一种,病变范围广泛[5]。中医学将其归属于“肠澼”、“泄泻”及“痢疾”等范畴,采用“清热利湿、化瘀行气、涩肠解毒”为主要治法[6]。认为针对其“气滞血瘀而发病”的特点,可以运用乳香活血行气的功效加以治疗[7]。中医临床治疗多以其炮制品醋乳香入药[8-9]。乳香醋炙可降低刺激性,并增强活血行气化瘀、消肿止痛功效[1]。由角叉菜胶诱导的大鼠胸腔白细胞游走抑制实验也表明,乳香醋炙后抗炎作用显著增强[10]。那么,醋乳香对UC模型动物是否有作用,以及醋炙前后作用是否存在差异,还未见研究报道。
UC常用的实验动物模型制作方法主要有化学刺激法、免疫法和复合法三大类。TNBS∕乙醇作为常用的复合法,制作简单、价格低廉且具有较好的重复性,通过单剂灌肠诱导,不需要预先致敏或对动物进行外科手术,模型持续时间较长,模型组织学变化与人类结肠炎相似,是评价药物疗效稳定的结肠炎模型[11]。因此本文拟采用TNBS∕乙醇诱导大鼠UC模型,通过比较大鼠的DAI、CMDI、结肠HS评分以及肿瘤坏死因子(TNF-α)、白细胞介素-1β(IL-1β)、白介素6(IL-6)的水平,探究醋乳香对UC功效及醋炙前后的作用差异,为乳香醋炙理论提供科学基础,并为临床提供科学依据。
1 实验材料
1.1 实验动物
SD大鼠,雄性,体重(250±20)g,北京维通利华实验动物中心提供,实验动物在中国中医科学院中医基础理论研究所SPF级动物房喂养[实验动物室许可证号SYXK(京)2016-0021]。
1.2 饮片、药品及试剂
乳香购自北京同仁堂药店,经北京中医药大学刘春生教授鉴定,均为橄榄科植物乳香树Boswellia carterii Birdw.树皮渗出的树脂。TNBS(批号SP229701,Sigma),水合氯醛(批号20180420,天津福晨化学试剂厂),柳氮磺吡啶肠溶片(Salazosulfapyridine,SASP)(0.25 g∕片,批号20180106,上海信谊嘉华药业有限公司生产),羧甲基纤维素钠(Sodium carboxymethylcellulose, CMC-Na,批 号20161025,上海沪试),0.9%氯化钠注射液(批号1709283205,石家庄四药有限公司),95%乙醇(批号20160504,北京化工厂),甲醛溶液(批号20180420,天津福晨化学试剂有限公司),注射器(批号20130821,山东威高集团医用高分子制品股份有限公司),血清管(批号180601,江苏康健医疗用品有限公司),细胞因 子TNF-α、IL-1β、IL-6 ELISA试 剂 盒(批 号20180830、20180830、20180830,北京四正柏公司)。
1.3 仪器
CP225D电子天平(德国赛多利斯公司);HSS-1 B数字式超级恒温浴槽(成都仪器厂);低温离心机(美国西格玛公司);Multiskan Mk3型酶标仪(美国赛默飞世尔公司);CKX41倒置相差显微镜(日本Olympus公司);石蜡包埋机(中国湖北欧美莱医疗科技有限责任公司);手动旋转式石蜡切片机(德国Slfe)。
2 实验方法
2.1 药物配制
2.1.1 阳性对照药柳氮磺吡啶混悬液的配制
将柳氮磺吡啶片粉碎,过100-120目筛。称取337.5 g粉末,以6750 mL 0.5%羧甲基纤维素钠(CMCNa)溶液配制为混悬液,4℃储存备用。按柳氮磺吡啶50 mg∕100 g大鼠体重给药。
2.1.2 乳香、醋乳香混悬液的配制
首先炮制醋乳香。按照2015版中国药典[1]和前期研究结果[2],称取乳香适量,采用中火(设定电磁炉温度130℃),待锅底温度达到130℃后投入乳香,不断翻炒,炒制9 min后,按照10∶1的比例喷入陈放2年以上的米醋,继续翻炒2 min出锅,摊开晾凉,得到醋乳香。
分别称取乳香和醋乳香适量,在相同条件下粉碎,过100目筛,即得到乳香及醋乳香粉末。以70 kg人体用药量作为等剂量,制成含乳香或醋乳香的0.5%CMC-Na混悬液,用时摇匀,4℃储存备用。
2.2 UC模型建立及分组处理
2.2.1 造模方法[12]
采用SD雄性大鼠,体重280-300 g,适应性喂养2 d后,禁食不禁水36 h后,按照完全随机法,正常组10只,造模动物84只,分别给予2%戊巴比妥钠(45 mg·kg-1)腹腔麻醉,用直径2 mm的橡胶输液管缓慢推入距大鼠肛门约8 cm深的肠腔内。造模动物一次性将5%TNBS(100 mg·kg-1)水溶液和50%乙醇溶液的1:1混合液注入大鼠肛门,捏紧倒置保留5 min。正常组按同样方法,以同体积0.9%氯化钠溶液注入大鼠肛门。让动物保持平衡状态,均自然清醒后正常喂养。
2.2.2 分组及给药
除了上述正常对照组(A),将造模动物分为6组,即模型对照组(B)、乳香等剂量组(C,0.45 g·kg-1)、乳香2倍剂量组(D,0.90 g·kg-1)、醋乳香等剂量组(E,0.45 g·kg-1),醋乳香2倍剂量组(F,0.90 g·kg-1),阳性对照组(G,0.50 g·kg-1),每组10只。造模后第二天开始给药。给药组按上述剂量分别灌胃给药,正常组按10 mL∕kg剂量给予CMC-Na。每天给药1次,连续给药14 d。
2.3 检测指标
2.3.1 大鼠疾病活动指数(DAI)的观测[13-14]
造模成功后,每周称量大鼠体重并观察粪便情况。按表1评估大鼠DAI,DAI=(体重+大便形态+大便出血)∕3。
2.3.2 结肠黏膜损伤指数(CMDI)的观测[13-14]
大鼠腹腔注射10%水合氯醛(0.3 mL∕100 g)进行麻醉后,将其固定于手术台。剥离结肠组织,用冰生理盐水冲洗干净,肉眼观察结肠粘膜损失指数评分。CMDI评分标准分为5级:肉眼观察结肠无损伤,记为0分;轻度充血,水肿,表面光滑,无糜烂或溃疡,记为1分;充血水肿,黏膜粗糙呈颗粒状,有糜烂或肠粘连,记为2分;高度充血水肿,黏膜表面有坏死及溃疡形成,溃疡最大纵径<1.0 cm,记为3分;在3分基础上溃疡最大纵径>1.0 cm,或全肠壁坏死,记为4分。
2.3.3 结肠组织学观察及评分(HS)[13-14]
取大鼠病变最明显的一段结肠组织,将其浸入10%中性甲醛缓冲液中固定,常规石蜡包埋,切片,HE染色,光镜下观察结肠组织学变化并评分。HS评分标准分为4级:大鼠结肠肠黏膜无水肿、溃疡,无组织学病变,记为0分;肠黏膜轻度水肿、炎症溃疡、肉芽肿、上皮细胞异型增生,病变到达黏膜层,记为1分;肠黏膜中度水肿、炎症溃疡、肉芽肿、上皮细胞异型增生,病变到达肌层,记为2分;肠黏膜重度水肿、炎症溃疡、肉芽肿、上皮细胞异型增生,病变到达浆膜层最后所得的数值相加评分,记为3分。
2.3.4 血清中细胞因子TNF-α、IL-1β、IL-6的检测
打开大鼠腹腔,暴露腹主动脉。用5 mL的注射器采集全血,保存于血清促凝管。静置2 h后,4℃低温离心10 min(2500 r·min-1),吸取上清液,分装,于-80℃保存备用。采用ELISA法分别对各组大鼠血清中细胞因子TNF-α、IL-1β、IL-6水平进行测定,均按照试剂盒说明书进行操作。
2.4 统计分析
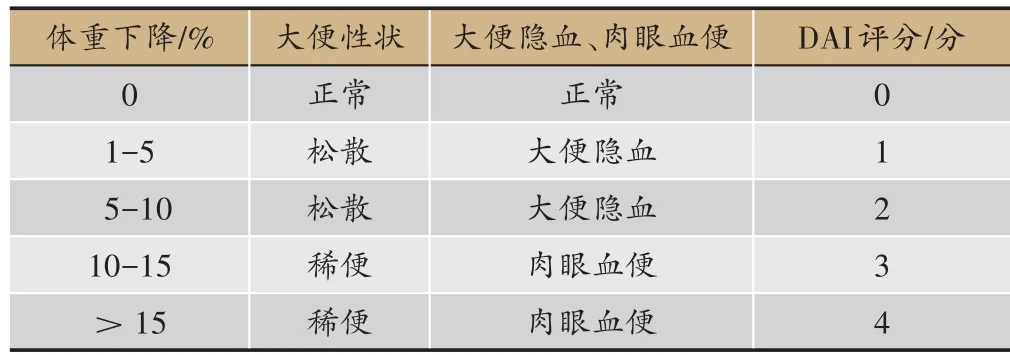
表1 DAI的评分标准
3 结果
3.1 DAI、CMDI及HS评分结果
与正常组大鼠比较,模型大鼠DAI、CMDI及结肠HS评分均明显上升,并具有极显著性差异(P<0.01);各给药组在给药治疗后,DAI、CMDI及结肠HS评分均显著低于模型组(P<0.01),且由低到高依次为醋乳香2倍剂量组、醋乳香等剂量组、乳香2倍剂量组、乳香等剂量组。其中,醋乳香组DAI与乳香等剂量组之间在给药1周后的差异具有统计学意义(P<0.01);醋乳香2倍剂量组CMDI及结肠HS评分与其他给药组之间的差异均具有统计学意义(P<0.01)(表2,表3)。
3.2 结肠组织病理切片结果
正常组大鼠结肠黏膜完整,未见溃疡、水肿,也无炎症细胞浸润(图1A)。模型组可见炎症累及肠壁全层,部分表面上皮脱落,隐窝破坏,肌层肉芽组织生长,腺体排列不规则,淋巴细胞、中性粒细胞等炎性细胞浸润,符合溃疡性结肠炎的组织病理学改变,病变最为严重(图1B)。经乳香及醋乳香干预后,各给药组呈现不同程度的修复作用,显微镜下可见较局部的隐窝破坏伴有上皮再生修复和腺体增生,增厚的炎症组织与正常组织交织,中性粒细胞浸润,伴有巨噬细胞、淋巴细胞、纤维细胞存在,腺体也有不同程度的改善,而乳香等剂量组(图1C)及2倍剂量组(图1D)病理改变逊色于醋乳香等剂量组(图1E)及2倍剂量组(图1F)。
表2 DAI评分的比较(±s,n=10)
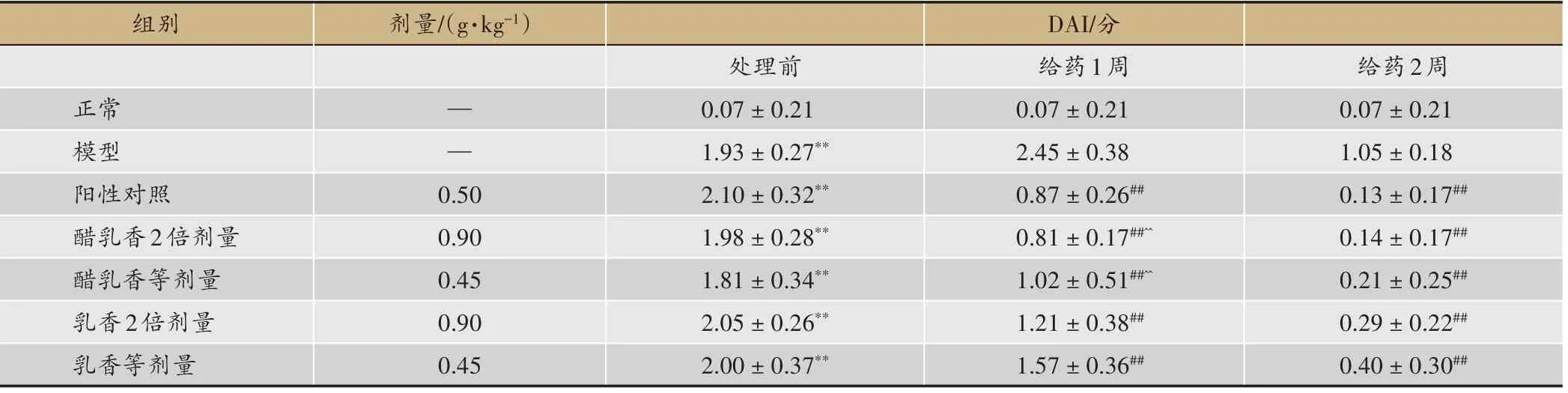
表2 DAI评分的比较(±s,n=10)
注:与正常组比较**P<0.01;与模型组比较##P<0.01;与乳香等剂量组比较^^P<0.01。
?
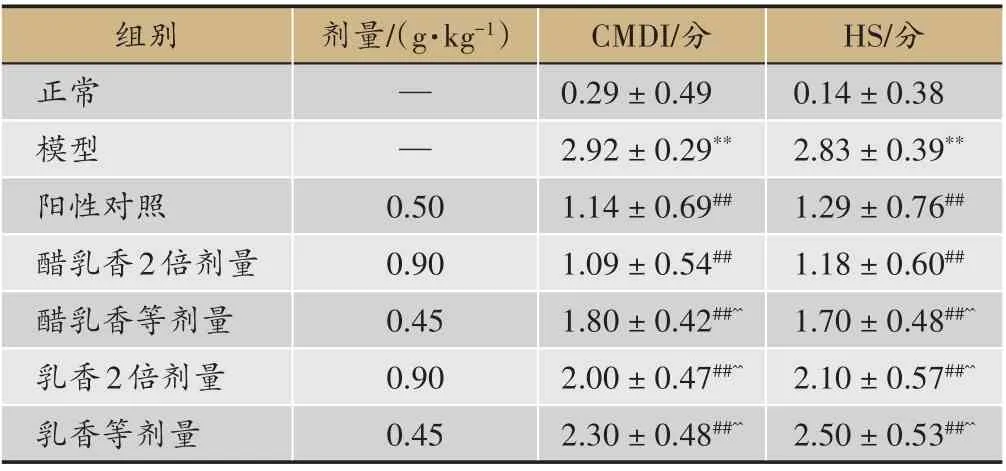
表3 CMDI以及HS评分的比较(x±s,n=10)
3.3 血清中细胞因子TNF-α、IL-1β、IL-6检测结果
结果显示(图2),正常组与模型组大鼠血清中细胞因子的水平分别为TNF-α:91.93±16.95、232.60±33.201 pg·mL-1,IL-1β:34.00±25.53、249.71±25.527 pg·mL-1,IL-6:336±77.79、587.67±103.62 pg·mL-1,模型组高于正常组,且具有极显著性差异(P<0.01)。阳性对照组低于模型组,且具有极显著性差异(P<0.01)。
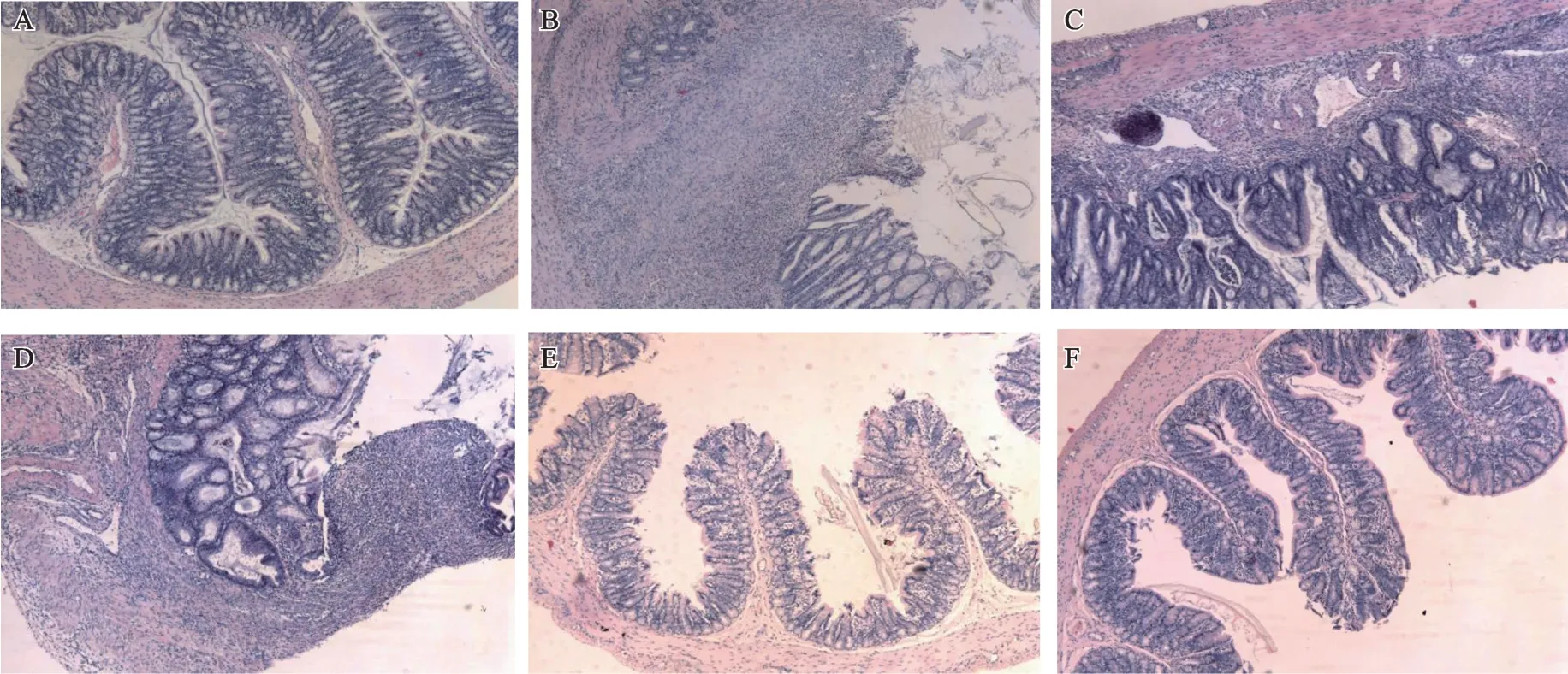
图1 各组结肠组织病理切片结果
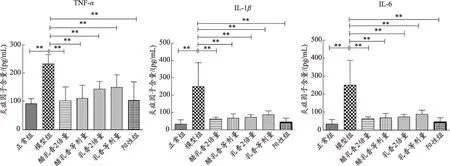
图2 大鼠血清中细胞因子TNF-α、IL-1β和IL-6的表达
乳香与醋乳香等剂量组给药后,结肠炎大鼠血清中各细胞因子水平分别为:TNF-α:148.60±45.05、111.933 ±44.78 pg·mL-1,IL-1β:88.29±22.23、66.86±24.31 pg·mL-1,IL-6:436.00±114.20、417.67±103.71 pg·mL-1,与模型组相比,均显著降低(P<0.05)。而乳香与醋乳香等剂量组间没有统计学差异,但从数值趋势上看,醋乳香较乳香炎症因子水平更低。
乳香与醋乳香2倍剂量组血清中各细胞因子水平分别为:TNF-α:143.27±26.38、101.93±49.10 pg·mL-1,IL-1β:74.00±12.96、39.71±33.38 pg·mL-1,IL-6:434.33±97.87、399.33±128.61 pg·mL-1,与模型组相比,均显著降低(P<0.05)。两个给药组之间虽无显著性差异,但从数值趋势上看醋乳香2倍剂量组较乳香炎症因子水平更低。
另外,醋乳香等剂量组与2倍剂量组之间虽无显著差异,但从数值趋势上来看,醋乳香2倍剂量组炎症因子水平明显低于等剂量组。
4 讨论
UC是一种自身免疫性疾病,与精神、感染、免疫、遗传等多种因素密切相关,其病程长,易反复发作[15]。TNF-α、IL-1β和IL-6在UC中被公认为是促炎细胞因子,参与UC炎症反应和免疫应答[16]。研究证明细胞因子TNF-α、IL-1β以及IL-6水平在UC患者血清中显著升高,且与病变程度及累及范围相关,病情缓解后3种炎症因子水平显著降低[17-18]。本研究结果显示,TNBS∕乙醇造模后,模型组大鼠血清中细胞因子TNF-α、IL-1β和IL-6的表达水平均显著高于正常组,结合DAI、CMDI、HS评分以及病理学切片,显示大鼠UC模型造模成功。三种细胞因子在阳性对照组中的表达水平显著低于模型组,说明实验具有可靠性。乳香和醋乳香各给药组大鼠DAI、CMDI以及HS评分均显著低于模型组,三种细胞因子的表达水平均显著低于模型组,说明乳香、醋乳香可以通过降低炎症因子水平对UC具有明显的治疗作用。综合各指标的数值趋势,提示醋乳香的抗炎作用优于乳香,且以2倍剂量组作用最显著。
乳香中主要含有五环三萜、四环三萜、大环二萜以及挥发油等成分[19-21]。骨架结构为五环三萜类化合物的乳香酸组分(Boswellic Acids,BAs),是其最主要的活性组分,具有抗炎作用[22-24]。11-羰基-β-乳香酸(11-keto-β-boswellic acid,KBA)、3-乙酰-11-羰基-β-乳 香 酸(3-acetyl-11-keto-β-boswellic acid,AKBA)、α-乳香酸(α-boswellic acid,α-BA)、β-乳香酸(β-boswellic acid,β-BA)、3-乙酰-α-乳香酸(3-acetyl-α-boswellic acid,α-ABA)和3-乙酰-β-乳香酸(3-acetyl-β-boswellic acid,β-ABA)为含量最高的6种乳香酸成分[18]。其中,含有11位羰基结构的11-羰基乳香酸和3-乙酰-11-羰基乳香酸抗炎作用最强[25]。而乳香醋炙后,五环三萜类成分含量显著增加,尤以含有11位羰基结构的乳香酸含量增加最多[2]。同时,醋炙后含量显著增加的还有9,11-α-去氢-乳香酸、9,11-β-去氢-乳香酸、3-乙酰-9,11-α-去氢乳香酸和3-乙酰-9,11-β-去氢乳香酸,有报道显示相较于醋炙前的11-羰基结构成分,具有9,11去氢结构的乳香酸抗炎活性更强[26]。另一方面,乳香酸类成分生物利用度较低,而乳香醋炙后两个主要乳香酸成分KBA和AKBA的血药峰浓度(Cmax)以及药时曲线下面积(AUC)均显著增加[27]。肠外翻实验也显示,主要乳香酸成分在乳香醋炙后肠渗透率显著增加[28]。醋炙后乳香酸成分含量增加,同时吸收作用增强,这些变化应该都与乳香醋炙后抗炎活性的增强有关。因此导致了与乳香相比,醋乳香可以对UC发挥更加显著的治疗作用。本研究在丰富中药传统炮制理论同时,也为UC临床治疗提供了思路。

