基于干眼症细胞凋亡模型观察淫羊藿总黄酮含药血浆对foxp3mRNA的作用*
王 方,万咪咪,卢书娟,胡文婧,石玉恒
(1.贵州中医药大学第二附属医院眼科 贵阳 550003;2.贵州中医药大学 贵阳 550003)
干眼症是一种慢性眼表疾病,据统计全球有超过10亿干眼患者,发病率约为5.5%~33.7%,而我国干眼患者人数就超过1亿人,患病率占21%~30%。眼科门诊30%的病人以“眼干、眼涩”为主症前来就诊,已成为目前患病人数最多的眼科慢性病,因此,患者本人和社会医疗都投入非常大的资金来投入干眼的治疗。干眼症是由许多要素引起的眼表疾病。患者出现长期疲劳、瘙痒、疼痛等刺激症状为主要临床表现,严重扰乱患者的正常生活。免疫相关的炎症反应是干眼发病中的关键要素,大量炎症因子被激活,加速泪腺、角结膜上皮细胞凋亡[1],使眼球的表面功能受到侵害,泪膜的相对稳定性降低[2]。早在《本草纲目》中就有对淫羊藿治疗眼疾的记载,大量研究证实淫羊藿苷具有调节免疫系统功能的活性[3]。为中药干预免疫炎症所致的干眼症开辟了新的机会,在此基础上,本研究观察了淫羊藿总黄酮含药血浆对干眼症细胞凋亡模型免疫反应相关因子的影响。
1 和实验材料和操作步骤
1.1 实验动物
本研究实验动物约2.0~2.5 kg/只的一个月龄远交系新西兰大耳雄兔,用普通饲料喂养。
1.2 主要试剂、耗材和仪器
本研究的主要试剂、耗材和仪器:DMEM/F12(Hyclone,SH30023.01B)、胎 牛 血 清(Hyclone,SH30070.03)、青霉素/链霉素(Hyclone,SV30010/100 mL)、胰酶(Hyclone,SH30042.01/100 mL)、10%水合氯醛(100 mL蒸馏水,完全溶解10 g水合氯醛)、3.8%枸橼酸钠溶液(100 mL蒸馏水加入3.8 g枸橼酸钠)、PBS(南 京 生 兴 物,SN331SN331)、DMSO(sigma,C6295C6295-50 mL)、SYBR®Premix Ex Taq(Takara,RR820A,即SYBR green溶液)、RNAiso Plus(Takara,9108,即Trizol)、氯仿(Trichloromethane,上海阿拉丁生化,C128130)、异丙醇(isopropanol,上海阿拉丁生化,I112011)、乙醇(ethanol,上海阿拉丁生化,E111989)、DEPC(Diethyl pyrocarbonate,上 海 阿 拉 丁 生 化,D105557)、MTT(biosharp,5 g)、PrimeScript™RT reagent Kit with gDNA Eraser(Takara,RR047A)、CO2培养箱(Thermo fisher,3131)、离心机(北京医用离心机厂生产)、0.45µm手控式负压过滤器(长沙鹏程生物有限公司)、超低温冰箱(沈阳市医疗设备生产厂)、血球计数板(上海求精生化)、酶标仪(Thermo fisher,Multi Multiskan skan 51119000)、Stepone plus荧光定量PCR(ABI)、PCR仪(ABI,Veriti)、Nano drop 2000(Thermo fisher)、引物(引物序列见表1)。
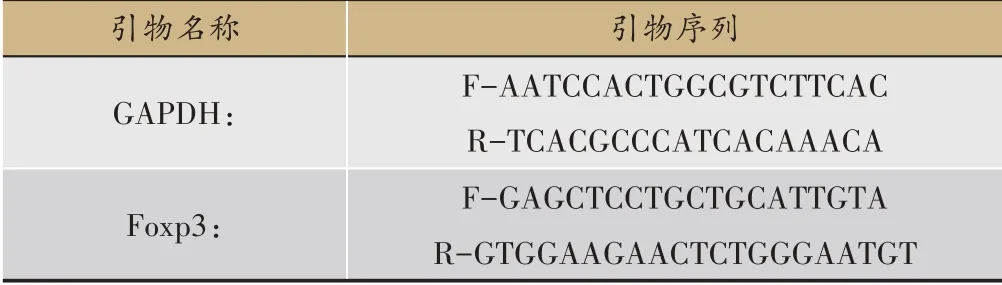
表1 引物
1.3 雄兔泪腺上皮细胞的原代培养
取健康1月龄、雄性新西兰大耳白兔(2.02.5 kg/只)1只,经空气栓塞法处死后无菌操作下取出其泪腺,用PBS平衡溶液洗涤3次后,将其置于储备溶液中,剥离其上的血管和纤维结缔组织。将漂洗后的泪腺分为3块(1-2 mm×1-2 mm/块)。混合新鲜制备的2 g·L-1II型胶原酶,并在37℃下孵育25分钟。离心后的泪腺上皮细胞贴壁纯化,在含有5%的CO2培养箱中于37℃培养。36小时和2天后,分别更换半量和全量的溶液,然后每4天更换一次液体。后每隔10天进行一次传代。将第三代细胞用于实验。
1.4 淫羊藿总黄酮含药血浆的制备
将60只雄兔随机分为4个淫羊藿总黄酮组:10倍、5倍、2.5倍剂量组和空白组。根据体表面积转换的方法,计算每只兔子的药物量(兔的药物量=人的药物量×70×0.07),其中人的药物量为26 mg/kg,故兔子的药物量为85.02 mg/kg,并给予空白组同等剂量的0.9%氯化钠溶液。各组灌胃一周后,以空气栓塞法处死兔,立即心脏穿刺抽取动脉血置入离心管,并与3.8%枸橼酸钠溶液(枸橼酸钠∶血=1∶9)颠倒混匀。离心后提取上清液。-80°C下0.45µm手动负压过滤器过滤分配和储备。
1.5 探讨添加含药血浆的量(MTT细胞毒性试验)
将培养好的第三代泪腺上皮细胞用DMEM/F12配置成细胞悬液(100×103个/mL),96孔板中每孔种90µL,待细胞贴壁后,加入不同浓度的含药血浆,每孔总体积为200µL,培养24小时后,去除培养基,加入含有10µL MTT(5 mg/mL)的无血清培养基,在细胞培养箱中继续培养约4 h。4 h后去除培养基,每孔加入150µLDMSO,摇晃均匀5分钟,微量板读数仪在490 nm波长测定每孔吸光值(OD值)。计算每组空白血浆中细胞的抑制率:抑制率=1-实验组OD值/对照组OD值。以50%抑制率的浓度作为选择浓度。通过公式计算各组抑制率。公式为:LgIC50=Xm-I(P-(3-Pm-Pn)/4),其中Xm∶Lg最大剂量,I∶Lg(最大剂量/相临剂量),P:抑制率之和,Pm:最大抑制率,Pn:最小抑制率。
1.6 细胞模型的建立和含药物血浆的干预
将泪腺上皮细胞培养在(含10%胎牛血清、100 U/mL青霉素、100 ug/mL链霉素)DMEM/F12培养基中,置于37℃含5%CO2的细胞培养箱中。当细胞长至80%~90%时,去除培养基,加入PBS洗1~2次。去除PBS后,再加入1 mL胰酶进行消化,1-3 min后加入3 mL完全培养基以中和胰酶而停止消化过程。将消化完成的细胞转移至15 mL离心管中,1000 rpm离心5分钟。去除上清液,加入3 mL培养基重悬细胞,1:3传代至培养皿中培养。将长到培养皿80%~90%的泪腺上皮细胞用胰酶消化下来,1000 rpm离心后去除上清,加入完全培养基重悬细胞,将细胞种在6孔板中(每孔1×106个细胞)。细胞融合后2小时,将培养的细胞随机分为淫羊藿总黄酮、雄激素组和空白组,各组加入不同的培养基内培育48小时。淫羊藿总黄酮组培育于含有淫羊藿总黄酮和15%胎牛血清的DMEM/F12低葡萄糖培养基。雄激素组培育于含有1×106moL/L丙酸睾酮和15%胎牛血清的DMEM/F12低葡萄糖培养基。空白组培育于空白血浆和15%胎牛血清的DMEM/F12低葡萄糖培养基。
1.7 RT-PCR技术测定含药血浆对Foxp3表达的影响
1.7.1 RNA提取
样品处理:将培养完成的细胞置于100µmol/L的过氧化氢中诱导细胞凋亡,60分钟后去除培养基,PBS洗细胞。除去PBS,加入1 mL trizol,室温下2分钟后,将其转移到不含RNA酶的EP管中。放200 uL氯仿后用力摇晃15秒。相分离:室温静置15分钟。离心后转移上清液进新的EP管。RNA沉淀:加入同一量的异丙醇混合后离心。RNA洗涤:除去上清液后混合1 mL 75%乙醇,将混合物振荡15秒,然后离心。RNA溶解:除去上清液,静置3~5分钟。溶解于50µL DEPC水,nanodrop检测浓度,保存于-80℃冰箱。
1.7.2 逆转录
去除基因组DNA:在冰上进行反应液的配制(6µL RNA、1µL DNA污染清除试剂、2µL DNA污染清除缓冲液、1µL DEPC水)然后放置于室温,反应10分钟。逆转录PCR反应:将10µL第一步反应液、4µL反应缓冲液5×Primescript Buffer、1µL反转录酶5×Primescript RT Enzyme Mix、4µL反转录随机引物RT Primer Mix、1µL DEPC水混合后,在PCR仪器中进行逆转录(37℃,15分钟,85℃,5秒)。
1.7.3 荧光定量PCR
整个试剂配制体系在冰上配制:10µL SYBR Green solution、7.2µL灭菌双蒸水、2µL cDNA、0.4µL PCR上游引物(10µM)、0.4µL PCR下游引物(10µM)。SYBR green是混匀好的试剂,里面有Taq polymerase,dNTP,Sybrgreen染液,反应缓冲液。轻轻混匀试剂后,使粘附在壁上的液体离心到底层。使用上述反应系统将8个管置于定量PCR测定中。PCR反应结束后,直接将8连管丢弃,直接根据仪器收集的数值对数据进行分析即可。
1.7.4 RT-PCR实验
RT-PCR法检测采用染料法(SYBR Green I),按照ΔΔCt解析法来进行设计,对Foxp3mRNA行相对定量分析:明确对照样本与处理样本及所有样本的目的基因及其持家基因的Ct值;求出ΔCt=Ct未知-Ct持家基因,ΔΔCt=ΔCt未知-ΔCt对照;求相对含量,即相对含量=2-△△Ct。
1.7.5 统计学分析
图1 原代细胞
图2 第二代细胞
图3 第一代细胞
本研究的实验数据通过SPSS23.0统计软件处理,计量资料以(xˉ±s)表示。单因素方差分析用于组间比较,t检验用于比较之前和之后。计量资料通过χ2检验进行分析,P<0.01被认为具有统计学意义且差异显著。
2 结果
2.1 泪腺上皮细胞培养
在显微镜下可见原代细胞胞膜清亮。第一代细胞部分附着在培养表面,部分伪足突出。第二代细胞胞体肥大透明,胞膜清楚,中央可见细胞核,生长活跃。第三代细胞看到细胞全部粘附、伸长,可单层融合。各代细胞见图1~图4。
2.2 含药血浆加入量的确定
图4 第三代细胞
图5 每组中GAPDH的扩增曲线图

图6 每组中GAPDH的溶解曲线图
淫羊藿总黄酮10倍、5倍、2.5倍剂量组和空白组细胞抑制率分别为(0.08±0.09)%、(0.09±0.06)%、(0.05±0.06)%、(0.02±0.06)%,因此,选择2.5倍组作为选择的目标浓度。
2.3 GAPDH在不同样本中的数据分析
从图像中可以看出,每组中的GAPDH扩增效果令人满意,并且样品的逆转录是顺利的。GAPDH的扩增曲线和每组的扩增后融解曲线的分析见于图5和图6中。
2.4 Foxp3mRNA表达量分析
Foxp3mRNA表达相对含量(2-ΔΔCt)见表2。每组中的Foxp3mRNA扩增曲线和融解曲线分析见于图7和图8中。淫羊藿总黄酮组Foxp3mRNA的含明显高于雄激素组和空白组(P<0.01);雄激素组Foxp3mRNA的含量明显高于空白组(P<0.01);空白组Foxp3mRNA的含量显著低于总黄酮和雄激素组(P<0.01)。
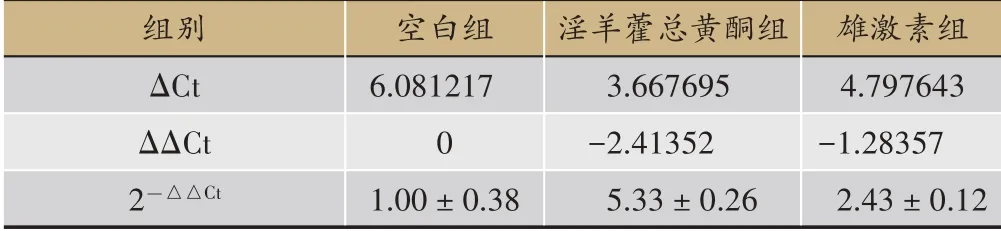
表2 每组Foxp3mRNA表达相对含量(2-△△Ct)
图7 每组中Foxp3mRNA的扩增曲线
图8 每组中Foxp3mRNA的溶解曲线
3 讨论
干眼症的发病率在全球范围内逐年上涨,在中国目前约21%~30%[4-5]。在对其50余年的研究中发现,人眼本身具有免疫赦免的特性,而这种赦免一旦被打破,免疫性眼病发生的风险就随之提高[6],而干眼症正是这样一个因免疫紊乱而介导的眼表疾病。在国际泪膜和眼表协会(the Tear Film&Ocular Surface Society,TFOS)干眼疾病工作组第二次会议(TDOS Dry Eye WORKshopⅡ,TFOSDEWSⅡ)中指出,干眼的危险因素包含了结缔组织病、干燥综合征等免疫系统疾病,并且提到使用激素及免疫抑制剂是应对干眼的一个治疗措施[7],也再次证实了干眼与免疫应答机制失衡之间有着密不可分的紧密联系。调节性T细胞在眼表免疫应答的发展和进展中举足轻重,很多血清学或细胞水平的研究都证实T细胞在自身免疫性疾病中都有异常改变[8]。调节性T细胞是一类可调节免疫细胞增殖、分化与功能,占维持机体免疫稳态和免疫耐受的外周CD4+T淋巴细胞亚群的5%~10%,其在诸如自身免疫疾病、肿瘤、器官移植和慢性感染等疾病中起重要作用。根据其发育分化、抗原特异性与效应机制的不同,可将其分为产生自胸腺的胸腺源性Treg细胞,由初始T细胞在外周组织中或体外诱导分化而来的表达Foxp3(forkhead box p3)的诱导性Treg细胞。除控制自身反应性T细胞的激活和增殖外,Treg细胞还涉及各种免疫抑制功能的控制[9]。Foxp3作为Treg分化发育的特异性核转录因子,是本研究通常所说的Foxp3+Treg谱系发育、表型和功能的决定基因[10-11],其对于自身免疫疾病等炎症性疾病的发生,发展和易感性至关重要。Foxp3通过多种途径实现免疫抑制作用,包括了诱导抑制性细胞因子产生的途径、调节抗原递呈细胞功能的途径、免疫介导细胞凋亡的途径、干扰细胞代谢的途径,最后通过转录水平和蛋白质的翻译后调控实现细胞功能的管理[12]。转录因子Foxp3因其蛋白表达、转录复合体动态组装及其稳定性,可反映Treg的活性水平,被认为是调节性T细胞的标志分子,其在调节性T细胞的发育,分化和维持中起重要作用[13-19]。当调节性T细胞丢失或改变其Foxp3表达时,其引起调节性T细胞的数量和功能的异常,就无法发挥其免疫负性调节作用[20],导致免疫紊乱和自身免疫疾病的发生[21]。在对诸多免疫相关疾病,如哮喘、过敏性鼻炎、银屑病、类风湿性关节炎等疾病的研究中心都发现了Foxp3的低表达,这可能与人类染色体上Foxp3蛋白编码基因突变导致的Foxp3+Treg功能紊乱有关。因此,干眼作为一个免疫相关性眼病,其与Foxp3的表达之间有着密不可分的关系。
目前,中药调节免疫的作用治疗干眼症是一个研究的热点,因其具有安全、有效、廉价的优势,受到广大中医工作者及患者的青睐[22]。临床上常规使用复方治疗干眼症,而近年来对单味药治疗干眼症的研究愈加深入[23]。早在《本草纲目》中就有对淫羊藿的记载,曰:“淫羊藿味甘气香,性温不寒,能益精气……真阳不足者宜之”。淫羊藿亦名仙灵脾、放杖草、弃杖草、千两金、干鸡筋、黄连祖、三枝九叶草、刚草,性味辛、寒、无毒,在眼科上可用于治疗日昏生翳、病后青盲、小儿雀目、痘疹入目等眼病。干眼症在中医眼科上属于“白涩病”的范围,又称“干涩昏症”及“神水将枯症”“神气枯瘁”。眼的干燥为干涩不通之疾。五脏正常功能受“燥”所伤,必会导致肺、肝、肾之功能失调,精血阴液不足,润泽目珠之津精化生不足,目珠失于润泽而致干眼症的发生。而淫羊藿作为一味能够益精气、补真阳的补阳药,通过补肺、肝、肾的阳气,从而推动气的生成和运化,气行则津液自能运化和生成,眼球则得以润泽。从现代药理学的研究进展上来看,淫羊藿总黄酮因其具有的对机体双向调节免疫功能[24]而广泛地取得了科研工作者的关注和。黄酮类化合物广泛存在于植物的根、叶、花和种子等不同部位中,淫羊藿则是这样一种全草供药用的植物。黄酮类化合物被认为在抗炎,抗菌,抗病毒,抗肿瘤和抗氧化中起重要作用,但是近年来,黄酮类化合物因其增强NK细胞和细胞毒性T细胞的杀伤活性以及细胞因子的释放的强大作用被认为是天然且高效的免疫调节剂[25],其可以提高抗体效价[26]和免疫器官指数,增强黏膜免疫[27],改善机体免疫系统。黄酮类化合物主要通过介导T细胞及NK细胞等免疫细胞信号通路调控相关免疫分子、基因和蛋白质表达来实现对免疫细胞的调控。黄芪桂枝五物汤总黄酮就被真是能够显著提高小鼠T淋巴细胞的细胞毒活性及水平来增强细胞免疫[28]。淫羊藿总黄酮是淫羊藿的主要有效成分[29],同样主要活性成分为黄酮类物质的淫羊藿也被大量文献证实可协同调节T细胞,抑制淋巴细胞凋亡和坏死[30]。其重塑T淋巴细胞凋亡相关基因平衡的作用,与本研究调节干眼眼表免疫环境稳定性的目的不谋而合,为淫羊藿总黄酮治疗干眼症的可行性提供了依据。
目前,针对不同类型不同程度的干眼,都有各种不同的治疗方案,但是都有其弊端及不足。针对泪液分泌不足型的干眼症,轻者可以通过补充人工泪液或使用促泪液分泌剂来缓解,但是人工泪液需常年使用,且并不能从根本上解决眼干本质。促泪液分泌剂大部分都是胆碱能受体激动剂,最常见的副作用就是多汗、头痛、恶心、呕吐等。在治疗依然无效的情况下则需要使用泪点栓塞的方法,但是溢泪、化脓性肉芽肿、泪小管炎、泪囊炎等并发症的风险及对手术的畏惧心理让很多患者止步。针对蒸发过强型的病人,睑板腺按摩是首选,但是视频终端使用的不可避免、年龄的增长、糖尿病等内科疾病的并发症会导致治疗的效果维持时间很短,甚至是效果不佳。对于严重的干眼病人局部使用抗生素或非甾体抗炎药疗效可观,但是副作用也不容忽视。非甾体抗炎药本身可以引起角膜敏感性下降,影响角膜上皮损害修复,激素使用后会出现眼压升高、后囊型白内障的形成,且这些药物均含有防腐剂,可加速干眼症形成。因此作为一个中医的追随者,发扬中医中药的独特优势,寻找一个安全、有效、可推广的中医药治疗方法和中草药免疫抑制药物迫在眉睫。
本实验通过对干眼症泪腺上皮细胞凋亡模型含药血浆干预后,定量PCR检测泪腺组织中Foxp3mRNA的阳性表达。淫羊藿总黄酮血浆组中Foxp3mRNA的含量明显增加,与其他组有显著差异(P<0.01)。研究结果表明,淫羊藿总黄酮可以增加泪腺组织中Foxp3mRNA的含量,相比雄激素有着显著差异。
本研究的结果表明,淫羊藿总黄酮含药血浆可以促进Foxp3mRNA含量的途径而减少细胞凋亡。但是调控眼表免疫反应的通路诸多,也伴随着相关因子表达量的变化[31]。Foxp3作为一个免疫相关因子,能一定程度上体现细胞凋亡的水平,但是并不全面。在未来的相关研究中期待可以从调节性T细胞、细胞毒性T细胞和辅助性T细胞等多个因子方面,综合观察免疫对其表达的影响,以更全面地评估含药血浆对细胞凋亡的抑制作用。淫羊藿总黄酮是一种天然药物,资源丰富,分离提纯工艺成熟,且其疗效肯定[32],可能成为一种新的具有免疫抑制作用的中药,以避免激素、免疫抑制剂等所造成的副作用、起效慢等缺点[33]。但其最佳有效使用剂型及用法、用量等,值得更大样本、大数据的研究。

