细胞外泛素对肝癌细胞增殖、侵袭和迁移能力的影响
张 杨, 陈淑英, 徐光如
1 上海市浦东新区人民医院 肿瘤科, 上海 200120; 2 复旦大学附属华山医院 检验科, 上海 200040
肝细胞癌(以下简称肝癌)是已知最常见的高度恶性肿瘤之一,其发病率和死亡率均居前五位[1]。目前肝癌在临床上以手术切除为主,化疗和放疗为辅,具有高复发率、高转移率和低长期生存率的特点[2]。大量临床研究[3-6]发现,肝癌围手术期输血与肝癌术后复发率和生存率密切相关,但其可能的机制仍不明确。有文献[7]报道,血液离体后,细胞外泛素含量与储存时间具有显著的线性关系;近期相关研究[8-9]证实泛素能明显促进肿瘤进展。而在临床实践中,血液采集后用于临床输血治疗时多已储存>20 d[10],因此笔者提出假设,血液中细胞外泛素可能与肝癌术后的不良预后存在因果关系。本文旨在通过体外实验研究细胞外泛素对肝癌细胞增殖、侵袭和迁移的影响,从而为进一步探索细胞外泛素与肝癌预后的相关性提供一定的理论基础。
1 材料与方法
1.1 材料 来源于肝母细胞瘤的肝癌细胞株HepG2(中国科学院上海细胞库);胎牛血清(Gibco公司);DMEM培养基(HyClone公司);胰蛋白酶-EDTA消化液(Gibco公司);DMSO(Sigma公司);CCK8细胞增殖检测试剂盒(Diojindo公司);泛素(4841-100,Biovision);6孔板(Corning 公司);24孔板(Corning公司);96孔板(Corning公司);Transwell小室(Corning公司);基质胶(Corning公司);结晶紫(碧云天生物有限公司);MMP-9抗体(CST生物公司,美国);β-actin抗体(碧云天生物有限公司);二抗(山羊抗小鼠,碧云天生物有限公司)。
1.2 不同浓度细胞外泛素的配制 首先,取5支15 ml无菌离心管分别进行编号(1#、2#、3#、4#、5#)。其次,在1#管中加入6.5 ml无菌DMEM,2#~5#管中分别加入6 ml无菌DMEM;取20.8 μl泛素原液(1 μg/μl)加入到1#管中,配制成浓度为3200 ng/ml的泛素储备液。最后,采用倍比稀释法,从1#管中取6 ml加入到2#管中,以此类推,最终配制成目标浓度为200、400、800 ng/ml的泛素储备液,-20 ℃低温储存备用。
1.3 细胞培养和细胞分组 利用含有10%胎牛血清的DMEM培养基,在37 ℃、5% CO2的培养箱中培养HepG2细胞。当HepG2细胞处于最佳状态时,在6孔板中接种5×104个细胞/孔,继续在37 ℃、5% CO2的培养箱中培养。当细胞融合度达到约80%时,分别用不同浓度的细胞外泛素(200、400、800 ng/ml)进行干预,然后在37 ℃、5% CO2的培养箱中孵育30~60 min。实验共分为4组:空白对照组,即向HepG2细胞中加入等剂量的DMEM;200、400、800 ng/ml泛素干预组,即利用不同浓度的泛素分别干预HepG2细胞。
1.4 CCK8法检测细胞增殖 取对数期细胞,胰酶消化后用完全培养基重悬细胞。96孔板中每孔接种5×103个细胞/100 μl,分别用不同浓度细胞外泛素干预细胞,每组设6个复孔。轻轻混匀后,将培养板放在培养箱中分别培养24、48、72、96 h后,去除培养液,每孔分别加入100 μl含10% CCK8的DMEM溶液,将培养板放在培养箱内孵育3 h后取出。最后使用酶标仪在450 nm处检测各孔的吸光度值,实验重复3次。
1.5 Transwell实验检测细胞侵袭 首先,进行实验前准备,即用无血清培养基对肝癌细胞进行过夜培养,在Transwell板上室铺设基质胶(将无血清培养基和基质胶按1∶6稀释后,分别在上室加入100 μl,然后置于37 ℃恒
温培养箱中孵育4~5 h,使基质胶充分凝固)。其次,用无血清的DMEM将肝癌细胞稀释为5×104个/ml,分别在各实验组Transwell小室的上室加入100 μl的细胞悬液和不同浓度细胞外泛素,下室加入500 μl含20%胎牛血清的培养基,用无菌镊子小心将上室浸没在下室液体中。最后,将含有Transwell小室的24孔板置于37 ℃恒温培养箱内孵育24 h。24 h后,将上室内液体去除,放入盛有600 μl PBS的孔内,轻轻“十字”交叉清洗3次。结晶紫染色后,将上室置于电子显微镜下观察,并拍照。
1.6 划痕实验和蛋白免疫印迹检测细胞的迁移能力 用标记笔和直尺在6孔板背后均匀地划横线(间隔约0.75 cm),横穿过孔,每孔至少穿过5条线;取对数生长期的细胞,置于6孔板,细胞密度为5×105/孔,每组设3个复孔。待细胞呈现单层贴壁生长时,用10 μl的消毒枪头在24孔板垂直划痕,避免倾斜;用PBS清洗去除划痕处划下的悬浮细胞,分别加入不同浓度的细胞外泛素;放入37 ℃ 5% CO2培养箱内培养。分别在0、15、27、34 h置于显微镜下拍照,实验重复3次。根据文献[11]报道中的蛋白免疫印迹方法,检测400 ng/ml泛素对肝癌细胞迁移能力的影响。
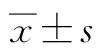
2 结果
2.1 细胞增殖实验检测不同浓度细胞外泛素对肝癌细胞增殖的影响 随着时间的增加,细胞外泛素能明显促进肝癌细胞的增殖,且具有明显的浓度依赖性。其中400 ng/ml泛素组对细胞增殖的促进作用最为明显,在48、72、96 h相对吸光度值均明显高于对照组(P值均<0.05)(表1)。
2.2 细胞侵袭实验研究不同浓度细胞外泛素对肝癌细胞侵袭能力的影响 细胞外泛素能明显促进肝癌细胞的侵袭能力(图1a);与对照组细胞的侵袭个数相比,不同浓度的细胞外泛素均可明显促进肝癌细胞的侵袭(P值均<0.05),其中400 ng/ml泛素组对肝癌细胞侵袭能力的促进作用最为显著[(134.00±8.18)个 vs (347.33±18.90)个,t=17.94,P<0.001](图1b)。

表1 各实验组细胞不同培养时间下的相对吸光度值的比较
注:与对照组比较,1)P<0.05。
2.3 细胞迁移和蛋白免疫印迹试验检测400 ng/ml泛素对肝癌细胞迁移功能的影响 400 ng/ml泛素明显增加了肝癌细胞的迁移能力(图2a)。蛋白免疫印迹结果显示,与对照组相比,肿瘤迁移相关指标MMP-9的表达在400 ng/ml泛素组明显增强(图2b)。
3 讨论
肝癌是一种始于肝脏细胞的恶性肿瘤,具有发病率高、早期发现难和预后差的特点,临床发现确诊时病程往往已经进展至中晚期阶段。随着医学技术的进步,使得越来越多的患者获得了手术干预的机会,围手术期备血是手术前准备的重要环节。大量的临床研究[3]发现,围手术期输血是肝癌术后复发独立危险因素,但其原因尚不明确。因此深入研究围手术期输血与术后不良预后的原因,了解引起术后复发的分子机制至关重要。
红细胞作为一种战略资源,到目前为止尚无有效的替代品。在临床实践中,将血液离体后体外储存>14 d定义为长期储存血[12]。输血是一把双刃剑,能够拯救人的生命,但也有诸多副作用[13]。前期的动物实验[14]发现,输注长期储存血与肿瘤进展有明显的因果关系,并建议肿瘤患者围手术期输血选择新鲜储存血。红细胞不仅是泛素的天然载体[15],且泛素在人类血液制剂离体贮存过程中其含量的增加与血液保存时间存在良好的线性关系[16]。研究[17]也已证实,CXCR4是泛素在细胞表面的天然受体。体外实验[18]发现,泛素可与细胞表面的CXCR4结合促进心肌血管内皮细胞的生成,抗纤维化,抑制心肌细胞凋亡[19];体内动物肿瘤转移模型中,细胞外泛素可通过CXCR4-PI3K-AKT途径促进多种肿瘤细胞的侵袭和转移[8]。近期的一项研究[9]报道,长期储存血中细胞外泛素可能与黑色素瘤的侵袭和转移存在因果关系。本研究体外细胞增殖实验结果证明,细胞外泛素能明显促进肝癌细胞的体外增殖,且在96 h达到高峰;细胞划痕实验和Transwell侵袭进一步表明,细胞外泛素可增加肝癌细胞的侵袭和迁移能力,且细胞外泛素浓度在400 ng/ml时最显著。
注:a,细胞侵袭实验(×400);b,细胞侵袭个数统计,与对照组相比,*P<0.05,**P<0.01,***P<0.001。
图1不同浓度细胞外泛素对肝癌细胞侵袭能力的影响
此外,细胞外泛素还是人体重要的内源性免疫调节剂,具有明显的免疫抑制活性,例如可降低机体炎症、减少器官损伤、延长器官移植存活时间等[20-22],因此储存血中细胞外泛素对肝癌的促进作用,可能通过以下两个方面发挥作用:一方面,细胞外泛素的免疫抑制特性打破机体正常的Th1/Th2平衡,使具有促肿瘤作用的Th2细胞因子占优势,导致再发肿瘤的风险增加;另一方面,输注衰老红细胞使微循环的血流量和功能性毛细血管密度降低50%以上,引起组织缺血缺氧,形成了有利于肿瘤生长的微环境,细胞外泛素在此过程中进一步参与触发免疫和非免疫信号传导途径,促进肿瘤的进展[13]。
综上所述,本研究结果证实体外细胞外泛素能明显促进HepG2细胞增殖,增加其迁移和侵袭能力,为进一步研究围手术期输血与肝癌不良预后的分子机制提供了一定的理论基础。

