Child-Pugh评分、MELD评分、MELD-Na评分、APASAL评分和R评分对肝硬化伴食管胃静脉曲张再出血及死亡的预测价值
马佳丽, 陈 旭, 何玲玲, 魏红山, 李 坪
首都医科大学附属北京地坛医院 消化内科, 北京 100015
食管胃静脉曲张破裂出血是肝硬化失代偿期患者严重及致命的并发症,是肝硬化相关死亡的最常见原因[1],约有50%的肝硬化患者合并食管胃静脉曲张,10年累积发生率约为44%[2]。小的静脉曲张以每年8%的速度发展为大的静脉曲张[3],静脉曲张的年出血率为5%~15%,出血的危险因素包括曲张静脉的粗细、红色征阳性和肝脏疾病的严重程度(如Child-Pugh B、C级)[4],6周病死率约为20%[5]。在严重失代偿期,如Child-Pugh C级患者中,病死率更可高达30%[6]。血管活性药物、预防性抗生素联合内镜治疗被认为是静脉曲张出血的标准治疗方案[7]。静脉曲张出血后如未进行有效的治疗,1~2年内再发出血概率约为60%[8],内镜治疗后1年内再出血率仍高达30%~40%[9-10]。对于再出血患者的筛选和早期识别具有重要的意义。
目前,有多种预后模型、评分、公式可以用于消化道出血患者的危险分层,如R评分[11]、MELD评分[12]、MELD-Na评分[13]、Child-Pugh评分[14]、AIMS65评分[15]、GBS评分[16]、mGBS评分[17]等,可以预测治疗的需要、再出血的风险及死亡等。以上各种评分模型创建的背景人群各不相同,所适用的目标患者也各有差异,Blatchford评分、Rockall评分及AIMS65评分主要适用于急性非静脉曲张性上消化道出血[18],而针对静脉曲张出血的评分系统包括R评分、MELD评分、APASAL评分[19]等,但对静脉曲张出血行内镜治疗后再出血及远期预后的预测能力尚不明确。本研究对多个针对静脉曲张出血的风险评分系统的诊断价值进行验证和比较,旨在为临床提供简单、可靠的静脉曲张再出血及远期预后的预测方法。
1 资料与方法
1.1 研究对象 选取2013年1月-2016年1月因肝硬化伴食管胃静脉曲张破裂出血于本院行内镜下治疗,内镜下明确的食管胃静脉曲张出血,并为出血首次行内镜治疗且随访时间超过3年的患者。肝硬化的诊断符合临床、实验室、影像学或组织学表现。排除标准:(1)合并心、肺、肾、脑、血液等重要脏器严重疾病影响患者常规指标者;(2)在首次内镜治疗前即合并有肝癌或其他恶性肿瘤患者;(3)曾接受经颈静脉肝内门体分流术(TIPS)、脾栓塞、脾切除+分流术/断流术等门静脉高压干预治疗患者;(4)未能按规定随访治疗,或临床资料严重缺失患者。
1.2 食管胃静脉曲张出血内镜治疗 所有肝硬化伴食管胃静脉曲张出血患者均予血管活性药物(特利加压素、生长抑素及类似物,3~5 d)、预防性抗生素(头孢美唑钠,3~5 d)和内镜治疗(入院后24 h内,血流动力学稳定后)。食管静脉曲张出血采用套扎或硬化治疗,胃静脉曲张采用组织胶三明治疗法(聚桂醇+组织胶+生理盐水)。初次治疗1周后复查,必要时再次重复治疗,此后根据静脉曲张轻重程度及消失情况,每隔3~6个月复查。静脉曲张出血停止5~7 d后,采用卡维地洛口服行二级预防(在排除禁忌证后,起始剂量为5 mg,1次/d,若能耐受,1周后增加为10 mg,1次/d,并长期维持口服治疗,出现静脉曲张再出血后停药)。
1.3 观察指标、随访及研究终点 观察指标为患者入院后,内镜治疗前的人口学及常规临床指标,如年龄、性别、体质量、血压、血常规、肝肾功能、凝血及腹部超声等影像学指标和肝性脑病、腹水、感染等并发症发生情况。随访结束至患者死亡或2019年10月,最短随访时间≥3年。以静脉曲张再出血为主要研究终点,以死亡为次要研究终点。
1.4 伦理学审查 研究方案经由首都医科大学附属北京地坛医院伦理委员会批准[京地伦科字(2018)第(021)-01号]。所有患者在治疗前充分知情并签署知情同意书。

2 结果
2.1 一般资料 共选取肝硬化伴食管胃静脉曲张出血行内镜下治疗患者401例,规律复查随访患者,其中10例患者行TIPS治疗,36例患者行脾切除+断流手术,10例患者合并有严重的肾脏及血液系统疾病影响了其常规指标,40例患者失访,最终有305例患者纳入研究,53例(17.38%)患者在随访过程中出现了静脉曲张再出血。在无再出血组中,肝硬化病因包括:乙型肝炎143例(56.75%),丙型肝炎31例(12.30%),酒精性23例(9.13%),原发性胆汁性胆管炎19例(7.54%),隐源性18例(7.14%),自身免疫性肝炎12例(4.76%),药物性4例(1.59%),原发性硬化性胆管炎2例(0.79%);再出血组中,肝硬化病因包括:酒精性27例(50.94%),丙型肝炎8例(15.09%),自身免疫性肝炎7例(13.21%),隐源性7例(13.21%),原发性胆汁性胆管炎4例(7.55%)。食管胃静脉曲张改善情况:31例患者仍合并有重度静脉曲张,196例患者静脉曲张有所减轻(轻-中度);78例患者静脉曲张根除或基本消失。再出血组和无再出血组患者间存在显著性差异的指标包括:年龄、ALT、DBil、国际化标准比值(INR)、门静脉内径、MELD评分、MELD-Na评分及R评分(P值均<0.05),其中再出血组患者DBil水平略高,凝血功能较差,门静脉内径略宽,但MELD评分、MELD-Na评分及R评分均低于无再出血组(表1)。
2.2 5种风险评分系统之间的相关性 Spearmen相关分析发现,除了APASAL评分与MELD评分、R评分,MELD-Na评分与R评分以外,余下风险评分系统之间均存在相关性(P值均<0.001)(表2)。
2.3 5种风险评分系统对静脉曲张再出血的诊断价值比较 ROC曲线分析发现,5种风险评分系统对静脉曲张再出血的预测价值均有限[ROC曲线下面积(AUC):0.537~0.647],其中MELD评分、MELD-Na评分和R评分具有一定的预测价值(P值均<0.05)(表3,图1)。
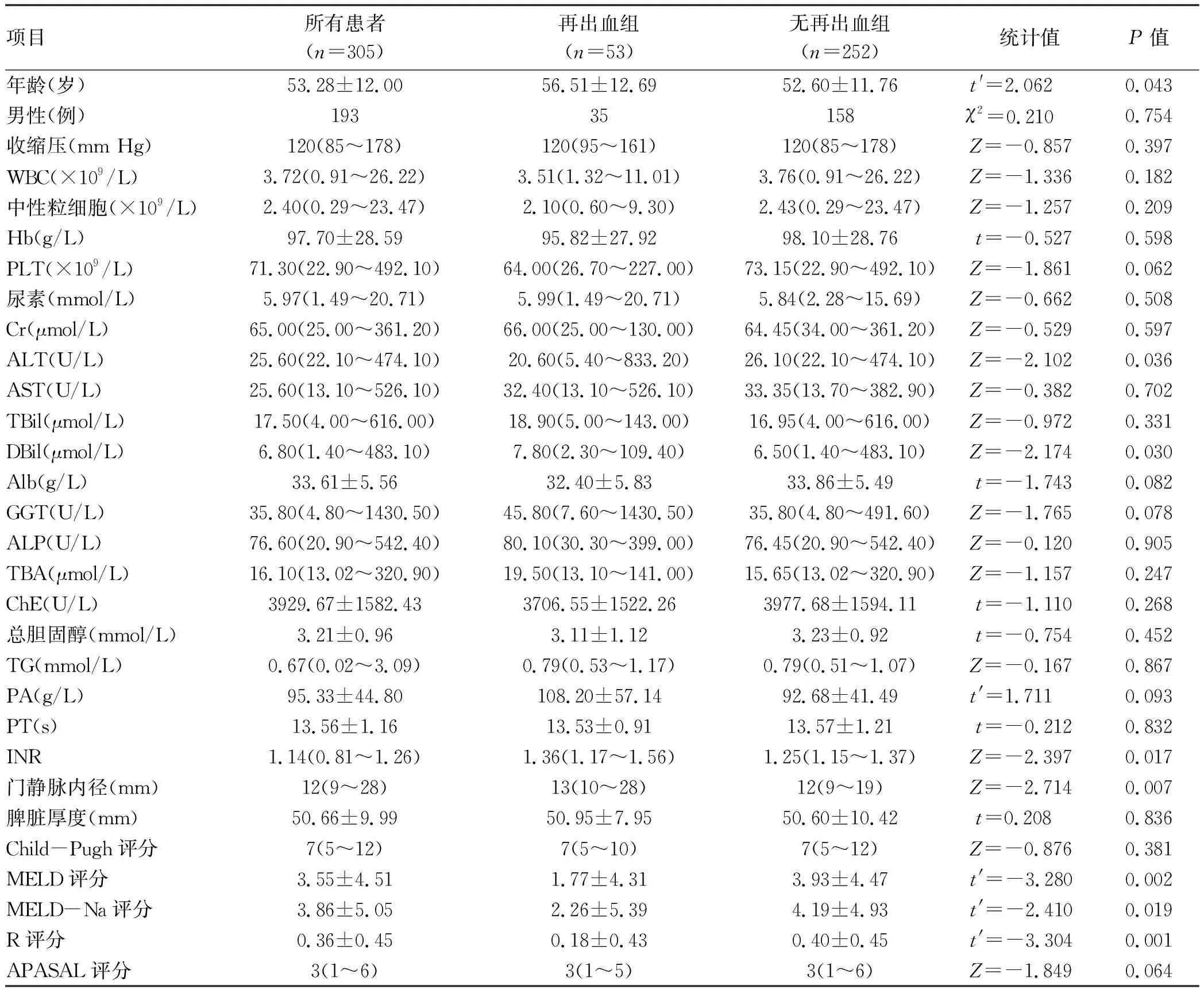
表1 患者基线指标比较
注:Cr,肌酐。
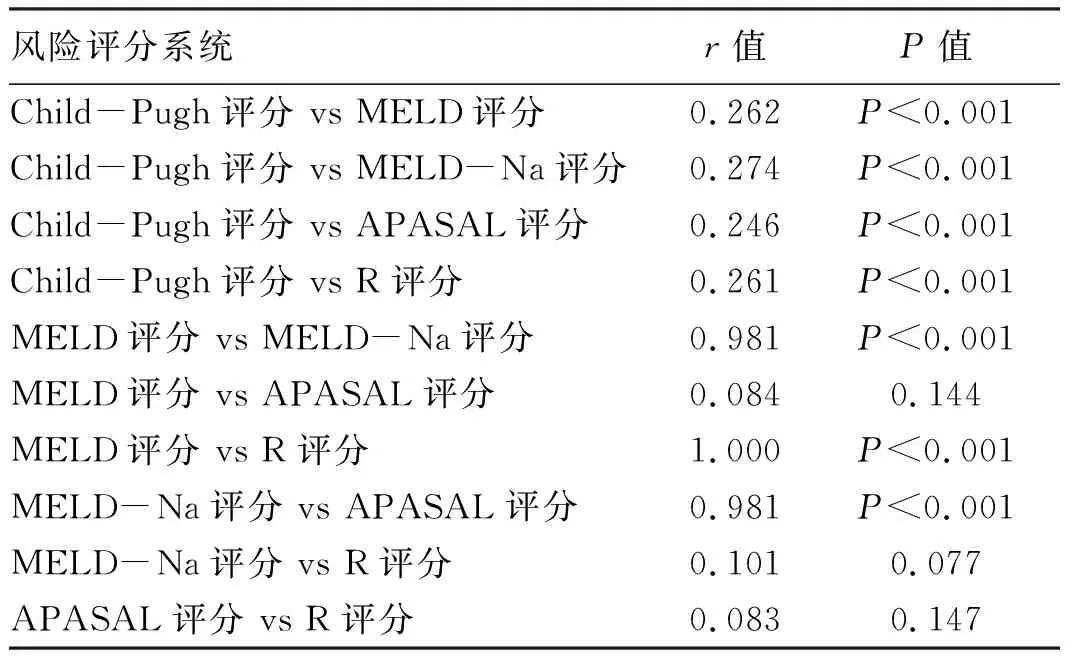
表2 5种风险评分系统的相关性
2.4 5种风险评分系统对静脉曲张再出血死亡的诊断价值比较 Child-Pugh评分、MELD评分、MELD-Na评分、APASAL评分及R评分预测患者死亡AUC分别为0.610、0.527、0.537、0.568和0.526,其中只有Child-Pugh评分对患者死亡结局具有一定诊断价值(P=0.002)(表3,图2)。
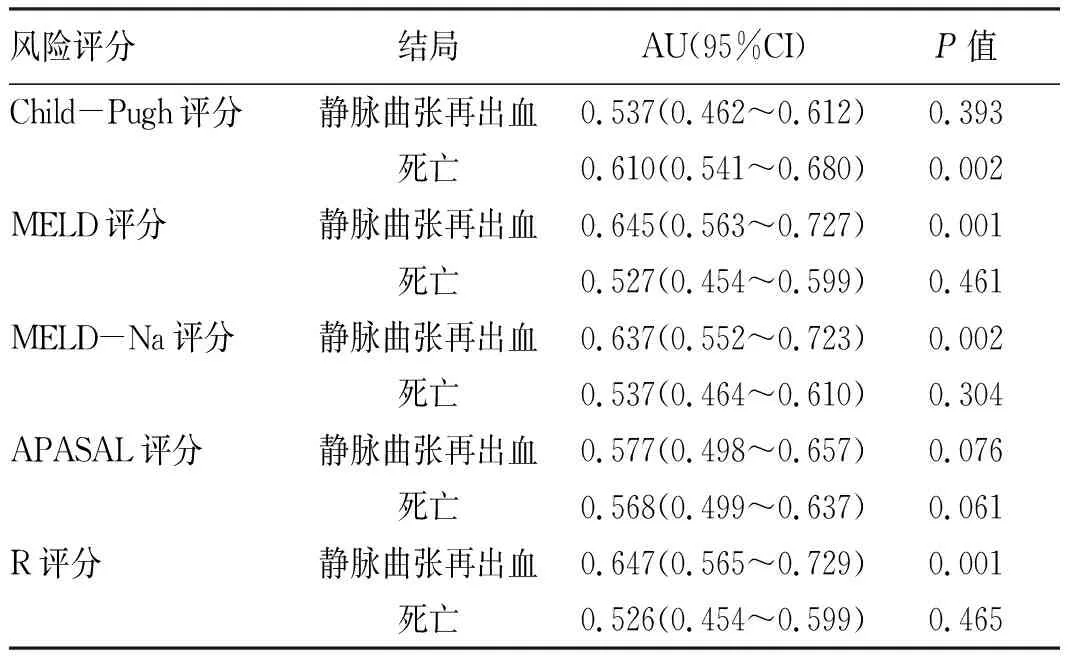
表3 5种风险评分系统诊断静脉曲张再出血及死亡的价值比较
注:95%CI,95%可信区间。
3 讨论
过去的20~30年,门静脉高压症和食管胃静脉曲张出血的治疗取得了显著的进展,患者的生存率有了显著的提高[20-21]。有研究[22]发现,肝硬化合并食管胃静脉曲张出血患者接受反复的内镜治疗,绝大部分患者均能获得较为长期的生存,3年和5年的累积生存率可达80.9%和67.1%,对于内镜治疗后患者的再出血及远期预后的评价,具有重要的临床意义。Child-Pugh评分、MELD评分及其改良的评分系统,是临床中常用的用于评估患者肝储备功能及判断终末期肝病患者病情的风险评分系统,R评分及APASAL评分被认为可用于静脉曲张出血严重程度和患者预后的评估[11,19],笔者将以上5种风险评分系统应用于反复内镜治疗的肝硬化伴食管胃静脉曲张出血患者,以评价其对于再出血及死亡的预测价值。
从无再出血组和有再出血组患者的基线数据比较发现,再出血组患者年龄大于无再出血组,两组患者的ALT和DBil水平存在差异,但其中位数均在正常范围之内,提示其差异可能并无实际意义。无再出血组患者INR及门静脉内径值略低于再出血组,但MELD评分、MELD-Na评分及R评分均高于再出血组,这3种评分系统的危险因素均包括Cr、TBil、INR和肝硬化病因,两组间Cr、TBil水平并无差异,无再出血组 INR低于再出血组,但与最终评分结果相矛盾,提示肝硬化病因对最终的评分结果产生很大影响。再出血组中,酒精性肝硬化患者占绝大多数(50.94%),明显高于在无再出血组中所占比例(9.13%),病因组成比的不同,影响了评分系统的最终得分。酒精性肝硬化是一种预后非常差的“恶性”疾病,随访1年病死率为49%,随访15年病死率高达90%,近60%的患者死于静脉曲张出血或肝性脑病[23-24],酒精性肝硬化是静脉曲张首次出血和再出血的独立危险因素[25-26]。
本研究结果显示,MELD评分与MELD-Na评分,MELD评分与R评分,MELD-Na评分与APASAL评分表现出良好的相关性,MELD、MELD-Na评分及R评分涉及的主要危险因素均包括Cr、胆红素及INR,考虑为显示相关性良好的原因。R评分是在因反复静脉曲张出血或难治性腹水而行择期TIPS手术患者的基础上创建的,Child-Pugh评分在此类患者中的应用中存在多个弊端,如:患者多处于Child-Pugh C级,无法对患者进行风险分层;仅能对患者病情进行轻/中/重分度,无法预测患者具体生存期;腹水、肝性脑病的分度存在主观性,且可因治疗而改变,因此需要一个精确的、客观的用于预测及量化这类患者生存期的替代方法。R评分可预测患者短期生存和长期生存,但随着随访期的延长,支架堵塞或出现肝癌等影响生存的不利因素,其预测精确度也随之下降[11]。在本研究中,行TIPS手术的患者被剔除在外,TIPS手术是通过降低患者门静脉压力的方法来降低门静脉高压相关并发症,从而降低病死率,而本研究中纳入的患者是通过内镜治疗,减轻或根除食管胃静脉曲张,降低静脉曲张再出血率,从而降低病死率,但对降低门静脉压力并无贡献,治疗方式和目标人群的差异,是导致R评分在本研究中对静脉曲张再出血预测效果不佳的原因。APASAL评分是基于亚太肝病学会专家意见建立的用于评估肝硬化患者静脉曲张出血严重程度的评分系统[19],APASAL评分对再出血及死亡均未体现出诊断价值,危险因素包括收缩压、Child-Pugh分级、PLT、是否合并感染及有无活动性出血,除了Child-Pugh分级以外,其余指标均受患者出血量影响较大,主要体现患者当时病情危重情况及近期预后,对远期的预后影响尚需进一步证实。Child-Pugh分级是APASAL评分系统中的危险因素之一,与MELD评分、MELD-Na评分、R评分及APASAL评分均呈一定相关,但仅有Child-Pugh评分对患者的长期预后,即死亡存在一定的预测价值,但无法预测静脉曲张再出血,分析原因为:Child-Pugh评分除了包含胆红素、Alb和INR等提示肝脏合成及解毒功能的指标外,还包含肝性脑病、腹水两项并发症,静脉曲张破裂出血是提示肝硬化失代偿的严重并发症,但其病死率与患者是否合并肝硬化其余并发症相关,如果出血为患者肝硬化的唯一并发症,其5年病死率为20%,但若合并有肝性脑病或腹水,5年的病死率高达80%以上[2,27]。
本研究对Child-Pugh评分、MELD评分、MELD-Na评分、R评分及APASAL评分5种针对静脉曲张出血的风险评分系统对于静脉曲张再出血及死亡的诊断价值进行验证和比较,发现对静脉曲张再出血的预测价值均有限,仅有Child-Pugh评分对患者死亡结局具有一定诊断价值。笔者曾在乙型肝炎肝硬化伴食管胃静脉曲张出血且反复行内镜治疗的患者中,筛选出生存时间达3年以上的患者,采用患者的常规临床指标,建立了一个可以预测患者长期生存的新算法[22],并将这个新算法应用于本研究,验证其对本研究中患者的再出血及死亡的预测价值,结果显示,该算法对于静脉曲张再出血基本无预测价值,AUC(95%CI)为0.559(0.477~0.641)(P=0.177),而对于死亡具有一定的预测价值,AUC(95%CI)为0.680(0.613~0.746)(P<0.001)。可见,针对乙型肝炎肝硬化患者所建立的算法,应用于全病因肝硬化患者的诊断价值明显下降,提示病因对患者预后影响较大。
笔者通过对多个肝硬化患者常用的风险评分系统进行分析并评估其对再出血的预测价值,均未发现有满意的效果,考虑原因为,这些风险评分系统所纳入的危险因素均为反映患者肝功能、间接反映门静脉压力的指标及肝硬化并发症,部分评分系统考虑到了病因对预后的影响,但均未考虑治疗的因素。对于静脉曲张出血的患者而言,再出血风险取决于患者本身的门静脉压力、肝功能情况及治疗的效果等,通过针对病因的治疗,如病毒性肝炎患者有效的抗病毒,酒精性肝硬化患者戒酒等,患者的肝功能好转、门静脉压力下降,再出血也将随之减少;通过针对静脉曲张的治疗,如反复的内镜下治疗,可使静脉曲张明显减轻或消失,静脉曲张再出血也随之减少。随着近些年来门静脉高压治疗的长足进展,静脉曲张出血的治疗及预防有了明显的进步,在多项研究[22,28-29]中发现,静脉曲张治疗的方法并非患者死亡的独立危险因素,提示静脉曲张出血或再出血无法决定患者的长期预后,出血与死亡的相关性在逐渐削减。这也解释了风险评分模型无法预测再出血,却对死亡存在一定预测价值的原因。

