气质联用结合偏最小二乘法在生鲜牛、鸭混合肉含量判别分析中的应用
魏泉增 杨自翔 肖付刚


摘 要:采用顶空固相微萃取(headspace solid-phase micro extraction,HS-SPME)和气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)技术提取和分析生鲜牛、鸭混合肉中的挥发性化合物,利用偏最小二乘(partial least squares,PLS)法对GC-MS数据进行建模,对不同比例生鲜牛、鸭混合肉进行判别分析。结果表明:生鲜牛、鸭混合肉中共鉴定出39 种挥发性化合物;PLS模型可以有效区分不同比例生鲜牛、鸭混合肉,利用训练集和验证集数据验证模型,评估均方差为3.455 9,预测均方差为4.068 9,PLS模型对不同比例生鲜牛、鸭混合肉的预测准确率较高。本方法在判别不同比例生鲜牛、鸭混合肉方面准确性较高。
关键词:生鲜牛、鸭混合肉;偏最小二乘法;气相色谱-质谱联用
Abstract: The volatile compounds of beef adulterated with duck meat in different proportions were analyzed by headspace solid-phase micro extraction (HS-SPME) coupled to gas chromatography-mass spectrometry (GC-MS). The results showed that a total of 39 volatile compounds were identified in the two meats. The GC-MS data were analyzed by partial least squares (PLS) method. The pattern recognition analysis by PLS showed clear separation of the meat mixtures by internal and external validations. The obtained values for root mean square error of estimation (RMSEE, 3.455 9) and root mean square error of prediction (RMSEP, 4.068 9) showed the PLS model had strong predictive ability. The method provided a highly accurate prediction model for distinguishing different levels of duck in adulterated beef.
Keywords: duck adulteration in beef; partial least squares; gas chromatography-mass spectrometry
DOI:10.7506/rlyj1001-8123-20200210-032
中图分类号:TS251.7 文献标志码:A 文章编号:1001-8123(2020)05-0053-06
牛肉美味可口,鲜嫩多汁,含有大量的蛋白质、氨基酸、B族维生素以及多种矿物质。由于牛肉价格昂贵,火锅生鲜肉中的掺假现象频发,并且以掺假羊肉、牛肉居多。大多数用于掺假的肉类以猪肉和鸭肉为主。目前,肉类掺假的检测方法日渐成熟。例如采用单克隆抗体、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)技术检测熟制红肉(猪肉、牛肉、羊肉、鹿肉、马肉)中是否添加熟制禽肉(鸡肉和火鸡肉)[1];运用猪肉、牛肉、羊肉和马肉中的肽段作为生物标记物检测肉中是否掺假[2];运用电子舌技术区分牛肉、绵羊肉和山羊肉[3]。此外,蛋白质组学、DNA生物标签扩增、红外光谱[4-5]、电子鼻分析[6]、核磁共振[7]和气相色谱-质谱联用(gaschromatography-mass spectrometry,GC-MS)[8]等技术也被用于检测肉类掺假。采用GC-MS技术进行定量分析具有简便、灵敏度高和定量准确的优点。常見的GC-MS样品前处理技术有顶空固相微萃取(headspace solid-phase micro extraction,HS-SPME)、同时蒸馏萃取、有机溶剂萃取、超临界CO2萃取和水蒸气蒸馏等方法。孙建军等[9]采用GC-MS技术鉴定牛肉香气成分。但是GC-MS技术所获得的数据较多,且数据间相关性较高,处理较为复杂繁琐。偏最小二乘(partial least squares,PLS)法是一种新型多元统计分析法,是多元线性回归法、主成分分析法和典型相关分析法的有机结合[10]。PLS法可以有效地解决样本量少、自变量多、相关性高的数据模型,近年来在食药分析领域应用广泛[11-14]。
一般地,肉类掺假检测方法多采用特异性标记物、特征波长或扩增DNA靶点,并且存在操作复杂、精确度不高等问题。目前关于定量分析生鲜牛、鸭混合肉含量的研究较少。本研究采用HS-SPME-GC-MS技术分析不同比例生鲜牛、鸭混合肉中的香气成分,利用PLS法建模,建立生鲜牛、鸭混合肉的定量分析方法。
1 材料与方法
1.1 材料与试剂
冷鲜牛肉(牛肩肉)、鸭肉(鸭脯肉) 本地超市。
C8~C40正构烷烃(色谱纯) 北京百灵威科技有限公司、氦气(纯度99.999%) 河南迎众化工产品有限公司;纯净水 杭州娃哈哈集团有限公司。
1.2 仪器与设备
7890B-7000C GC-MS仪 美国安捷伦公司;65 μm聚二甲基硅氧烷/聚二乙烯基苯固相微萃取头和萃取手柄 青岛贞正分析仪器有限公司;ML204分析天平 梅特勒-托利多仪器(上海)有限公司。
1.3 方法
1.3.1 样品处理
将牛肉和鸭肉分别制成肉糜,使用保鲜膜封装并作标记,置于-20 ℃冰箱冷冻待用,并于48 h内进行分析。将鸭肉分别以0%、10%、20%、30%、40%、50%、60%、70%、80%、90%、100%比例替代牛肉,制备不同比例的生鲜牛、鸭混合肉进行GC-MS分析,每个样品重复测定5 次。
1.3.2 GC-MS分析
取1.00 g肉糜(生鲜牛、鸭混合肉)。加入2 mL去离子水,置于15 mL顶空瓶中,90 ℃水浴15 min,HS-SPME吸附40 min,250 ℃下解吸3 min。
GC条件:DB-WAX柱(60 m×0.25 mm,0.25 μm);载气:氦气;恒流柱流速1.2 mL/min;不分流进样;进样口温度250 ℃。升温程序:初始温度50 ℃,5 ℃/min至155 ℃,2 ℃/min至170 ℃,5 ℃/min至250 ℃。
MS条件:电子轰击离子源;电子能量70 eV;离子源温度230 ℃;四极杆温度150 ℃;溶剂延迟5.5 min;扫描模式Scan;扫描质量范围29~700 u。
1.3.3 不同比例生鲜牛、鸭混合肉样品的定性分析
利用GC-MS仪器自带的NIST14谱库对所采集数据进行定性分析,以匹配度>600作为物质鉴定标准,按
1.4 数据处理
设定生鲜牛、鸭混合肉含量为因变量,以香气物质的相对峰面积为自变量,采用SIMCA-P 14.1软件进行PLS分析及相关图形绘制。
2 结果与分析
2.1 牛肉与鸭肉香气成分的对比分析
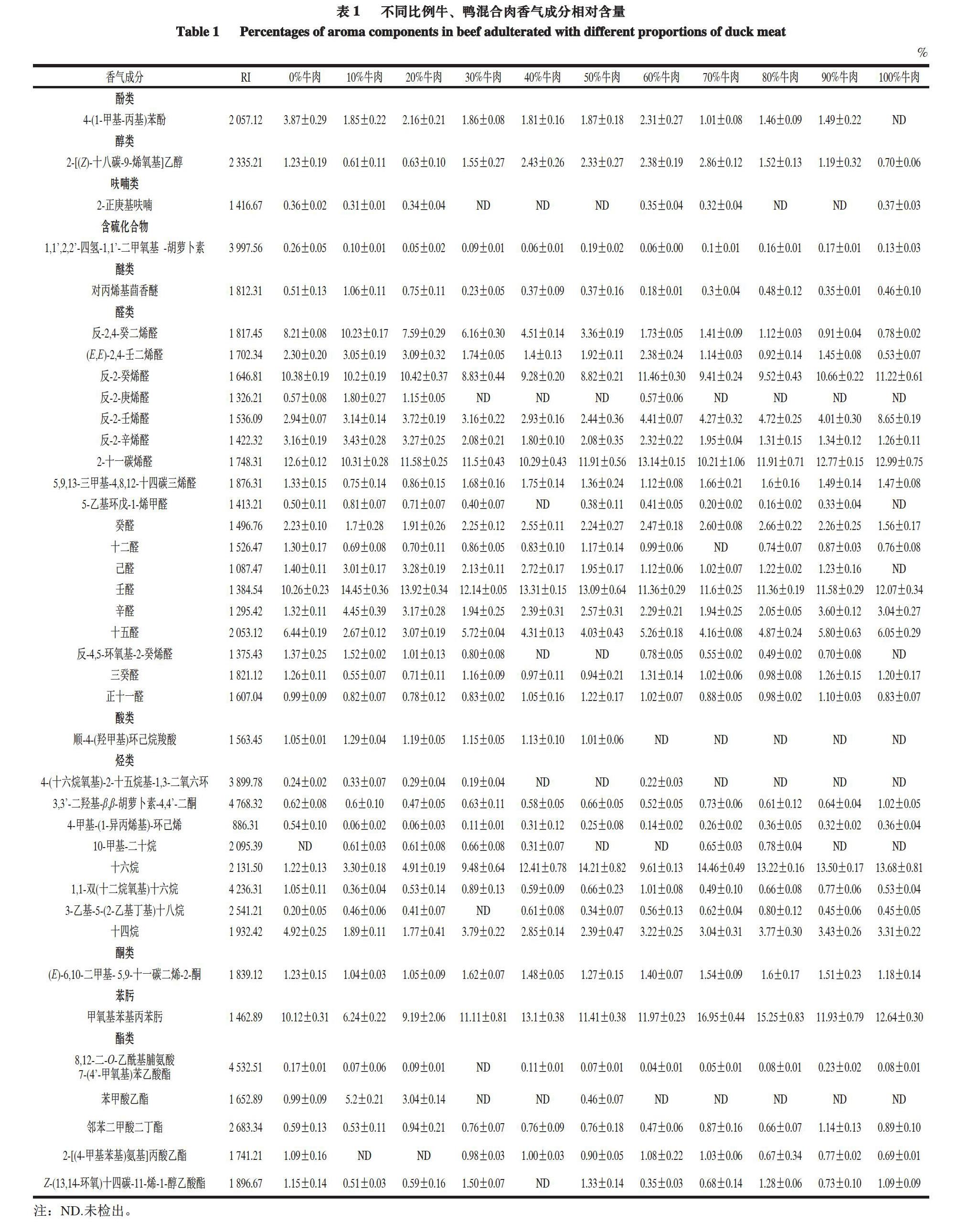
由图1~2可知,鸭肉和牛肉的香气成分总离子流图差异明显,牛肉和鸭肉中苯肟类化合物的相对含量最高,其次是醛类和烃类化合物,其余物质相对含量较小,且差别不大。
由表1可知,生鲜牛、鸭混合肉中共检测出39 种挥发性化合物。除了苯甲酸乙酯、环己烯、反-2-庚烯醛、顺-4-(羟甲基)环己烷羧酸以外,其他挥发性化合物的相对含量均随着牛肉含量的增加而增加。在鸭肉中检出的
2,4-壬二烯、2-癸烯醛、邻苯二甲酸二丁酯、4-(1-甲基-丙基)苯酚,也在牛肉中检测到。研究表明苯三甲基丁醛是鸭肉中的主要化合物[15],但在本研究中均未检出。
醛类化合物在酯类物质氧化过程中形成,是构成牛肉香气成分重要的化合物种类之一。2,4-癸二烯醛是亚油酸的氧化产物,所测样品中2,4-癸二烯醛相对含量较多。己醛来源于ω-6多不饱和脂肪酸的氧化,具有极低的香氣阈值和腐臭味。不同季节牛肉的香气成分含量明显不同,冬春季牛肉的香气成分含量较高,但是丙醇、3-甲基正丁醛、2-丁醇、庚烷、己醇、甲基异丙基苯和壬醛含量没有显著差异[16-17]。
烃类化合物主要来源于脂肪酸降解或动物体内的脂肪氧化[18]。正烷烃可能来自支链脂肪酸的氧化,短链烷烃是脂肪自动氧化的次级产物,而脂肪的自动氧化还伴随着醇、醛、酮类物质的产生[19]。
酯类化合物具有水果香气[20],主要来源于肉中醇类和羧酸类化合物发生的酯化反应,对于肉类香气的贡献不大。本实验牛肉和鸭肉中均检出酯类化合物,相对含量均较低且差异不明显。
醇类和酸类化合物在肉类中含量较低。陈海涛等[21]通过SPME法仅在酱牛肉中检测到2 种酸类化合物。醇类物质产生可能和微生物代谢葡萄糖和氨基酸或油脂氧化有关[22-23]。虽然3-甲基-1-丁醇经常在生肉中检测到[24],但本实验未检测到,可能是由于吸附温度较高引起的。
呋喃类化合物和含硫化合物等杂环化合物对肉类的香气贡献较大,呋喃类化合物主要呈现甜香、烤香、焦香等香气,呋喃主要形成途径是酮基二元酸通过加热后的二次羧酸转换脱羧形成[25]。含硫化合物可能来源于还原糖与含硫氨基酸之间的美拉德反应,也可能来源于含硫氨基酸的降解[26-27]。醚类化合物主要为茴香醚。
2.2 不同比例生鲜牛、鸭混合肉样品的PLS分析
采用SIMCA-P软件中留一法对全样本进行PLS回归分析[28-30]。通过PLS回归模型提取3 个主成分:第1主成分分别解释了原自变量系统和因变量系统48.7%、85.8%的变异信息;第2主成分分别解释了原自变量系统和因变量系统中13.6%、11.9%的变异信息;第3主成分分别解释了原自变量系统和因变量系统中9.73%、1.13%的变异信息。前3 个主成分能够解释因变量系统中72.0%的变异信息,对自变量的信息利用率为98.9%,而前3 个主成分所预测模型的累计差异为98.4%。这说明该模型的预测精度良好。
由图3可知,所建立的PLS模型能够将不同比例的掺假牛肉区分开。所有样本均在95%的置信区间内,无异常值。
由表2可知,不同比例生鲜牛、鸭混合肉预测结果稳定且与真实值接近,二者之间的相关系数为0.997 8,建模后预测值和实际值之间的误差均在10%以内。这表明PLS模型在预测不同比例生鲜牛、鸭混合肉中牛肉含量具有较高的精度。
以训练集真实值为纵坐标、预测值为横坐标,绘制散点图。由图4~5可知,不同比例生鲜牛、鸭混合肉被明显分开。以评估均方差(root mean square error of estimation,RMSEE)评价真实值与预测值的差异[30],得到训练集RMSEE为3.455 9,表明预测值能较好反映真实值。经验证集验证,预测均方差(root-mean-square error of prediction,RMSEP)为4.068 9,与RMSEE差值较小,说明该模型的预测效果较好。
采用排列检验图判断PLS模型是否存在过拟合现象。Y-观测值(牛肉含量)的顺序随机排列,而X-矩阵(生鲜牛、鸭混合肉挥发性成分)是完整的。随机选定某个变量,以排列后变量向量和原始变量向量之间的相关系数为横轴,拟合优度(R2)与预测优度(Q2)为纵轴,比较训练集模型的R2与Q2。由图6可知,R2均大于Q2,且R2与Q2回归线在纵轴的截距分别为0.201和-0.399。一般认为R2与Q2的回归线在纵轴的截距分别小于0.40、0.05,表示模型不存在过拟合现象。
3 结 论
采用HS-SPME技术对不同比例生鲜牛、鸭混合肉的香气成分进行提取,采用GC-MS结合RI进行分析,牛肉和鸭肉中共鉴定出39 种化合物。采用PLS法对不同比例生鲜牛、鸭混合肉进行判别分析,并建立预测模型,得到模型RMSEE为3.455 9、RMSEP为4.068 94,表明模型的预测精度较高。R2与Q2分析结果表明,该模型不存在过拟合现象。预测值与真实值的比较结果表明,PLS模型具有较好地预测能力,并能够较好判断生鲜牛、鸭混合肉中的牛肉含量。本方法为肉类产品的质量控制、判别掺假肉方面提供了新的途径和思路。
参考文献:
[1] DJURDJEVIC N, SHEU S C, HSIEH Y H. Quantitative detection of poultry in cooked meat products[J]. Journal of Food Science, 2005, 70(9): 586-593. DOI:10.1111/j.1365-2621.2005.tb08309.x.
[2] WATSON A D, GUNNING Y, RIGBY N M, et al. Meat authentication via multiple reaction monitoring mass spectrometry of myoglobin peptides[J]. Analytical Chemistry, 2015, 87(20): 10315-10322. DOI:10.1021/acs.analchem.5b02318.
[3] HADDI Z, BARBRI N, TAHRI K, et al. Instrumental assessment of red meat origins and their storage time using electronic sensing systems[J]. Analytical Methods, 2015, 7(12): 5193-5203. DOI:10.1039/C5AY00572H.
[4] ALAMPRESE C, AMIGO J M, CASIRAGHI E, et al. Identification and quantification of turkey meat adulteration in fresh, frozen-thawed and cooked minced beef by FT-NIR spectroscopy and chemometrics[J]. Meat Science, 2016, 121: 175-181. DOI:10.1016/j.meatsci.2016.06.018.
[5] MEZA-M?RQUEZ O G, GALLARDO-VEL?ZQUEZ T, OSORIO-REVILLA G. Application of mid-infrared spectroscopy with multivariate analysis and soft independent modeling of class analogies (SIMCA) for the detection of adulterants in minced beef[J]. Meat Science, 2010, 86(2): 511-519. DOI:10.1016/j.meatsci.2010.05.044.
[6] 董福凱, 周秀丽, 查恩辉. 电子鼻在掺假牛肉卷识别中的应用[J]. 食品工业科技, 2018, 39(4): 219-221; 227. DOI:10.13386/j.issn1002-0306.2018.04.040.
[7] MARCONE M F, WANG S, ALBABISH W, et al. Diverse food-based applications of nuclear magnetic resonance (NMR) technology[J]. Food Research International, 2013, 51(2): 729-747. DOI:10.1016/j.foodres.2012.12.046.
[8] 王綪, 李璐, 王佳奕, 等. 电子鼻结合气相色谱-质谱法对宁夏小尾寒羊肉中鸭肉掺假的快速检测[J]. 食品科学, 2017, 38(20): 222-228. DOI:10.7506/spkx1002-6630-201720032.
[9] 孙建军, 陈肇铁, 周瑞宝. 牛肉香气成分的研究[J]. 郑州粮食学院学报, 1995, 16(1): 7-19. DOI:10.16433/j.cnki.issn1673-2383.1995.01.002.
[10] 范玛莉, 李震宇, 李爱平, 等. 偏最小二乘方法在不同食醋判别分析中的应用[J]. 食品工业科技, 2014, 35(21): 324-328. DOI:10.13386/j.issn1002-0306.2014.21.061.
[11] 佘僧, 李熠, 宋洪波, 等. 低聚糖和多酚结合偏最小二乘判别分析鉴别油菜蜜产地[J]. 食品科学, 2019, 40(12): 290-295. DOI:10.7506/spkx1002-6630-20180424-308.
[12] 冉坚, 张琦, 刘淼, 等. 基于氢核磁共振和偏最小二乘法-判别分析建立鹿龟酒质量控制方法的研究[J]. 食品科学, 2012, 33(7): 69-72.
[13] 陈娜, 陈小娥, 方旭波, 等. 基于电子鼻和气质联用技术分析鱼油挥发性成分[J]. 中国粮油学报, 2017, 32(10): 179-184. DOI:10.3969/j.issn.1003-0174.2017.10.030.
[14] 黄业传, 李凤, 黄甜, 等. 利用电子鼻和气质联用研究腊肉挥发性风味物质的形成规律[J]. 食品工业科技, 2014, 35(6): 73-77; 80. DOI:10.13386/j.issn1002-0306.2014.06.016.
[15] GRAVADOR R S, SERRA A, LUCIANO G, et al. Volatiles in raw and cooked meat from lambs fed olive cake and linseed[J]. Animal, 2015, 9(4): 715-722. DOI:10.1017/S1751731114002730.
[16] NIE C N, ZHONG X X, HE L, et al. Comparison of different aroma-active compounds of Sichuan Dark brick tea (Camellia sinensis) and Sichuan Fuzhuan brick tea using gas chromatography-mass spectrometry (GC-MS) and aroma descriptive profile tests[J]. European Food Research and Technology, 2019, 245(9): 1963-1979. DOI:10.1007/s00217-019-03304-1.
[17] CALLAGHAN T F, FAULKNER H, MCAULIFFE S, et al. Quality characteristics, chemical composition, and sensory properties of butter from cows on pasture versus indoor feeding systems[J]. Journal of Dairy Science, 2016, 99(12): 9441-9460. DOI:10.3168/jds.2016-11271.
[18] 韩云秀. 牛肉风味物质分析及其检测方法研究[D]. 长春: 吉林大学, 2017: 19.
[19] 张俊勇, 徐素荣. 动物性脂肪败坏的原理及预防措施[J]. 肉类工业, 2002(8): 40-41. DOI:10.3969/j.issn.1008-5467.2002.08.013.
[20] RODRI?GUEZ-BURRUEZO A, KOLLMANNSBERGER H, GONZA?LEZ-MAS M C, et al. HS-SPME comparative analysis of genotypic diversity in the volatile fraction and aroma-contributing compounds of capsicum fruits from the annuum-Chinese-frutescens complex[J]. Journal of Agricultural and Food Chemistry, 2010, 58(7): 4388-4400. DOI:10.1021/jf903931t.
[21] 陈海涛, 张宁, 孙宝国. SPME或SDE結合GC-MS分析贾永信十香酱牛肉的挥发性风味成分[J]. 食品科学, 2012, 33(18): 171-176.
[22] DAINTY R H. Chemical/biochemical detection of spoilage[J]. International Journal of Food Microbiology, 1996, 33(1): 19-33. DOI:10.1016/0168-1605(96)01137-3.
[23] PARK S Y, YOON Y M, SCHILLING M, et al. Evaluation of volatile compounds isolated from pork loin (Longissimus dorsi) as affected by fiber type of solid-phase microextraction (SPME), preheating and storage time[J]. Korean Journal for Food Science of Animal Resources, 2009, 29(5): 579-589. DOI:10.5851/kosfa.2009.29.5.579.
[24] CHEN M, RAOR S P, ZHANG Y, et al. A modified data normalization method for GC-MS-based metabolomics to minimize batch variation[J]. Springerplus, 2014, 3(1): 1-7. DOI:10.1186/2193-1801-3-439.
[25] RENZ M. Ketonization of carboxylic acids by decarboxylation: mechanism and scope[J]. European Journal of Organic Chemistry, 2005(6): 979-988. DOI:10.1002/ejoc.200400546.
[26] ZHANG Yuangang, HO C T. Volatile compounds formed from thermal interaction of 2,4-decadienal with cysteine and glutathione[J]. Journal of Agricultural and Food Chemistry, 1989, 37(4): 1016-1020. DOI:10.1021/jf00088a044.
[27] KONTOU S, TSIPI D, TZIA C. Kinetics of maneb degradation during thermal treatment of tomatoes[J]. Journal of Agricultural and Food Chemistry, 2004, 52(5): 1212-1219. DOI:10.1021/jf030539r.
[28] CHO S K, YANG S O, KIM S H, et al. Classification and prediction of free-radical scavenging activities of Dangyuja (Citrus grandis Osbeck) fruit extracts using 1H NMR spectroscopy and multivariate statistical analysis[J]. Journal of Pharmaceutical and Biomedical Analysis, 2009, 49(2): 567-571. DOI:10.1016/j.jpba.2008.11.037.
[29] BAILEY N J C, WANG Y, SAMPSON J, et al. Prediction of anti-plasmodial activity of Artemisia annua extracts: application of
1H NMR spectroscopy and chemometrics[J]. Journal of Pharmaceutical and Biomedical Analysis, 2004, 35(1): 117-126. DOI:10.1016/j.jpba.2003.12.024.
[30] YANG S O, SHIN Y S, HYUN S H, et al. NMR-based metabolic profiling and differentiation of ginseng roots according to cultivation ages[J]. Journal of Pharmaceutical and Biomedical Analysis, 2012, 58(1): 19-26. DOI:10.1016/j.jpba.2011.09.016.

