芒草根际、内生可培养细菌多样性及促生潜力研究
庞发虎,徐 鸽,李 敏,谢涵珠,陈兆进
(1.南阳师范学院 农业工程学院,河南 南阳 473061;2.南水北调中线水源区水安全河南省协同创新中心,河南 南阳 473061)
发展可再生能源取代化石能源成为全球共识,其中,生物质能源是可再生能源的重要组成。芒草(Miscanthus)作为第二代能源植物的代表,因其生物量大、纤维素含量高、适应性强、生产成本低等诸多优点,被认为是目前最具开发潜力的高产纤维类能源植物之一,成为国内外研究的热点[1-4]。土壤和植物体内存在大量的细菌,能通过溶磷、固氮等途径改善植物营养以及分泌植物激素、铁载体、特异性酶(ACC脱氨酶等)促进植物在逆境条件下的生长,在植物的生长中起到重要作用[5-7]。因此,开展能源植物不同生境中细菌群落组成,特别是具有促生功能的细菌功能研究具有重要意义[8-9]。FARRAR等[8]系统总结了芒草、甘蔗、杨树等能源植物内生细菌组成,并指出有效利用植物与有益微生物之间的良好关系,为能源植物在各种生境中的生长提供帮助。关于芒草根际和内生细菌群落组成和功能研究已有开展,COPE-SELBY等[10]对芒草根际、根部、茎部、叶部和种子可培养细菌群落组成进行测定,发现其由β、γ变形菌门和厚壁菌门3个门、5个科组成,表现出群落组成的丰富性。目前,研究者已从芒草根际、内部分离筛选了细菌资源,包括Bacillusbarbaricus、Lysinibacillusfusiformis、Serratiasp.、Pseudomonassp.等[10],及PseudomonaskoreensisAGB-1[11]、Azospirillumlipoferum、Herbaspirillum[12]、Azospirillumdoereineraesp.nov.GSF71[13]、HerbaspirillumfrisingenseGSF30[14]、Clostridiumspp.[15],这些研究结果探明了不同生境中芒草细菌群落组成,并为后续研究促生细菌促进芒草生长提供了菌种资源[16]。
我国是世界芒草资源分布中心,全世界芒属植物有14种,中国有7种,并且还有许多不同的变种、生态型和基因型,种质资源极为丰富[1]。但目前我国不同生境中芒草细菌群落组成研究鲜见报道,限制了有益微生物辅助芒草生长技术的应用,相关工作亟待开展。因此,本研究采用传统平板分离方法分离筛选、鉴定芒草根际和根部、茎部、叶部内生细菌群落组成,并对其植物促生特性进行测定,以期探明芒草根际、内生可培养细菌多样性,初步分析其功能,并筛选到具有良好促生效果的菌种资源。
1 材料和方法
1.1 供试材料
芒草于2013年5月种植于河南省南阳国家农业科技园区能源植物栽培示范基地(坐标为32°56′45.34″N和112°24′56.28″E),本试验于2017年5月15日采集植物,采用抖落法收集根际土壤,芒草植株和收集的土壤样品分别置于灭菌信封内,运回实验室用于后续试验。
1.2 根际和内生可培养细菌分离纯化
采用有氮培养基(YN培养基)[17]和R2A培养基[18]分离芒草根际和内生可培养细菌,具体过程:根际细菌分离采用稀释梯度平板法,将1.0 g根际土壤加入100 mL无菌水中,稀释到合适梯度,取100 μL涂布于YN和R2A培养基,培养5 d,平板上生长的为可培养根际细菌。芒草内生菌分离参考文献[19]的方法,先将芒草分为根部、茎部和叶部,分别称取9、12、5 g组织,用75%乙醇和2.5%次氯酸钠各消毒5 min,用无菌水洗涤数遍后置于灭菌研钵中研磨至匀浆,加30 mL磷酸钠缓冲液稀释,取100 μL涂布于YN和R2A培养基,培养5 d。根据菌落形态、颜色、大小分别挑取不同细菌,并在相应平板上划线纯化,纯化后的细菌用含25%甘油的培养基于-20 ℃保存,备用。
1.3 DNA提取、PCR扩增及系统进化分析
将菌株接种于分离时对应的YN和R2A培养基中,摇床振荡培养18 h后取菌液于离心管中,12 000 r/min离心收集菌体后参考文献[19]的方法提取细菌基因组DNA。采用通用引物27F和1492R对细菌16S rRNA基因进行PCR扩增。PCR反应条件和反应体系参考文献[19]的方法,将扩增好的PCR产物送至生工生物工程(上海)股份有限公司进行测序。将测序结果与EzBioCloud网站(https://www.ezbiocloud.net)模式菌株的16S rRNA基因序列相比对,判定菌株所属类群。根据序列比对结果,下载相近的模式菌株序列,经Clustal X对齐后,通过软件MEGA 7(方法为Neighbour-Joining,Bootstrap值取1 000)构建系统进化树。
1.4 促生特性分析
根据序列比对结果,挑选不同种的细菌进行促生特性分析,分别测定菌株产吲哚乙酸(IAA)能力、产精氨酸脱羧酶(ADC)能力以及溶解难溶性磷酸盐能力。菌株产IAA能力采用Salkowski显色法进行测定,产ADC能力采用平板显色法进行测定,具体步骤参考文献[20]。溶磷试验采用钼锑抗比色法测定培养液中有效磷含量,具体步骤参考文献[21]。
2 结果与分析
2.1 芒草根际细菌群落组成
对于平板上生长的根际细菌,根据菌落形态、颜色、大小分别挑取不同菌株,经纯化、保藏最终从YN和R2A培养基各成功分离到13株菌,共计26株根际细菌。对其16S rRNA基因进行PCR扩增,序列测定后与EzBioCloud网站中模式菌株进行比对,确定其分类学地位,结果如表1所示。结果表明,根际细菌分布于放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)4个门,放线菌纲(Actinobacteria)、黄杆菌纲(Flavobacteria)、芽孢杆菌纲(Bacilli)和α-、β-、γ-变形杆菌纲(Alphaproteobacteria、Betaproteobacteria、Gammaproteobacteria)6个纲,短小杆菌属(Curtobacterium)、节杆菌属(Arthrobacter)、黄杆菌属(Flavobacterium)、芽孢杆菌属(Bacillus)、根瘤菌属(Rhizobium)、假单胞菌属(Pseudomonas)等12个属(表1)。其中,属于芽孢杆菌属的菌株数为8株、根瘤菌属4株、短小杆菌属3株,占根际细菌总数比例分别为30.77%、15.38%和11.54%,为其优势种群。
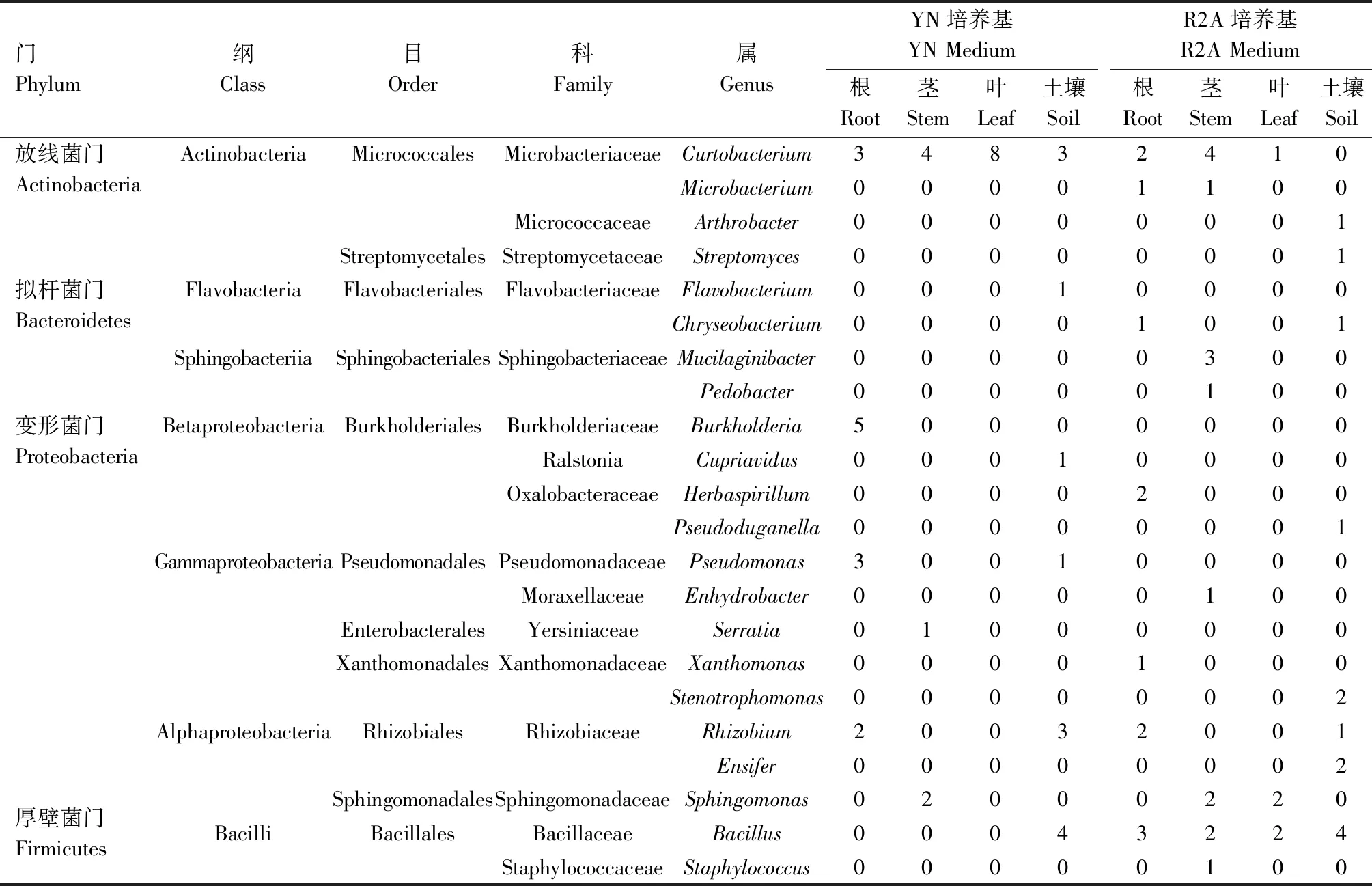
表1 芒草根际、内生可培养细菌组成Tab 1 Cultivable rhizosphere and endophytic bacteria isolated from Miscanthus
注:表格中不同植物部位对应数字为菌株数量。
Note:The number corresponding to different plant parts in the table represents the number of strains.
本试验通过YN和R2A培养基分离根际细菌,对其组成差异进行分析,结果如下:YN和R2A培养基各分离到根际细菌13株,均分布于放线菌门、拟杆菌门、厚壁菌门和变形菌门4个门,放线菌纲、黄杆菌纲、芽孢杆菌纲等6个纲。在属的水平上,YN培养基分离的菌株分布于短小杆菌属、芽孢杆菌属、根瘤菌属等6个属,其中,芽孢杆菌属、短小杆菌属、根瘤菌属菌株数分别为4、3、3株,为优势种群;R2A培养基分离的菌株分布于芽孢杆菌属、剑菌属(Ensifer)、根瘤菌属等8个属,其中,芽孢杆菌属、剑菌属菌株数分别为4、2株,为优势种群(表1)。分离到的12个属的细菌经比较发现,YN培养基和R2A培养基共有的属只有芽孢杆菌属和根瘤菌属。芽孢杆菌属在2种培养基中菌株数量均为4株,但后续通过序列比对发现,YN培养基中与B.acidicelerCBD 119(1株)、B.altitudinis41KF2b(1株)、B.safensisFO-36b(1株)、B.tequilensisKCTC 13622(1株)相似性最高,R2A培养基中与B.aryabhattaiB8W22(1株)、B.megateriumNBRC 15308(3株)相似性最高。
2.2 芒草内生细菌群落组成
YN和R2A培养基各成功分离到13株和12株,共计25株根部内生细菌(表1)。对其分类学地位进行分析发现,根部内生细菌与根际细菌类似,分布于放线菌门、拟杆菌门、厚壁菌门和变形菌门4个门、6个纲,短小杆菌属、芽孢杆菌属、根瘤菌属、假单胞菌属、伯克霍尔德菌属(Burkholderia)等9个属(表1)。其中,属于短小杆菌属的菌株数为5株、伯克霍尔德菌属5株、根瘤菌属4株,占根部内生细菌总数比例分别为20.00%、20.00%、16.00%,为其优势种群。同时对不同培养基根部内生细菌群落组成进行分析,YN培养基分离的细菌分布于2个门、4个纲、4个属,其中伯克霍尔德菌属(5株)、假单胞菌属(3株)为独有种群;R2A培养基分离的细菌分布于4个门、6个纲、7个属,其中芽孢杆菌属(3株)、草螺菌属(Herbaspirillum,2株)、黄单胞菌属(Xanthomonas,1株)、金黄杆菌属(Chryseobacterium,1株)和细小杆菌属(Microbacterium,1株)为独有种群;短小杆菌属和根瘤菌属为2种培养基共有种群(表1)。
YN和R2A培养基各成功分离到7株和15株,共计22株茎部内生细菌(表1)。这些细菌分布于放线菌门、拟杆菌门、厚壁菌门和变形菌门4个门,放线菌纲、芽孢杆菌纲、鞘脂杆菌纲(Sphingobacteriia)等5个纲,短小杆菌属、细小杆菌属、Mucilaginibacter、鞘脂单胞菌属(Sphingomonas)、水栖菌属(Enhydrobacter)等9个属(表1)。其中,属于短小杆菌属菌株数为8株、鞘脂单胞菌属4株、Mucilaginibacter3株,占茎部内生细菌总数比例分别为36.36%、18.18%和13.64%,为其优势种群。同时对不同培养基茎部内生细菌群落组成进行分析,YN培养基分离的细菌分布于2个门、3个纲、3个属,沙雷氏菌属(Serratia,1株)为独有种群;R2A培养基分离的细菌分布于4个门、5个纲、8个属,其中Mucilaginibacter(3株)、芽孢杆菌属(2株)、葡萄球菌属(Staphylococcus,1株)等6个属为独有种群;短小杆菌属和鞘脂单胞菌属为2种培养基共有种群,菌株数均为4株和2株。根据KIM等[22]的方法将16S rRNA基因序列相似度98.65%作为种间的临界值,对芒草细菌群落组成进行分析时发现,茎部分离的菌株13和14与已发表的模式种16S rRNA基因序列最大相似度分别为97.36%~98.70%和97.23%~97.78%,可能为潜在的新种(表2)。后续试验中,菌株14与参比菌株之间的平均核苷酸同源性(Average nucleotide identity,ANI)介于78.5%~78.7%,基于基因组数据计算所得的DNA杂交同源率(In silico DNA-DNA hybridization,In silico DDH)介于22.2%~22.6%,低于相应的阈值,结合生理生化特性等表型特征和化学组分分析,判定其为Pedobacter属的1个新种,命名为Pedobactermiscanthisp.nov.[23]。与之类似,菌株13经过分子鉴定、生理生化特性和化学组分分析,判定其为Mucilaginibacter属的1个新种,命名为Mucilaginibacterendophyticussp.nov.[24]。

表2 筛选的44种细菌群落组成及其植物促生特性Tab 2 Community composition and plant growth promoting activities of the filtered bacteria belonging to 44 different species

续表2 筛选的44种细菌群落组成及其植物促生特性Tab 2(Continued) Community composition and plant growth promoting activities of the filtered bacteria belonging to 44 different species

续表2 筛选的44种细菌群落组成及其植物促生特性Tab 2(Continued) Community composition and plant growth promoting activities of the filtered bacteria belonging to 44 different species
注:表格中不同植物部位对应数字为菌株数量;+为产ADC,-为不产ADC。
Note:The number corresponding to different plant parts in the table represents the number of strains,+ means production of ADC,- means no production of ADC.
YN和R2A培养基各成功分离到8株和5株,共计13株叶部内生细菌(表1)。这些细菌分布于放线菌门、厚壁菌门和变形菌门3个门,放线菌纲、芽孢杆菌纲和α-变形杆菌纲3个纲,短小杆菌属、芽孢杆菌属和鞘脂单胞菌属3个属,群落组成较为单一。其中短小杆菌属菌株数为9株,占叶部内生细菌总数比例为69.2%,为其优势种群。芽孢杆菌属和鞘脂单胞菌属菌株数均为2株。同时对不同培养基叶部内生细菌群落组成进行分析,YN培养基分离的细菌组成单一,均属于放线菌门的短小杆菌属,经后续序列比对,发现其分别与C.albidumDSM 20512(2株)、C.citreumDSM 20528(2株)、C.oceanosedimentumATCC 31317(4株)相似性最高;R2A培养基分离的细菌分布于放线菌门、厚壁菌门和变形菌门3个门的3个属,其中芽孢杆菌属(2株)和鞘脂单胞菌(2株)为独有种群。
2.3 芒草根际、内生细菌促生特性分析
在进行菌株分离时,同一菌株可能被重复挑选,之前的研究多采用16S rRNA基因限制性酶切多态性分析其组成,挑取代表菌株进行序列测定,准确度有限[21]。因此,本试验将全部分离的86株菌进行16S rRNA基因序列测定,将测序结果与EzBioCloud网站模式菌株相比对,EzBioCloud数据库中最高相似度种一致的菌株,结合菌落颜色、形态、大小等特征分析,认定为同一菌株。根据分析筛选出44种细菌(图1),继而对这44种细菌进行促生潜在性评价(表2)。根际细菌根据序列比对,分布于20个种,其产IAA能力介于0.80~22.28 mg/L,其中产量超过10.00 mg/L的菌株占总数的61.54%;能产ADC的菌株9种,占菌株总数的34.62%;溶磷能力介于15.94~203.57 mg/L,其中超过100.00 mg/L的菌株占总数的46.15%。对不同培养基分离菌株促生特性分析表明,YN培养基分离的优势菌株29(最高相似性种RhizobiumradiobacterATCC 19358T)和菌株3(CurtobacteriumoceanosedimentumATCC 31317T)具有良好的溶磷能力,分别为203.57、131.60 mg/L,菌株41(BacillustequilensisKCTC 13622T)和菌株22(PseudomonashunanensisLVT)同时具有较好的产IAA、ADC和溶磷能力;R2A培养基分离的优势菌株40(BacillusmegateriumNBRC 15308T)具有较高产IAA能力,菌株31(EnsiferadhaerensCasida AT)具有良好产IAA能力和溶磷能力,分别为10.03、113.61 mg/L。25株根部内生细菌分布于14个种,其产IAA能力介于2.11~44.08 mg/L,其中产量超过10.00 mg/L菌株占总数的48.00%;能产ADC的菌株9种,占菌株总数的36.00%;溶磷能力介于23.65~203.57 mg/L,其中超过100.00 mg/L菌株占总数的52.00%。对不同培养基分离菌株促生特性分析表明,具有良好促生能力的菌株多属于YN培养基分离的菌株,如菌株15(BurkholderiagladioliNBRC 13700T)和菌株20(PseudomonaspsychrotoleransDSM 15758T)能产ADC,同时具有较强的溶磷能力;菌株21(PseudomonassimiaeOLiT)同时具有较强的产IAA能力和溶磷能力,菌株1(CurtobacteriumcitreumDSM20528T)同时具有3种促生特性(表2)。22株茎部内生细菌分布于17个种,其产IAA能力介于0.11~28.56 mg/L,其中产量超过10.00 mg/L菌株占总数的38.89%;能产ADC的菌株9种,占菌株总数的66.67%;溶磷能力介于23.65~175.30 mg/L,其中超过100.00 mg/L菌株占总数的54.55%。对不同培养基分离菌株促生特性分析表明,具有良好产IAA能力的菌株主要分离自R2A培养基,YN培养基分离优势菌株3具有良好的溶磷能力。菌株24(SerratiamarcescensATCC 13880T)、菌株44(StaphylococcushaemolyticusMTCC 3383T)和菌株1同时具有3种促生特性(表2)。13株叶部内生细菌分布于6个种,其产IAA能力介于8.31~22.28 mg/L,其中产量超过10.00 mg/L菌株占总数的53.85%;能产ADC的菌株8株,占菌株总数的61.54%;溶磷能力介于59.63~131.60 mg/L,其中超过100.00 mg/L菌株占总数的53.85%。对不同培养基分离菌株促生特性分析表明,YN培养基分离的优势菌株3(CurtobacteriumoceanosedimentumATCC 31317T)具有良好的溶磷能力,R2A培养基分离的优势菌株36(SphingomonaspaucimobilisNBRC 13935T)具有产ADC能力(表2)。

图1 基于可培养细菌16S rRNA基因序列构建的NJ系统进化树Fig.1 Phylogenetic tree of the culturable bacteria constructed by the Neighbor-Joining method based on the 16S rRNA gene sequences
3 结论与讨论
微生物在植物生长过程中起到重要作用,因此开展植物根际土壤、内生细菌群落组成研究具有重要意义[25]。目前关于芒草根际土壤和内生细菌群落组成研究开展较少,特别是针对国内生境中芒草细菌群落研究鲜见报道。笔者之前采用16S rDNA Miseq高通量测序技术的方法研究了芒草根际细菌群落组成,发现其主要由变形菌门、拟杆菌门、放线菌门等31个门、343个属的细菌组成,表现出群落组成的丰富性[26]。纯培养菌株的获得是微生物资源开发利用的重要前提和关键因素,因此本试验采用传统平板分离方法对种植5 a的芒草根际细菌和不同部位内生细菌群落进行研究。结果表明,根际细菌由放线菌门、拟杆菌门、厚壁菌门和变形菌门4个门、6个纲、12个属的细菌组成,与高通量测序结果相比群落组成较为单一,绝大多数细菌同时出现在可培养和高通量测序结果中,但节杆菌属、剑菌属和Pseudoduganella只出现在可培养结果中,推测这些菌株在土壤中占比较低,通过培养基富集培养从而被分离出来。该结果与COPE-SELBY等[10]关于芒草根际可培养细菌群落组成研究类似,芽孢杆菌属均为优势种群。从芒草根部、茎部和叶部共分离60株内生细菌,对其群落分析表明,由放线菌门、拟杆菌门、厚壁菌门和变形菌门4个门、7个纲、15个属的细菌组成,其中短小杆菌属在根、茎、叶中占比分别为20.00%、36.36%、69.23%,为内生细菌优势种群,同时伯克霍尔德菌属为根部优势种群,鞘脂单胞菌属为茎部优势种群,这些菌株也广泛存在于水稻等植物体内[27-28],但因芒草品种和土壤等外界环境不同,与COPE-SELBY等[10]关于芒草内生细菌群落组成研究有所差异。对比根际和内生细菌群落可以发现,根际优势种群短小杆菌属存在于根部、茎部和叶部,且同时为其优势种群。与此类似,土壤优势种群芽孢杆菌属菌株广泛存在于芒草不同组织内部。以上结果与内生细菌来源于土壤等外界环境,进入植物体内定殖和适度繁殖的观点相一致[29]。同时根部优势种群伯克霍尔德菌属、茎部优势种群Mucilaginibacter和叶部的黄杆菌属等只出现在相应的组织中,其中,菌株13、14只存在于芒草茎部,经分子鉴定、生理生化特性和化学组分分析,判定其为2个新种,分别命名为Mucilaginibacterendophyticussp.nov.[24]和Pedobactermiscanthisp.nov.[23],表现出不同组织群落组成的差异。同时不同培养基因其营养物质成分、离子含量等条件的差异,导致对微生物具有不同的选择性。对YN和R2A 2种培养基分离菌株进行分析发现,其群落组成互相补充,因此,后续研究时应考虑培养基种类及其组合以获得尽可能全面的芒草细菌群落组成[30]。
TIMMUSK等[31]研究表明,具有促生特性功能的可培养细菌在植物生长中起到重要的作用。植物促生细菌PseudomonaskoreensisAGB-1分离自芒草根部,芒草接种试验表明其能提高芒草生物量和重金属积累量[11]。本试验对芒草根际和内生细菌促生特性进行分析,发现很多菌株具有良好的促生特性。其中产IAA能力超过10.00 mg/L的菌株数为42株,占菌株总数的48.84%;产ADC的菌株36株,占菌株总数的41.86%;溶磷能力超过100.00 mg/L的菌株44株,占菌株总数的51.16%。这些菌株分布于放线菌门、拟杆菌门、厚壁菌门和变形菌门4个门,7个纲,21个属,其中短小杆菌属、根瘤菌属、芽孢杆菌属、伯克霍尔德菌属、鞘脂单胞菌属为其主要组成,该结果与之前的关于促生细菌群落组成研究类似[32-34]。其中菌株29(RhizobiumradiobacterATCC 19358T)、菌株21(PseudomonassimiaeOLiT)、菌株22(PseudomonashunanensisLVT)、菌株44(StaphylococcushaemolyticusMTCC 3383T)等同时具有3种促生特性,是后续用于研究提高芒草生长能力的良好菌种资源。细菌组成和促生能力分析表明,不同部位之间有所差异,根际细菌产ADC和溶磷能力较强菌株比例均低于内生细菌,产IAA能力较强菌株比例低于叶部,高于根部和茎部。可见,植物组织内部作为重要的促生细菌来源,在后续芒草促生细菌筛选过程中应予以重视。

