中国和印度黍稷的遗传差异分析
林元香,陈小红,王 蓉,石甜甜,陈 凌,王海岗,乔治军,王瑞云,
(1.山西农业大学农学院,山西太谷030801;2.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西太原030031)
黍稷(Panicum miliaceum L.)又名糜子,属禾本科黍属,起源于我国,已有1万多年的栽培历史[1]。黍稷具有抗旱、耐盐、适应性强、产量稳定、生长周期短等优点[2],是干旱半干旱地区人们日常生活的粮食保障与救灾作物[2-3]。黍稷拥有丰富的抗旱基因,可以通过基因工程挖掘和克隆黍稷抗旱相关基因,进而对作物进行遗传改良。干旱胁迫下,黍稷在分子、生理生化及形态解剖等多个方面会形成适应机制。研究发现,干旱胁迫下黍稷抗旱相关基因表达受阻,复水后基因表达量显著增加[4]。另外,黍稷富含一些对人体有益的成分,如卵磷脂会保持神经系统的健康状态,不仅会改善神经系统的功能,还能减缓人体衰老,进而避免老年性疾病的发生[5]。由于适用于黍稷多样性分析的RAPD、ISSR和AFLP等分子标记有限[6-9],而具有等位基因变异多、多态性信息含量高、稳定性和重复性好、进化所受选择压小等优势的SSR分子标记更易开发,且已经在小麦、水稻、玉米等大宗作物中广泛应用[10-18]。
近年来,SSR标记在黍稷上的研究也取得了长足进展。2009年,HU等[19]用46对来源于水稻、小麦、燕麦和大麦的SSR标记对来自不同地理来源的118份黍稷资源进行遗传差异分析,结果表明,黄土高原地区的遗传多样性最为丰富。2011年,HUNT等[20]用16对SSR标记对98份欧亚大陆黍稷资源进行遗传差异分析,共检测到78个等位基因,基于遗传距离分为东部和西部两大类群,它们也存在少数交叉现象;2015年,董俊丽等[21]用19对黍稷特异性SSR标记分析了96份不同地区的黍稷资源,结果表明,山西黍稷的遗传多样性最丰富,地理来源相似的黍稷种质资源亲缘关系也较近;2016年,刘笑瑜等[22]用6对黍稷特异性SSR引物分析了40份黍稷的遗传多样性,检测出等位变异20个,其多样性指数(I)和多态性信息含量(PIC)分别为0.542 6和0.340 3;同年,连帅等[23]利用63对黍稷特异性SSR标记评估来自10个不同地理来源的192份国内外黍稷资源,共检测到161个等位变异,其中,内蒙古及东北、黄土高原地区种质资源遗传多样性最丰富,国内黍稷遗传多样性总体高于国外;2017年,王瑞云等[24]用85对黍稷特异性SSR标记分析了来源于6个糜子生态栽培区的96份黍稷种质资源,检测到232个等位变异,基因多样性指数为0.770 8,多态性信息含量为0.472 3;2018年,HUNT等[25]用16个SSR和2个GBSSI标记分析了341份欧亚大陆黍稷资源(195份来自我国),发现黄土高原西部为黍稷的主要驯化地;薛延桃等[26]用103对黍稷多态性SSR标记对146份黍稷资源(85份国内野生资源和61份国外地方品种)进行了遗传多样性分析,发现国内资源的观测等位基因数(2.912 6个)、多样性指数(0.830 2)、期望杂合度(0.502 3)、多态性信息含量(0.527 8)均高于国外资源,遗传多样性更丰富;2019年,寇淑君等[27]用22对特异性SSR标记对131份黍稷资源(72份育成品种和59份农家种)进行遗传多样性分析,发现I为1.2062,PIC为0.587 4,北方春黍稷区和黄土高原春夏黍稷区的遗传多样性最丰富。
近年来,分子育种是遗传育种研究的主流方向,应进一步加强对野生材料和南方种质资源的收集与国外资源的引进,以丰富现有资源,方便进行遗传差异分析,并促进黍稷进行演化传播、遗传改良等方面的研究。印度的沙质和微酸性土壤中依然分布着黍稷,足见黍稷具有较强的适应性,研究印度黍稷对提高我国黍稷的抗性具有显著意义,可帮助我们扩充遗传基因库,获取丰富有利的遗传资源,提高作物品质。
本研究用基于转录测序手段开发的80个SSR引物对56份国内外黍稷资源的遗传差异进行评价,旨在利用黍稷种质资源的遗传差异性与地理分布特点,为优异种质鉴定、基因挖掘、种质资源保护和黍稷起源演化提供分子依据。
1 材料和方法
1.1 试验材料
供试材料为56份黍稷资源,来源于国家种质资源库(国内29份,国外27份),分布于中国和印度的7个黍稷生态栽培区(表1)。
1.2 基因组DNA提取
2017年5月10日将56份黍稷资源种植于山西农业大学农作站,种植方法参照文献[22]进行。采用改良的CTAB法[28]提取三叶期黍稷基因组DNA,检测质量并稀释浓度至30~80 ng/μL。
1.3 PCR扩增及聚丙烯酰胺凝胶电泳检测
PCR扩增在BIO-GENER基因扩增仪(GT9612)上进行,反应体系(20μL)包括2×MasterMix(中科瑞泰2×Taq PCRMasterMix)10μL、引物(终浓度为0.4μmol/L)各0.8μL、ddH2O 7.4μL和DNA模板1μL。反应程序为:94℃5 min;94℃40 s,不同Tm退火40 s,72℃1 min,36个循环;72℃10 min。用8%聚丙烯酰胺凝胶电泳检测PCR扩增产物,0.1%硝酸银染色显影,凝胶成像仪成像保存。
1.4 数据分析
对PCR扩增条带进行读取并将其整理为基因型数据(0,1),用Excel转换成不同软件相应格式。用PopGen1.32[29]计算黍稷材料的等位基因数(Na)、等位基因频率、基因多样性指数(I)及群体间聚类分析等;用PowerMarker 3.25[30]分析引物及材料多态性信息含量(PIC);用MEGA 5.0[31]基于UPGMA构建聚类图;用Structure2.2[32]分析群体遗传结构。用NTSYSpc2.11[33]进行主成分分析。利用“Genepop on the web”在线软件(http://genepop.curtin.edu.au.html)对群体各标记位点的无效等位基因频率和哈迪-温伯格平衡(Hardy-Weinberg equilibrium)进行检验。

表1 供试黍稷资源明细
2 结果与分析
2.1 无效等位基因频率与哈迪-温伯格平衡检验
基于80个SSR标记对56份材料进行无效等位基因频率和哈迪-温伯格平衡的卡方检测。结果表明,所有标记除新疆和内蒙古的两大群体外均存在不同程度的偏离Hardy-Weinberg平衡(P<0.05或P<0.01),无效等位基因频率为0.000 0~0.816 5,各位点(80个位点×7个群体)均存在无效等位基因(合计219个)。就偏离平衡的位点数和无效等位基因数而言,印度最高(分别为69、53个),新疆最低(分别为0、21个)。
2.2 基于特异性SSR标记分析遗传多样性和遗传相似性
用80对引物分析56份黍稷资源的遗传参数,结果发现,56份材料在80个位点中共检测出206个等位变异,其中,34对产生了2个变异,46对产生了3个变异,平均值为2.575 0个变异,有效等位基因181.935 9个,占比88.32%;多样性指数介于0.646 1(WRY92)~1.066 7(WRY111),平均值为0.851 7;期望杂合度介于0.4537(WRY92)~0.6466(WRY111),平均值为0.553 8;多态性信息含量介于0.159 6(WRY132)~0.660 7(WRY111),平均值为0.440 8。综合而言,引物WRY111遗传参数最高,WRY92的遗传参数最低。分析不同地区黍稷资源的遗传多样性参数(表2),就多样性指数而言,印度最高(0.838 0±0.1435),新疆最低(0.7454±0.2081);就多态性信息含量而言,印度最高(0.394 8),内蒙古最低(0.2340);不同省份间黍稷资源遗传距离与一致度分析结果表明(表3),山西与黑龙江间遗传距离最小(0.0407),遗传一致度最高(0.960 1);黑龙江与内蒙古间遗传距离最大(0.122 0),遗传一致度最低(0.885 2)。就中国和印度黍稷两大群体的多样性指数和多态性信息含量而言,中国大于印度,说明中国黍稷资源的遗传多样性高于印度(表4)。
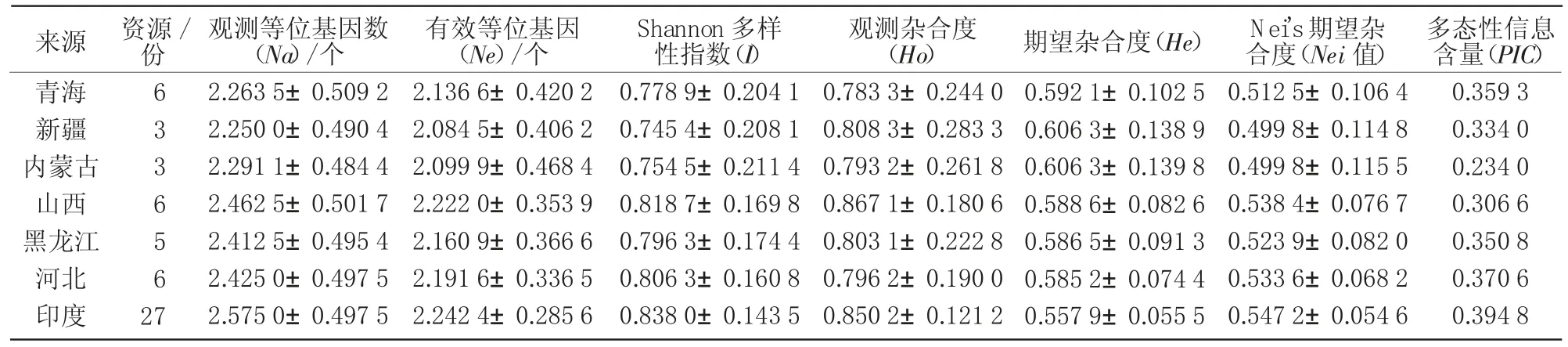
表2 不同地区黍稷的遗传多样性参数

表3 不同省份黍稷资源的遗传一致度与遗传距离

表4 中国和印度黍稷的遗传参数评估
2.3 聚类分析
根据UPGMA聚类分析,将56份材料划分为4个类群:类群Ⅰ有21份,主要包括印度黍稷(共18份,占85.7%)和新疆、内蒙古(共3份,14.3%);类群Ⅱ有11份,主要包括山西省和河北省黍稷(共6份,占54.5%),即主要为黄土高原春夏区黍稷;类群Ⅲ有17份,主要包括国内(河北、青海、山西、黑龙江和新疆,共12份,占70.6%)和印度(共5份,占29.4%);类群Ⅳ有7份,主要包括青海省(共3份,占42.9%)(图1)。
2.4 群体结构分析
对56份黍稷材料建模(图2)并分析群体结构(图3),发现等位变异频率特征数Delta K(Delta K根据EVANNO等[34]的方法计算得到,其中,K为遗传群体数)在K=3处峰值明显(图2),利用Structure将试验材料划分为3个群组(图3)。从表5可以看出,类群i有22份,包括印度20份、内蒙古和山西各1份;类群ii有2份,来自于印度;类群iii有32份,主要来自于中国(新疆、内蒙古、山西、河 北、黑龙江和青海省),也有印度少量材料。

表5 遗传结构图中各类群的统计(K=3) 份
分析遗传结构图各分类群的遗传差异参数发现,类群ⅱ的多态性信息含量和多样性指数最低,基因遗传多样性较低;类群ⅲ的多态性信息含量和多样性指数最高,基因遗传多样性较高,在此区域中中国黍稷的资源数目相对较多,说明中国黍稷的遗传多样性更为丰富(表6)。

表6 遗传群体结构图中各类群的遗传差异参数
2.5 主成分分析
聚类分析将地理起源和种系发生一致性进行同一群体聚类,但存在少数个体例外,例如,类群Ⅱ存在着少数的黑龙江黍稷,类群Ⅳ也有少数黑龙江黍稷,各群体间皆有交叉现象。主成分分析(Principle Component Analysis,PCA)可解释图1这些特例。PCA结果(图4)表明,前3个主成分PC1、PC2和PC3分别解释了总变异的42.04%、3.17%和2.80%,累积贡献率为48.01%。PC1将国内各个类群及国外群体划分出5个类群,第1个类群共6份,全部来自青海;第2个类群共3份,全部来自新疆;第3个类群共3份,全部来自内蒙古;第4个类群共21份,包括山西、黑龙江、河北的全部和4份印度黍稷;第5个类群包括23份印度黍稷。由图4可知,主成分分析的5个类群划分界限清楚,种群结构明显,而印度和河北黍稷存在少量交叉现象。
3 结论与讨论
本研究中,基于遗传距离分析黍稷种质资源,类群Ⅳ主要为青海黍稷,但黑龙江资源(19号黄糜子)也包含在该类群;印度的黍稷在每个类群均有分布。基于遗传结构聚类,结果发现,类群i主要包括印度黍稷,但内蒙古资源(达旗黄秆大白黍)也包含在该类群;印度黍稷在每个类群均有分布。但利用主成分分析却将上述个例划分在同一类群中。在主成分分析中,黑龙江资源19号黄糜子归于黑龙江类群,与青海黍稷分成2个不同的类群;内蒙古资源达旗黄秆大白黍归于内蒙古类群,与印度黍稷分成2个不同的类群。各个黍稷生态区具有较清晰的群体结构,各种系与其地理起源基本一致,这与前人研究结果[35]基本一致。通过主成分分析发现,在小麦、玉米、水稻和大豆等其他物种中也存在明显的群体结构[36-39],可见,主成分分析在明确其地理起源和种系发生的一致性方面具有一定的作用。
王舒婷等[35]用27对SSR引物分析了57份山西黍稷的遗传多样性,发现多样性指数为0.768 6。而本研究发现山西黍稷的多样性指数为0.818 7,高于前者,可能与本研究所用引物的数目较多有关。寇淑君等[26]研究发现,黄土高原春夏糜子区与北方春糜子区之间黍稷资源的遗传距离最小,遗传一致度最高,亲缘关系较近。本研究也有类似结果,即山西与黑龙江资源间遗传距离最小。寇淑君等[26]和王瑞云等[40]均用荧光SSR标记分析了中国黍稷的遗传多样性,二者的等位变异数分别为5.82、7个,Shannon多样性指数为1.206 2和0.529 8,PIC分别为0.587 4和0.486 4,本研究的等位变异数、Shannon多样性指数和PIC分别为2.575 0个、0.851 7和0.440 8。可见,本研究的多样性指标整体较差,遗传多样性较低,证明了荧光SSR确实比常规SSR更有利于提高黍稷遗传多样性检测的准确性,可以测出普通聚丙烯酰胺凝胶电泳识别不出的等位变异,结果更加可靠准确。薛延桃等[41]利用103对黍稷特异性SSR标记对216份新疆、甘肃的黍稷资源进行了遗传差异分析,结果表明,平均Shannon多样性指数为0.736 0,平均观测杂合度为0.629 8,平均期望杂合度为0.549 7,而本研究分别为0.851 7、0.830 8和0.559 2,本研究用较少的SSR标记和材料研究出了较高的遗传多样性,这或许与本研究所用的标记较好、黍稷的多样性较高有关。
在主成分分析中,印度黍稷与河北黍稷存在交叉现象,说明它们存在相似的遗传组成。HUNT等[20]在模型群体结构分析的基础上,利用16对SSR标记对98份欧亚大陆黍稷资源的遗传结构进行了差异分析,发现黍稷资源划分类群与其地理来源相对应,存在一定的匹配联系,本研究也将相同地理来源的划分为一类。基于主成分分析,王舒婷等[35]用27对SSR引物分析了57份山西黍稷,发现主成分分析中的PC1、PC2和PC3共解释了35.80%的累积贡献率,而本研究前3个主成分共解释了48.01%的累积贡献率,二者的累积贡献率均小于85%,均没有达到相对典型的比率值,这可能与黍稷本身的异源四倍体特性、基因组相对复杂、序列信息缺乏有关,因此,各基因型间存在连锁不平衡。

