行维持性血液透析治疗的患者血清骨桥蛋白、血管内皮生长因子、基质金属蛋白酶9水平及其与血管钙化的关系▲
贺晓雯 徐玉祥 张九芝 马 刚
[1 陕西省西电集团医院肾内科,西安市 710077,电子邮箱:hexiaowen8190@163.com;2 西北大学附属医院(西安市第三医院)感染科,陕西省西安市 710000]
维持性血液透析(maintenance hemodialysis,MHD)是延长尿毒症患者生命的治疗方法。随着各种疾病发生率的增加,由此导致的终末期肾病患者也逐年增多,给患者家庭和社会带来沉重的经济负担[1-2]。在MHD治疗过程中,患者不可避免地发生电解质失衡、营养素损失、睡眠障碍等各种并发症。相关资料显示,血管钙化者发生心血管病变的概率,较普通人群高20~30倍,血管钙化是导致慢性肾脏病行MHD治疗患者发生心血管病变并发症的主要原因[3]。寻找MHD患者血管钙化的影响因素,对于早期干预、降低钙化率尤为重要[4-5]。既往研究表明,骨桥蛋白在高磷诱导的血管平滑肌细胞钙化中异常表达[6],血管内皮生长因子(vascular endothelial growth factor,VEGF)在软骨钙化过程中起到重要作用[7],而基质金属蛋白酶(matrix metalloproteinase,MMP)-9与大鼠动脉钙化密切相关[8]。但三者在MHD患者血清中的表达水平及其与血管钙化关系如何,鲜见报告。本研究探讨行MHD治疗的患者血清骨桥蛋白、VEGF、MMP-9水平及其与血管钙化的关系,现报告如下。
1 资料与方法
1.1 临床资料 选取2017年11月至2019年1月在西电集团医院接受MHD治疗的51例患者作为研究对象。纳入标准:(1)均患有慢性肾小球肾炎并接受MHD治疗 ,慢性肾小球肾炎的诊断符合《肾脏病学》[9]中的标准;(2)无慢性肾衰竭症状;(3)透析时间>6个月;(4)均选用碳酸氢盐进行血液透析治疗。排除标准:(1)急性肾功能衰竭接受血液透析者;(2)严重营养不良者;(3)自行退出本次研究者;(4)有其他系统疾病者。根据骨盆X片血管钙化程度将患者分为非血管钙化组30例和血管钙化组21例。另外选取健康者51例作为对照组。3组一般资料比较,差异无统计学意义(均P>0.05),具有可比性,见表1。该研究由西电集团医院伦理委员会审核通过,所有患者及其家属都被告知研究目的并签署知情同意书。

表1 3组一般资料比较
1.2 方法
1.2.1 透析方法:所有患者先进行动静脉内瘘术,采用端侧吻合内瘘手术将桡动脉-头静脉吻合。血透时,将穿刺针穿入瘘管,并与人工透析机相连。采用德国贝朗Dialog血液透析机进行血液净化,加入碳酸氢盐透析液滤除体内积聚的代谢废物。每次血液透析治疗持续4 h,每周2~3次,均在医院门诊进行。
1.2.2 血液指标检测:抽取研究对象空腹静脉血5 mL(非血管钙化组及血管钙化组患者于入组后行第1次透析前采集,对照组于体检当日采集),静置30~60 min,4 000 r/min离心5 min分离血清,分装在干净的离心管中,置于-70℃冰箱(日本日立有限公司)保存待测。采用双抗夹心酶联合免疫吸附法测定血清骨桥蛋白、VEGF、MMP-9水平,检测试剂盒分别购自Paisley生物科技有限公司(批号:1708267)、美国R&D公司(批号:1711033)、美国RB公司(批号:1710182),所有操作均按试剂盒说明说明书进行,每份标本分别检测2次后取其平均值。采用瑞士Hitachi 7600-210全自动生化分析仪检测钙、磷、血清白蛋白、血红蛋白、总胆固醇、三酰甘油、HDL-C、LDL-C水平。测量研究对象静息状态下右臂肱动脉收缩压、舒张压。
1.2.3 血管钙化的评定:对接受MHD的患者进行骨盆X片检查。分别以股骨头切面和脊柱位置作为水平线和垂直线,根据文献[10]的方法进行评定。
1.3 统计学分析 采用SPSS 23.0软件进行统计学分析。计量资料以(x±s)表示,组间比较采用单因素方差分析,两两比较采用SNK-q检验;计数资料以例数(百分比)表示,组间比较采用χ2检验;采用二分类Logistic逐步回归分析影响MHD患者血管钙化的危险因素。以P<0.05为差异具有统计学意义。
2 结 果
2.1 3组血液指标及血压的比较 3组收缩压、舒张压以及血清白蛋白、血红蛋白、钙、磷、三酰甘油、总胆固醇、骨桥蛋白、VEGF、MMP-9水平比较差异均有统计学意义(P<0.05)。其中对照组、非钙化组、钙化组血清骨桥蛋白、VEGF、MMP-9、钙、磷水平依次升高,血红蛋白水平依次降低;与对照组比较,钙化组及非钙化组收缩压、舒张压、三酰甘油、总胆固醇水平升高,血清白蛋白、HDL-C水平降低(均P<0.05),见表2。
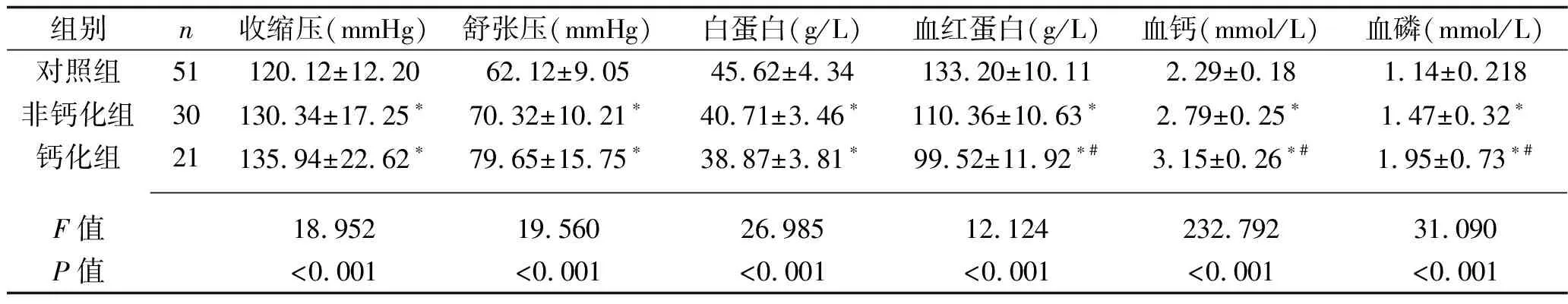
表2 钙化组、非钙化组和对照组相关指标比较(x±s)

组别n三酰甘油(mmol/L)总胆固醇(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)骨桥蛋白(g/L)VEGF(ng/L)MMP-9(ng/mL)对照组511.41±0.253.65±1.121.25±0.172.74±0.3728.25±9.8752.57±13.2262.67±15.24非钙化组301.67±0.45∗5.83±1.25∗1.03±0.26∗2.84±0.62112.32±27.41∗74.52±19.43∗86.13±20.13∗钙化组212.89±0.67∗6.97±1.47∗0.98±0.28∗2.80±0.54182.02±32.32∗#91.24±17.25∗#104.25±20.44∗# F值91.44163.83315.2730.413128.77415.29237.694P值<0.001<0.001<0.0010.664<0.001<0.001<0.001
注:与对照组比较,*P<0.05;与非钙化组比较,#P<0.05。
2.2 MHD患者发生血管钙化影响因素的Logistic回归分析 以MHD患者血管钙化为因变量(无=0、有=1),以单因素分析有意义的变量为自变量(均为连续变量)进行二分类Logistic逐步回归分析。结果显示,血清钙、磷、骨桥蛋白、VEGF、MMP-9水平升高均为MHD患者血管钙化的危险因素(均P<0.05),见表3。
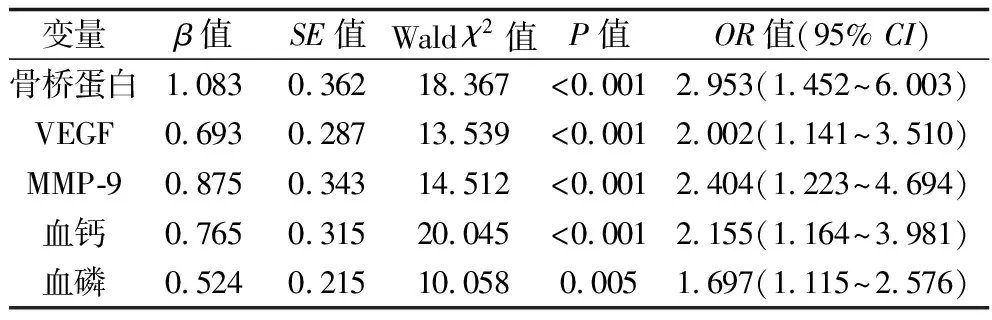
表3 Logistic回归分析结果
3 讨 论
随着透析技术的推广,接受MHD患者的预后有所改善,但终末期肾脏病透析患者普遍并发血管钙化,而血管钙化是接受MHD患者发生心血管并发症导致死亡的主要原因[11]。既往血管钙化被认为是一个被动的、退化的、不可避免的终末过程,但是最新研究显示,血管钙化是一种类似于软骨形成的可主动调节、可治疗和预防的过程[12-13]。以往的观点认为,血管钙化是过饱和的钙磷的被动沉积,与血管退化相关。但目前的观点普遍认为,血管钙化是细胞主动调节的病理过程,具有复杂的分子机制。正常情况下,许多钙化抑制因子(如焦磷酸盐、腺苷、基质Gla蛋白等)保护血管和瓣膜,防止矿物质异常沉积于软组织。当钙化抑制因子活性降低,钙化刺激因子(磷、钙、甲状旁腺激素等)活性增加时可导致血管钙化[14-15]。
骨桥蛋白最早是从骨基质中分离出来的一种功能蛋白,其能够诱导骨组织和骨基质相连,可对骨基质的矿化以及重吸收的过程产生重要作用。骨桥蛋白是细胞外基质中的一种由多种组织细胞合成和分泌的多功能性磷酸化糖蛋白,参与介导细胞黏附、增殖和迁移以及肿瘤发展等多种病理生理过程[16]。VEGF是从体外培养的牛垂体滤泡星状细胞培养液中分离出的一种多肽,平滑肌细胞、心肌细胞、垂体滤泡星状细胞以及肿瘤细胞均可分泌VEGF,肾小球脏层上皮细胞、足细胞也可产生VEGF。其主要作用是促血管内皮细胞有丝分裂,促进新生血管的形成;同时,其也是血管通透因子,可以增加血管通透性。在肺、脑、心脏、肾和子宫内膜等富含血管组织的器官或组织中均有VEGF mRNA的表达,而缺血/缺氧是造成VEGF增加的主要原因之一[17-18]。MMP是一组依赖性内肽酶家族,其中MMP-9是一种由多种细胞分泌的分子量为92KD的糖蛋白,它参与了血管的炎症反应和再生等病理进程,在内膜损伤和粥样病变形成的过程中起重要作用[19]。
本研究结果显示,对照组、非钙化组、钙化组血清骨桥蛋白、VEGF、MMP-9、钙、磷水平依次升高,血红蛋白水平依次降低(均P<0.05)。Logistic逐步回归分析结果显示,高钙、高磷、高血清骨桥蛋白、VEGF、MMP-9水平均是接受MHD患者发生血管钙化的危险因素,与相关研究结果相似[20-21]。血清骨桥蛋白是细胞及基质内一种重要的磷酸化因子,不仅在骨代谢中产生重要作用,同时对血管管壁钙化产生影响[22],因此推测其可能是连接骨质疏松和血管钙化的重要因子,而骨桥蛋白水平的升高可能是机体的防御性代偿机制。VEGF能够降解基底膜,产生一些蛋白和酶,使内皮细胞向周围迁移,使血管平滑肌紧张性增加,导致血管痉挛引起能量代谢损伤及自由基生成过量,加速血管损伤[23]。有研究显示,在多种因素的作用下,行MHD治疗的患者血管钙化风险较健康者高[24],而这可能与患者血清VEGF水平增高有关,提示VEGF在动脉粥样硬化的发生发展中起关键性作用,有可能是血管钙化的一个预测指标。有研究表明MMP-9通过对Ⅳ型胶原过度降解和转运,破坏了血管壁的完整性[25]。本研究结果显示,行MHD治疗的患者MMP-9水平升高,其中血管钙化者更明显,提示MMP-9水平可能与血管重塑有关,其可能通过参与血管组织重构和钙盐沉积,促进MHD患者血管钙化的发生。
综上所述,行MHD治疗的患者血清骨桥蛋白、VEGF、MMP-9水平增高,其中出现血管钙化者更明显;高水平血清骨桥蛋白、VEGF、MMP-9是行MHD治疗的患者发生血管钙化的危险因素。

