温度对生物基聚酰胺56氢键的影响
杨婷婷,高远博,MUTUA Fredrick Nzioka,胡红梅,
刘修才2,郑 毅2,王学利1c,何 勇1c
(1. 东华大学 a. 材料科学与工程学院; b. 纺织学院; c. 纺织科技创新中心,上海 201620;2. 上海凯赛生物技术研发中心有限公司,上海 201203)
近年来凯赛生物产业公司利用可再生资源成功研发了生物基1,5-戊二胺的产业化技术。由生物基1,5-戊二胺和石油基己二酸聚合而成的一种新型生物基奇偶聚酰胺——聚酰胺56(PA56),其具有和PA66相当的热性能、力学性能以及加工性能,可以通过注塑、吹膜、熔融纺丝等方式加工成型,有望应用于工程塑料、薄膜及纤维领域,具有非常广阔的应用前景[1]。特别是因生物基PA56纤维的吸湿性能优异、手感良好且可染性极佳而广受关注。与PA6和PA66一样,PA56主链上含有大量的酰胺基团且可形成大量分子间和分子内氢键。众所周知,氢键对聚酰胺的热性能、力学性能、加工性能以及染色性能等具有重要的影响。作为新型生物基聚酰胺的PA56,其氢键结构还鲜有研究涉及,并且其与PA66的主要区别在于主链含有奇数碳的二胺单元,因此研究PA56的氢键具有重要的理论意义及应用价值。
变温红外光谱技术是研究聚酰胺在不同温度下氢键结合状态的常用方法。大多数变温红外光谱的研究工作主要聚焦于聚酰胺的酰胺基团。Schroeder等[2]利用升温红外光谱技术测定了不同聚酰胺中氢键的解离焓,结果表明氢键的解离焓与聚酰胺的类型无关。Skrovanek等[3]利用升温红外光谱技术对一种无定型聚酰胺的氢键进行了研究,指出文献[2]获得的解离焓由于未考虑吸收系数与氢键强度的关系而导致游离N—H基团的比例被高估。Skrovanek等[4]还用升温红外光谱技术对半结晶尼龙PA11进行了研究,结果表明,相对于N—H的伸缩振动区域,酰胺Ⅰ带对构象具有较高的温度敏感性。此外,也有不少报道利用变温红外光谱对PA6、 PA66、 PA12等聚酰胺的氢键展开了研究[5-8]。然而,迄今为止,还没有利用变温红外光谱研究PA56氢键的报道。
本文利用变温红外光光谱技术测定了降温及升温过程中PA56的系列红外光谱,考察了PA56红外光谱中酰胺Ⅰ带、酰胺Ⅱ带及N—H伸缩振动谱带随温度的变化情况,探究温度对PA56氢键的影响。
1 试验部分
1.1 试验材料
生物基PA56切片为凯赛自制,相对黏度为2.83,熔点为252 ℃。三氟乙酸(AR级)购自梯希爱(上海)化成工业发展有限公司。
1.2 样品制备
取适量的PA56切片溶于三氟乙酸中,得到PA56质量分数为4%的聚合物溶液。采用溶液涂覆技术将聚合物溶液涂覆在直径为2 cm的溴化钾窗片上,以制备用于红外分析的样品(溶液成膜)。于室温下蒸发大部分溶剂后,将样品置于100 ℃的真空干燥箱中12 h以去除残留的溶剂及水分,然后立即转移到光谱仪所在的温度池中。此外,对PA56切片施加0.98 kPa的压力,并在280 ℃下保持3 min,随后冷却至室温,制得PA56薄膜(熔融成膜)。
1.3 测试方法
傅里叶变换红外光谱测试(FTIR):采用美国Thermo Fisher公司带有数字温度控制器的Nicolet 6700型傅里叶红外光谱仪进行红外测试。测量程序由两个阶段组成:(1)降温。将样品加热至280 ℃保持5 min以消除热历史及吸附水,随后以2 ℃/ min的降温速率将样品从280 ℃降至80 ℃。(2)升温。在80 ℃保温5 min后将样品以2 ℃/min的升温速率升至280 ℃。降温及升温过程中,每5 ℃ 收集一次FTIR光谱。光谱的扫描范围为4 000~ 400 cm-1,扫描次数为32次。
2 结果与讨论
2.1 PA56红外光谱总体概述
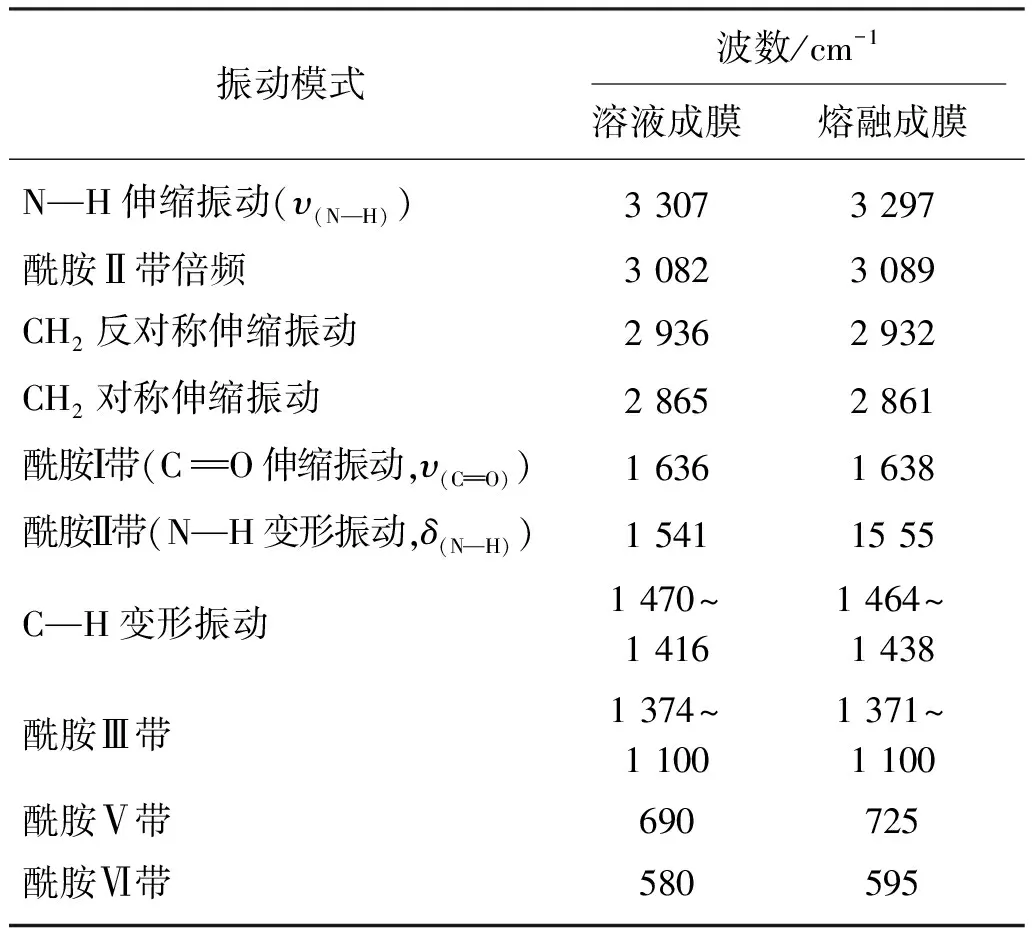
表1 PA56不同谱带对应的振动模式说明
注:υ为伸缩振动,δ为变形振动。
PA56降温及升温过程中的红外光谱如图2所示。由图2可以直观地观察出各个谱带特征吸收峰波数及强度随温度的变化情况。此处着重分析讨论与氢键相关的红外谱带,即酰胺Ⅰ带、酰胺Ⅱ带和N—H伸缩振动谱带。
Fig.2 Infrared spectra of PA56 at the range of 3 600~2 700 cm-1and 1 850~1 100 cm-1
2.2 酰胺Ⅰ带及酰胺Ⅱ带



Fig.5 Wavenumbers of hydrogen-bonded carbonyl and amine groups with the change of temperature at the range of 1 800~1 475 cm-1
2.3 N—H伸缩振动谱带
PA56在3 490~3 120 cm-1内的升降温红外光谱如图6所示。从图6可以看出,PA56在3 440和3 303 cm-1处的红外波段分别归因于游离N—H和氢键键合N—H的伸缩振动。对于N—H的伸缩振动:降温过程中,游离N—H的峰强逐渐减小,而氢键键合N—H的峰强逐渐增大,波数从3 344 cm-1降至3 303 cm-1,向低波数移动了41 cm-1;升温过程中,游离N—H峰强逐渐增加,氢键键合N—H的峰强逐渐减小,波数从3 303 cm-1增加到3 345 cm-1,向高波数移动了42 cm-1。升温过程中各温度的红外光谱减去80 ℃的红外光谱所得到差谱如图7所示。从图7可以看出,以80 ℃的红外谱图为基准,随着温度的升高,游离N—H的面积增加,氢键键合N—H的面积降低。由此可得:随着温度的降低,游离N—H的数量逐渐减少,部分缔合成氢键,使得氢键密度增加;反之,随着温度的升高,键合N—H的氢键被破坏,部分氢键键合N—H逐步解缔合为游离N—H,氢键密度降低。

3 结 语
本文利用变温红外光谱技术研究了生物基PA56红外谱图中酰胺Ⅰ带、酰胺Ⅱ带及N—H伸缩振动谱带随温度的变化情况,探究了温度对PA56氢键的影响。研究发现:随着温度的升高,酰胺Ⅰ带和N—H伸缩振动谱带中游离羰基、氨基的红外吸收峰强逐渐增大;氢键键合羰基、氨基的红外吸收峰强减小且向高波数移动,发生蓝移。随着温度的升高,酰胺Ⅱ带中游离基团谱带的峰强逐渐增大;氢键键合基团谱带的峰强逐渐减小,向低波数移动,发生红移。氢键键合N—H的波数在190 ℃时的突变归因于游离N—H振动峰与氢键键合N—H振动峰的重叠。由此可知:随着温度的下降,部分游离基团逐渐缔合成氢键,氢键密度增加;随着温度的升高,部分氢键被破坏,部分氢键键合基团逐步解缔合为游离基团,导致氢键密度降低。

