重组人β-catenin原核表达条件的优化及生物学活性鉴定
牛夏忆, 韩茂椿, 李 淼, 陈云雨, 刘晓平
(皖南医学院 药物筛选与评价研究所,安徽 芜湖 241002)
高度活化的Wnt/β-catenin信号通路在多种肿瘤的发生与发展中发挥重要的促进作用,已经成为肺癌、肝癌、乳腺癌、慢性淋巴细胞白血病等多种肿瘤分子靶向治疗的理想靶标之一[1-3]。β-catenin作为经典Wnt信号通路中重要的核转录调控因子,一方面可与E-cadherin相互作用,参与细胞连接的形成,另一方面通过与Lef1(lymphoid enhancer factor 1)的βBD结构域(β-catenin binding domain)在细胞质和细胞核内相互作用,促进β-catenin核内转运和转录调控元件(β-catenin responsive transcription, CRT)的形成,启动原癌基因的大量表达,促进肿瘤细胞的生长、增殖与分化[4-5]。β-catenin主要包括3个重要结构域,其N端约含130个氨基酸,有多个苏(丝)氨酸磷酸化位点,这些位点对于β-catenin的泛素化降解具有重要作用。C端约含100个氨基酸,含有转录因子结合位点,是重要的转录激活结构域。中间结构域是核心结构域,主要由12个连续重复的犰狳蛋白重复片段(armadillo repeats, 138~686 aa)组成,这些犰狳蛋白重复片段互相折叠,可形成狭长的螺旋状空间结构,几乎介导了与Wnt信号通路中所有重要大分子蛋白的相互作用,参与信号转导和原癌基因表达的调控,对β-catenin生物学功能的发挥尤为重要[4-5]。研究表明,在非小细胞肺癌(nonsmall cell lung cancer, NSCLC)的生长、分化、脑(骨)转移和耐药与复发的过程中,高度活化的β-catenin/Lef1相互作用发挥了重要的促进作用[6-10]。另外,Spranger等[11-12]在黑色素瘤抵抗免疫治疗的分子机制研究中发现,肿瘤细胞内β-catenin的高表达可能是肿瘤细胞抵抗免疫检查点抑制剂疗效的重要机制之一,但β-catenin如何在肿瘤微环境中调控免疫抵抗和肿瘤干细胞分化的分子机制目前尚未明确。本研究旨在优化重组人β-catenin(138~686 aa)在大肠埃希菌中的原核表达条件,经分离纯化后进行生物学活性鉴定,为深入研究β-catenin在肿瘤免疫抵抗中的生物学功能奠定实验基础。
1 材料与方法
1.1 材料
1.1.1 质粒和菌株 pET-30a(+)载体由中国医学科学院药物研究所林媛副研究员惠赠;大肠埃希菌E.coliDH5α感受态细胞和E.coliRosetta (DE3)感受态细胞购自General Biosystems公司;HeLa细胞由本室保存。
1.1.2 试剂 反转录试剂盒、Taq酶、DNA标准分子质量、pEASY®-T1试剂盒、EasyPure®胶回收和质粒提取试剂盒、蛋白质标准分子质量、BamHⅠ、XhoⅠ购自全式金公司;BCA(bicinchoninic acid)试剂盒购自Thermo公司;氨苄西林、卡那霉素、异丙基硫代半乳糖苷(isopropyl β-D-thiogalactoside, IPTG)购自Sigma公司;牛血清白蛋白(bovine serum albumin, BSA)、小鼠抗组氨酸(histidine, His)标签单克隆抗体、辣根过氧化物酶(horseradish peroxidase, HRP)标记的羊抗小鼠IgG购自Biosharp公司;HRP底物化学发光液购自上海天能科技有限公司;四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine, TMB)溶液购自天根生化科技(北京)有限公司;HisTrap层析柱购自GE公司;异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的Lef1 [FITC-Lef1: FITC-GDPELCATDEMIPFKDE]由杭州丹港生物科技有限公司合成;谷胱甘肽转移酶(glutathione S-transferase, GST)和GST-Lef1蛋白由本室制备;其他生化试剂为国产分析纯试剂。
1.1.3 仪器与设备 梯度PCR仪(C1000 TouchTM型,BIO-RAD公司)加热制冷型金属浴(H2O3-100C型,CYOTE BIOSCIENCE公司);琼脂糖水平电泳仪(DYCP-32B型,北京市六一仪器厂);电泳仪电源(DYY-2C型,北京市六一仪器厂);高速冷冻离心机(5804R型,eppendrof公司);细菌震荡培养箱(ZQLY-180N型,上海知楚仪器公司);超声波细胞粉碎仪(JY92-ⅡN型,SCIENTZ公司);AKTA Pure 25M(GE公司);蛋白质电泳仪(Mini-PROTEAN Tetra型,BIO-RAD公司);转膜仪(Trans-Blot®TurboTM型,BIO-RAD公司);凝胶成像分析系统(GenoSens 1800型,CLINX公司);多功能酶标仪(Cytation 5型,BioTek公司)。
1.2 方法
1.2.1β-catenin基因片段的扩增 β-catenin核心结构域即犰狳蛋白重复片段结构域(138~686 aa),主要介导与Wnt信号通路中重要大分子蛋白的相互作用[4-5]。根据β-catenin(138~686 aa)基因序列(GenBank:X87838.1),利用Primer Premier 5.0软件设计上游引物P1和下游引物P2,P1和P2引物中分别加入BamHⅠ与XhoⅠ酶切位点(表1)。以HeLa cDNA为模板,按照参考文献[13-14]所述的方法设置PCR程序,进行β-catenin基因片段(1 647 bp)的特异扩增。β-catenin基因片段的扩增结果以1%琼脂糖凝胶电泳检测,再以EasyPure®胶回收试剂盒进行回收。
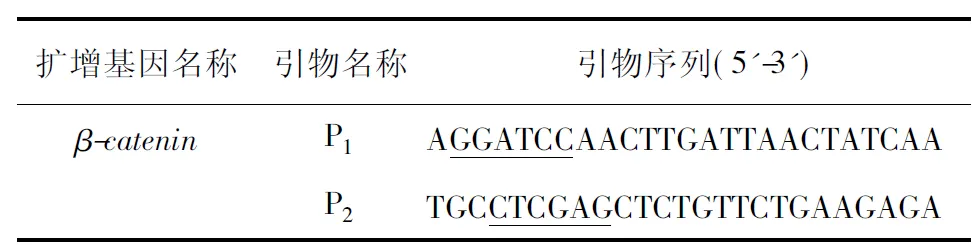
表1 引物设计
1.2.2 β-catenin克隆质粒的构建 利用pEASY®-T1试剂盒,将回收的β-catenin基因片段与T载体连接,按照参考文献[13-14]所述的方法进行β-catenin克隆质粒的构建。阳性克隆质粒由General Biosystems公司进行测序,再以DNAMAN软件进行序列比对分析。
1.2.3 β-catenin原核表达质粒的构建 按照参考文献[13-14]所述的方法进行重组质粒β-catenin-pET30a(+)的构建。将构建的重组质粒β-catenin-pET30a(+)转化到E.coliDH5α感受态细胞中,以单菌落PCR法初步经卡那霉素抗性筛选的单菌落鉴定阳性克隆后,再提取质粒以双酶切法进行鉴定。
1.2.4 β-catenin原核表达 按照参考文献[13-14]所述的方法进行β-catenin原核表达。将鉴定正确的重组质粒β-catenin-pET30a(+)转化到E.coliRosetta(DE3)感受态细胞中,将7株经卡那霉素抗性筛选的单菌落分别接种到LB液体培养基中,以1 mmol/L IPTG,37 ℃诱导6 h。离心收集菌体后,以8% SDS-PAGE检测β-catenin原核表达。
1.2.5 β-catenin诱导时间的优化 将工程菌于37 ℃培养至OD600达到0.7时,加入1.0 mmol/L IPTG后诱导和继续培养。分别在0、2、4、6、8、10、12 h时间点等量收集菌体,以SDS-PAGE和Clinx Image Analysis软件分析β-catenin表达量,确定最佳诱导时间。将诱导温度分别设置为30、25 ℃,重复上述操作,确定最佳诱导时间。
1.2.6 β-catenin诱导温度的优化 等量收集37 ℃诱导6 h、30 ℃诱导8 h和25 ℃诱导10 h的工程菌菌体,将其重悬于适量的TBS(50 mmmol/L Tris、150 mmol/L NaCl pH 8.0)溶液中,以超声波细胞破碎机裂解菌体。收集裂解后的上清液和沉淀,以SDS-PAGE鉴定β-catenin的可溶表达,确定最佳诱导温度。
1.2.7 IPTG诱导浓度的优化 将工程菌于37 ℃培养至OD600达到0.7时,分别加入0、0.2、0.4、0.6、0.8、1.0 mmol/L IPTG后,25 ℃诱导10 h。等量收集菌体,以SDS-PAGE分析β-catenin表达量并确定最佳IPTG诱导浓度。
1.2.8 β-catenin分离纯化与鉴定 工程菌经大量培养后,收集菌体并裂解。裂解的上清液用25%饱和硫酸铵盐析后制备粗提液,再按照参考文献[13-14]所述的HisTrap亲和层析方法和Western blot实验分别进行β-catenin的分离纯化与鉴定。纯化的β-catenin以SDS-PAGE进行纯度分析。
1.2.9 荧光偏振实验(fluorescence polarization, FP) 参考文献[13,15],首先将80 nmol/L FITC-Lef1(30 μL/孔,3组复孔)加入到全黑384孔板中,然后再以30 μL/孔的量依次加入1 000、900、800、600、400、200、100、50、0 nmol/L的β-catenin,室温孵育20 min,多功能酶标仪检测毫偏值(millipolarization unit, mP),拟合结合曲线后计算解离常数Kd值。
1.2.10 酶联免疫吸附测定实验(enzyme linked immunosorbent assay, ELISA) 按照参考文献[14]所述的ELISA方法进行β-catenin的生物学活性鉴定。包被GST与GST-Lef1(10 μg/mL,100 μL/孔)的96孔酶标板经10% BSA封闭后,各孔依次加入0、1、2、3、4、5、6、7、8、9、10 μg/mL β-catenin(100 μL/孔,3组复孔),室温反应1 h。依次加入小鼠抗His标签单抗(1∶ 2 000)和HRP-羊抗小鼠IgG(1∶ 4 000)后,以TMB溶液显色,多功能酶标仪检测OD450值。
2 结果与分析
2.1 β-catenin原核表达质粒的构建
利用设计的特异性引物,以HeLa cDNA为模板,特异性扩增出约1 647 bp的基因片段,与β-catenin预期大小一致(图1a)。随机选取6株经卡那霉素抗性筛选的单菌落进行PCR反应和质粒双酶切鉴定,实验结果表明,6株单菌落均可特异性扩增出约1 647 bp的基因片段(图1b)且重组质粒经双酶切后可再次得到同样大小的基因片段(图1c)。PCR扩增的β-catenin基因片段(QUERY)经测序和BLAST比对分析后,与β-catenin预期基因序列(SUBJECT)的同源性为100%(图1d)。上述结果表明,β-catenin原核表达质粒构建正确。
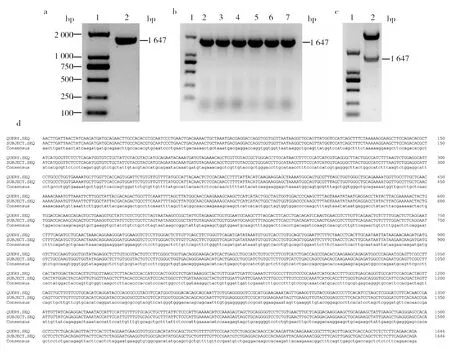
图1 β-catenin原核表达质粒的构建Fig.1 The construction of prokaryotic expression plasmid for β-catenina:β-catenin基因片段的扩增,1: DNA标准分子量, 2:β-catenin基因片段;b:单菌落PCR鉴定反应, 1: DNA标准分子质量, 2~7: PCR扩增的β-catenin基因片段;c: 重组质粒的双酶切鉴定,1: DNA标准分子质量, 2: β-catenin基因片段; d: PCR扩增的β-catenin基因片段BLAST分析 a:PCR product of β-catenin gene, 1: DNA Marker, 2: β-catenin gene;b: PCR products of six random positive clones, 1: DNA Marker, 2-7: β-catenin gene; c: Restriction enzyme digestion profile for β-catenin-pET-30a(+) plasmid, 1: DNA Marker, 2: β-catenin gene fragment; d: BLAST analysis map for β-catenin gene amplified by PCR
2.2 β-catenin的原核表达
SDS-PAGE分析表明,7株工程菌经IPTG诱导后,在相对分子量66 kDa左右显现明显的蛋白表达条带,这与预期的β-catenin分子质量基本一致(图2)。上述结果表明,成功进行了β-catenin原核表达。
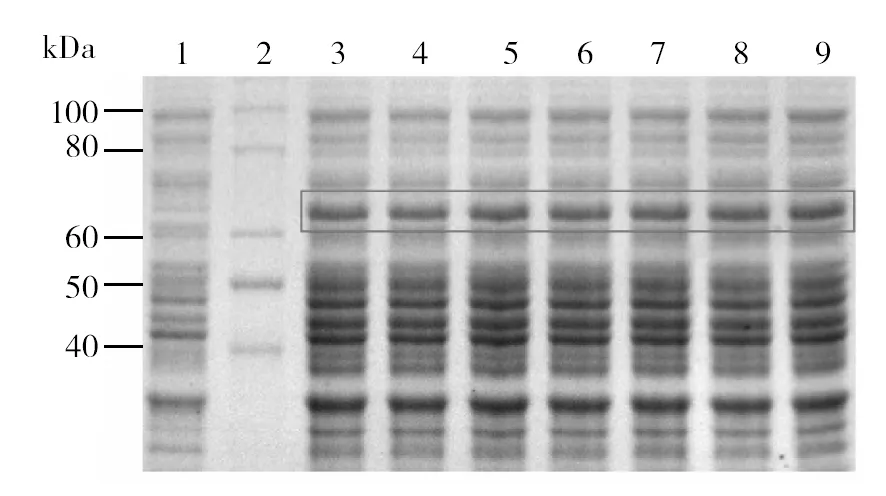
图2 β-catenin的原核表达Fig.2 Prokaryotic expression of β-catenin 1: 阴性对照; 2: 蛋白质标准分子质量; 3~9: 诱导的工程菌1: Negative control; 2: Protein Marker; 3-9: Positive clones
2.3 β-catenin诱导时间的优化
工程菌经不同诱导温度和诱导时间培养后,等量菌体以SDS-PAGE和Clinx Image Analysis软件分析β-catenin原核表达量。当诱导温度为37 ℃时,β-catenin表达量在诱导6 h时趋于稳定,最大表达量约为16.43%(图3a、3b);当诱导温度为30 ℃时,β-catenin表达量在诱导8 h时趋于稳定,最大表达量约为17.83%(图3c、3d);当诱导温度为25 ℃时,β-catenin表达量在诱导10 h时趋于稳定,最大表达量约为18.41%(图3e、3f)。
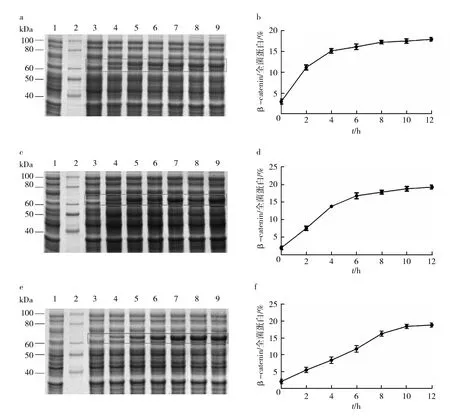
图3 β-catenin诱导时间的优化Fig.3 Determination of an optimal induction length for high yield of β-catenin a、c、e:β-catenin在37、30、25 ℃诱导时间的优化。1: 阴性对照; 2: 蛋白质标准分子质量; 3: 0 h; 4: 2 h; 5: 4 h; 6: 6 h; 7: 8 h; 8: 10 h; 9: 12 h。b、d、f:β-catenin在37、30、25 ℃各诱导时间点的表达量统计分析a,c,e:SDS-PAGE profile of β-catenin expressed at 37, 30 and 25 ℃ for 0-12 h. 1: Negative control; 2: Protein Marker; 3: Total cell proteins (TCP), 0 h; 4: TCP, 2 h; 5: TCP, 4 h; 6: TCP, 6 h; 7: TCP, 8 h; 8: TCP, 10 h; 9: TCP, 12 h. b,d,f:Analysis of prokaryotic expression percentage of β-catenin expressed at 37, 30 and 25 ℃ for 0-12 h
2.4 β-catenin诱导温度的优化
工程菌分别于37 ℃诱导6 h、30 ℃诱导8 h和25 ℃诱导10 h后,裂解菌体,收集上清液和沉淀。SDS-PAGE分析表明,37 ℃诱导6 h时,β-catenin大部分以包涵体形式存在,上清液中β-catenin含量较少;30 ℃诱导8 h时,β-catenin包涵体表达量略有减少,上清液中β-catenin量略有增多;25 ℃诱导10 h时,β-catenin包涵体表达量最少,上清液中β-catenin量最多,β-catenin以胞内可溶形式表达(图4)。
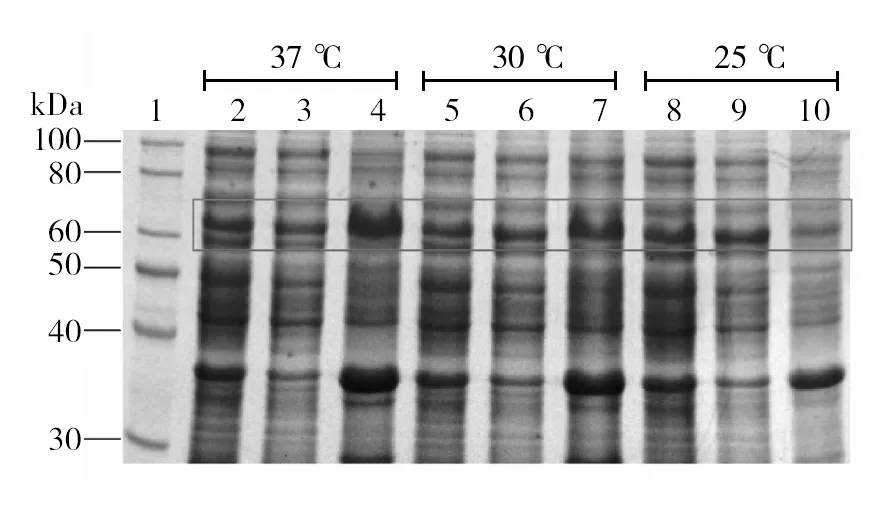
图4 β-catenin诱导温度的优化Fig.4 Determination of an optimal induction temperature for high yield of β-catenin 1: 蛋白质标准分子质量; 2: 全菌蛋白(37 ℃); 3: 上清液(37 ℃); 4: 沉淀(37 ℃); 5: 全菌蛋白(30 ℃); 6:上清液(30 ℃); 7: 沉淀(30 ℃); 8: 全菌蛋白(25 ℃); 9: 上清液(25 ℃); 10: 沉淀(25 ℃)1: Protein Marker; 2: TCP (37 ℃); 3: Supernatant (37 ℃); 4: Pellet (37 ℃); 5: TCP (30 ℃); 6: Supernatant (30 ℃); 7: Pellet (30 ℃); 8: TCP (25 ℃); 9: Supernatant (25 ℃); 10: Pellet (25 ℃)
2.5 IPTG诱导浓度的优化
工程菌以不同浓度的IPTG于25 ℃诱导10 h,收集等量菌体,以SDS-PAGE和Clinx Image Analysis软件分析β-catenin表达量。实验结果表明,在不同浓度的IPTG诱导条件下,β-catenin表达量基本相同,确定0.2 mmol/L IPTG作为最佳诱导浓度(图5a、5b)。
综上所述,确定诱导温度25 ℃、诱导时间10 h、0.2 mmol/L IPTG作为β-catenin最佳原核表达条件。
2.6 β-catenin分离纯化与鉴定
以25%饱和硫酸铵溶液沉淀菌体裂解上清液,制备β-catenin粗提液,再以HisTrap层析柱分离纯化。SDS-PAGE分析表明,纯化的β-catenin具有较高的纯度,样品均呈单一条带且与预期分子量(66 kDa)一致(图6a)。Western blot实验表明,在预期分子量位置仍可显现特异条带,证实了β-catenin的正确表达(图6b)。纯化的β-catenin以BCA法定量,其浓度为1.0 mg/mL。
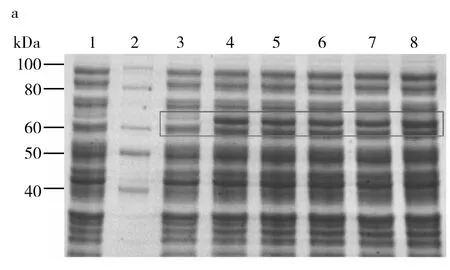
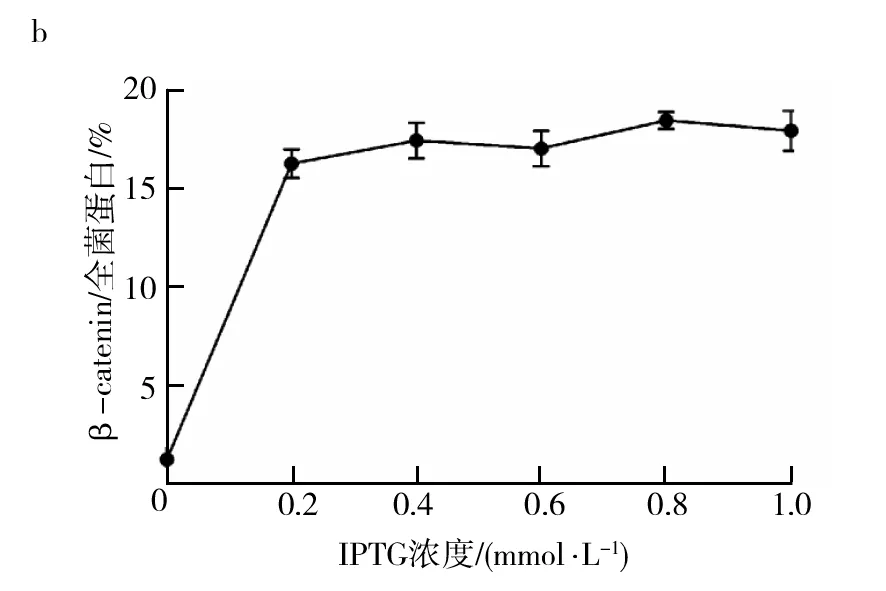
图5 IPTG诱导浓度的优化Fig.5 Determination of an optimal IPTG concentration for high yield of β-catenina:IPTG诱导浓度的优化,1: 阴性对照, 2: 蛋白质标准分子质量, 3: 0 mmol/L IPTG, 4: 0.2 mmol/L IPTG, 5: 0.4 mmol/L IPTG, 6: 0.6 mmol/L IPTG, 7: 0.8 mmol/L IPTG, 8: 1.0 mmol/L IPTG;b:在不同IPTG诱导浓度条件下β-catenin表达量的定量分析a:SDS-PAGE profile of β-catenin expressed in different IPTG concentrations at 25 ℃ for 10 h,1: Negative control,2: Protein Marker; 3: 0 mmol/L IPTG, 4: 0.2 mmol/L IPTG, 5: 0.4 mmol/L IPTG, 6: 0.6 mmol/L IPTG, 7: 0.8 mmol/L IPTG, 8: 1.0 mmol/L IPTG; b:Analysis of prokaryotic expression percentage of β-catenin expressed in different IPTG concentrations at 25 ℃ for 10 h
2.7 β-catenin生物学活性鉴定
肿瘤细胞内,Wnt/β-catenin信号通路主要通过β-catenin/Lef1相互作用形成转录调控元件,进而启动大量原癌基因的转录与表达,调控肿瘤细胞的生长与分化[1,16]。根据β-catenin/Lef1相互作用的结构生物学信息,将FITC-Lef1作为β-catenin结合蛋白的模拟物[17],以荧光偏振实验检测β-catenin与FITC-Lef1的特异性结合反应。实验表明,β-catenin/FITC-Lef1相互作用具有明显的量效关系,结合反应解离常数Kd值为55 nmol/L(图7a)。以GST-Lef1作为β-catenin结合蛋白,ELISA实验表明,β-catenin与GST-Lef1的结合反应也具有良好的浓度依赖性(图7b)。上述结果表明,纯化的β-catenin能与FITC-Lef1和GST-Lef1发生特异性结合反应,说明纯化的β-catenin具有良好的生物学活性。
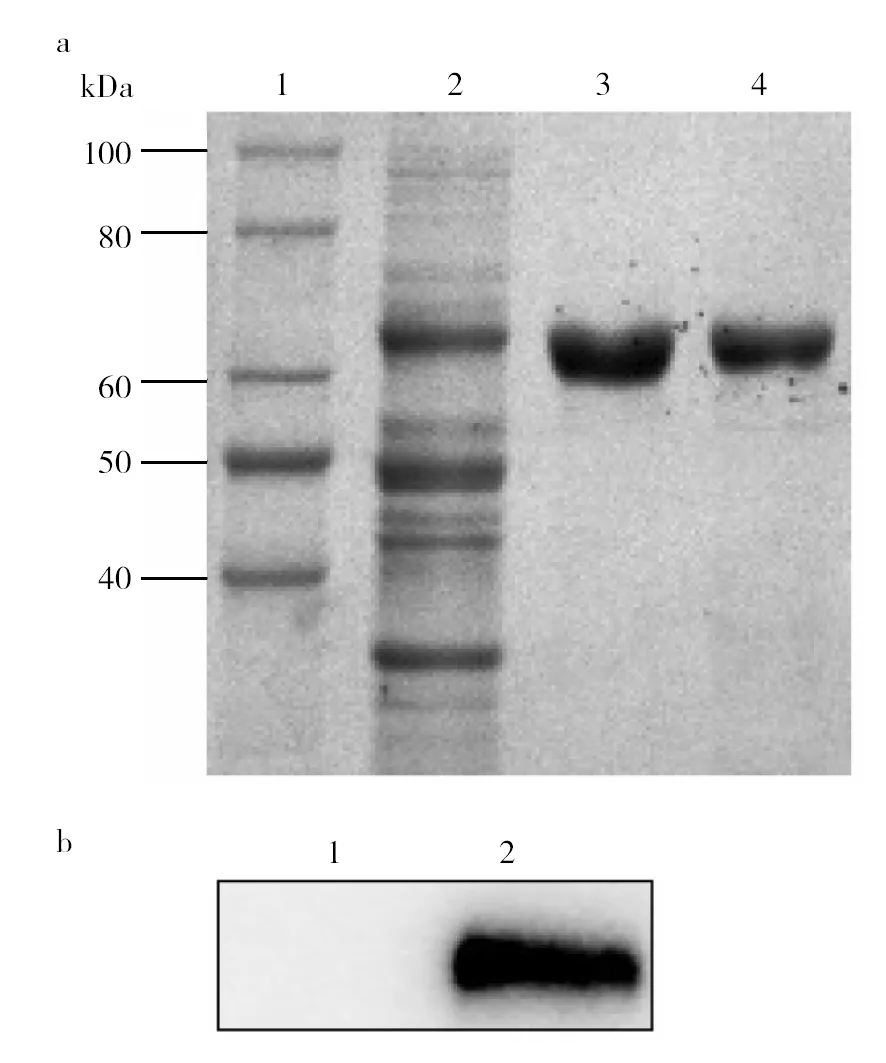
图6 β-catenin的分离纯化与鉴定Fig.6 Purification and identification of β-catenina:β-catenin的分离纯化, 1: 蛋白质标准分子质量, 2: 25%饱和硫酸铵粗提液,3~4: 纯化的β-catenin;b: Western blot实验鉴定β-catenin, 1: 蛋白质标准分子质量, 2: β-catenin条带(66 kDa)a: Purification of β-catenin by HisTrap, 1: Protein Maker, 2: Precipitated β-catenin by 25% saturated ammonium sulfate solution, 3-4: Purified β-catenin (66 kDa);b:Identification of purified β-catenin by Western blot analysis, 1: Protein Marker, 2: β-catenin band (66 kDa)
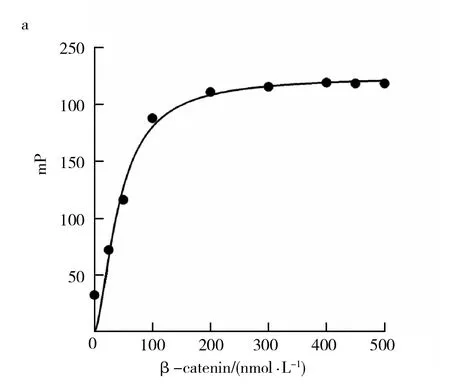
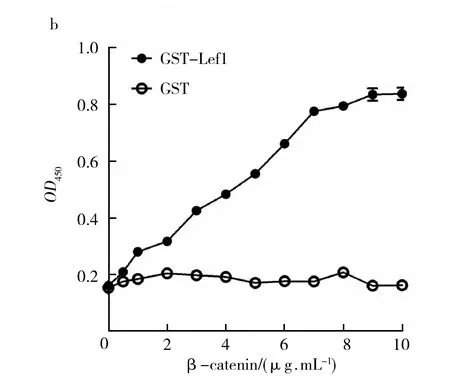
图7 β-catenin生物学活性鉴定Fig.7 Biological activity identification of purified β-catenina:荧光偏振实验检测β-catenin与FITC-Lef1的结合反应; b:ELISA实验检测β-catenin与GST-Lef1的结合反应a:Analysis of specific binding between β-catenin and FITC-Lef1 using fluorescence polarization assay; b:Analysis of specific binding between β-catenin and GST-Lef1 using ELISA assay
3 讨 论
大肠埃希菌原核表达系统具有操作简单、表达量高、成本廉价等诸多优点,已成为重组蛋白制备的首选表达方案[18]。由于外源蛋白融合分子量较小的His标签后,极大地方便了重组蛋白的纯化与检测[19]。故本研究在β-catenin基因片段的N端和C端融合了pET-30a(+)载体的His标签,成功进行了β-catenin核心结构域的原核表达与活性鉴定。建立的β-catenin原核表达方法与已报道的GST-β-catenin-His双标签融合表达策略相比[20-21],具有良好的简便性,不但无需繁琐的GST标签酶切和再纯化操作,经原核表达优化后β-catenin还具有更高的产量和生物学活性。
原核表达优化的主要目的是在低成本的实验室条件下,尽可能提高外源蛋白产量。鉴于诱导时间、诱导温度与IPTG诱导浓度是影响外源蛋白表达的重要因素[22-24],进行了β-catenin原核表达优化实验。结果表明,诱导温度是影响β-catenin原核表达的重要参数。37 ℃和30 ℃诱导培养时,β-catenin在上清液中含量较少,易于形成包涵体,这可能与高温导致目的蛋白快速表达而无法正确折叠有关;25 ℃诱导培养时,β-catenin包涵体含量明显减少,大部分以可溶形式表达,这可能与低温促进目的蛋白的正确折叠和增加可溶性有关[22]。大肠埃希菌在低温培养条件下生长缓慢,一般通过延长诱导时间以增加目的蛋白的表达量。工程菌在25 ℃诱导培养时,β-catenin表达量随着诱导时间的不断延长而逐渐升高,在诱导10 h左右,基本达到表达量高峰,故确定25 ℃诱导10 h作为β-catenin最佳表达条件。另外,IPTG对β-catenin原核表达的诱导效率很高,0.2 mmol/L IPTG即可达到良好的诱导效果。
Wnt/β-catenin信号通路是调控肿瘤细胞生长增殖的关键信号通路,该信号通路的高度活化主要基于β-catenin/Lef1相互作用形成转录调控元件,进而启动大量原癌基因的转录与表达[1,16]。因此,β-catenin与Lef1的体外高亲和力相互作用是评价其生物学活性的核心指标之一。荧光偏振技术主要基于偏振荧光的强弱程度与荧光分子的大小呈正相关的原理,被广泛应用于药物高通量筛选、生物大分子活性分析及疾病诊断[13,15,25-28]。只有当分子量较大的β-catenin和分子量较小FITC-Lef1发生高特异性结合反应时,由于复合物的分子量将增大,激发时分子旋转速度较慢,荧光偏振检测则表现较高的mP值;如果未有特异性结合反应的发生,由于FITC-Lef1的分子量较小,激发时分子旋转速度较快,那么发射光将发生去偏振化,荧光偏振检测则表现较低的mP值。在荧光偏振实验中,将FITC-Lef1作为β-catenin结合蛋白的模拟物[17],在溶液环境中检测β-catenin与FITC-Lef1的特异性结合反应,真实地反应了生命环境中β-catenin与Lef1相互作用的亲和力(Kd=55 nmol/L)。但FITC-Lef1作为一条短肽,还不足以完全模拟生物大分子Lef1的真实理化性质和空间结构。故利用包被GST-Lef1的ELISA实验,在固相环境中再次确证了β-catenin能与GST-Lef1蛋白发生特异性结合反应。上述实验说明,纯化的β-catenin具有良好的生物学活性。
本研究成功进行了β-catenin原核表达条件的优化与生物学活性鉴定,为进一步研究β-catenin在肿瘤免疫抵抗中的生物学功能提供了参考。
致谢衷心感谢中国科学院大学存济医学院袁莉教授、军事科学院军事医学研究院十一所生物技术应用研究室副主任岳玉环研究员和中国医学科学院药物研究所天然药物活性物质与功能国家重点实验室李霓副研究员在β-catenin原核表达和活性鉴定方面给予的悉心指导和无私帮助!
——一道江苏高考题的奥秘解读和拓展

