虾青素补充与急性大强度运动对机体Nrf2抗氧化通路影响的研究
郭新明 吴丽君 赵静 王僮

摘 要:目的:探究蝦青素及急性大强度运动对机体抗氧化应激通路的影响。方法:将32只7周龄雄性SD大鼠适应性饲养5天后分为4组,分别为:对照组(C组),单纯给药组(M组),单纯运动组(E组),运动加给药组(EM组)。M、EM两组以25 mg/kg/d的剂量灌胃虾青素溶液4周,C、E两组灌胃同体积大豆油。分组第1天大鼠进行适应性运动训练,分组后第20天进行递增负荷运动测试,测得大鼠平均力竭速度为21 m/min(75%VO2max),第28天E、EM两组进行最终的一次性大强度运动。运动后即刻处死大鼠取血液及腓肠肌,分别测定各组大鼠血液中SOD、MDA和GSH水平,腓肠肌Akt、Nrf2、HO-1的mRNA表达水平以及p-Akt、Nrf2、HO-1的相对蛋白表达量(/β-actin)。结果:1)安静状态下,M组血清SOD活性高于C组、MDA含量低于C组(P<0.01);分子水平上,M组HO-1的mRNA表达量明显高于C组(P<0.05),p-Akt、HO-1相对表达量也显著高于C组(P<0.01)。2)急性大强度运动后即刻,E组SOD、MDA水平均显著高于C组(P<0.01),GSH水平显著低于C组(P<0.01);E组Nrf2相对蛋白表达量显著低于C组(P<0.01)。EM组血清中MDA水平显著低于E组(P<0.01),HO-1mRNA表达量显著高于E组(P<0.05),p-Akt、Nrf2、HO-1相对蛋白表达量均显著高于E组(P<0.05)。结论:急性大强度运动导致大鼠机体产生氧化应激的同时,可明显降低骨骼肌抗氧化通路关键蛋白Nrf2的相对蛋白表达,也对抗氧化酶具有刺激作用。虾青素可激活急性大强度运动大鼠骨骼肌Akt、Nrf2表达,提高下游HO-1的表达量从而有效抑制大强度运动导致的氧化应激。
关键词:虾青素;急性大强度运动;Nrf2通路;氧化应激
中图分类号:G804.2 文献标识码:A 文章编号:1006-2076(2020)06-0111-08
Abstract: Objective: To investigate the effects of astaxanthin and acute high-intensity exercise on antioxidant stress pathways. Methods: After 5 days of adaptive feeding, 32 male SD rats aged 7 weeks were divided into 4 groups: control group (C), simple administration group (M), simple exercise group (E), and exercise plus administration group (EM). The M and EM groups were given astaxanthin solution at a dose of 25 mg/kg/d for 4 weeks, and the C and E groups were given the same volume of soybean oil. On the first day of the grouping, the rats were trained with adaptive exercise, and on the 20th day after the grouping, the rats were tested with increasing load. The average exhaustion speed of the rats was measured as 21m/min (75%VO2max), and on the 28th day, the E and EM groups were given the final one-time high-intensity exercise. Immediately after exercise, the rats were sacrificed to take blood and gastrocnemius muscle, and the levels of SOD, MDA and GSH in the blood, mRNA expression levels of Akt, Nrf2 and Ho-1 in the gastrocnemius muscle, and relative protein expression levels (/β-actin) of P-Akt, Nrf2 and Ho-1 in the gastrocnemius muscle were determined. Results: In the quiet state, the activity of SOD in group M was higher than that in group C, and the content of MDA was lower than that in group C (P<0.01); At the molecular level, the mRNA expression of HO-1 in group M was significantly higher than that in group C (P<0.05), the relative expression levels of P-Akt and HO-1 were also significantly higher than those of group C (P<0.01). The level of SOD and MDA in group E was significantly higher than that in group C (P<0.01); GSH level was significantly lower than that of group C (P<0.01); The relative protein expression of Nrf2 in group E was significantly lower than that in group C (P<0.01). The serum MDA level in EM group was significantly lower than that in E group (P<0.01); Ho-1 mRNA expression was significantly higher than that of group E (P<0.05). The relative protein expression levels of p-Akt, Nrf2 and HO-1 were significantly higher than those of group E (P<0.05). Conclusion: When acute high-intensity exercise causes the body to produce oxidative stress, it can significantly reduce the relative protein expression of Nrf2, a key protein in antioxidant pathway, and also has stimulation effect against oxidase. Astaxanthin can activate the expression of Akt and Nrf2 in skeletal muscle of rats with acute intense exercise, and increase the expression of HO-1 in the downstream, thus effectively inhibiting the oxidative stress caused by intense exercise.
Key words: astaxanthin; acute high-intensity exercise; Nrf2 pathway; oxidative stress
机体在正常新陈代谢过程中会产生一定量自由基,其中约95%为氧自由基(ROS),它们在细胞内通常可被抗氧化防御系统清除[1]。但是,ROS超量产生、抗氧化体系过负荷将导致机体发生生理病理损伤,被称为氧化应激[2]。目前,氧化应激被认为是导致衰老和多种疾病的重要原因之一。疲劳运动及大强度运动过程中骨骼肌细胞能量需求旺盛、代谢速率加快,机体缺氧及线粒体耗氧量增加导致骨骼肌细胞产生超量ROS[3],因此这些运动被认为是诱导机体氧化应激的原因之一。
虾青素(Astaxanthin)是一种来自海洋生物的抗氧化剂[4-5],其抗氧化活性是叶黄素、番茄红素和β-胡萝卜素等其他类胡萝卜素的10倍,是α-生育酚的100倍[6],具有延缓衰老、增强免疫力;调节血脂、预防心脑血管疾病;保护神经、肝肾及抗肿瘤等多种作用。在运动领域,它具有抗氧化、改善机体物质代谢、提高运动耐力、缓解运动疲劳等功效,是近年来的研究热点之一[7]。
核因子E2相关因子2(Nrf2)是机体抗氧化应激通路的主要靶点,氧化应激发生后,Nrf2被转运至细胞核并与抗氧化反应元件(ARE)结合,以启动抗氧化基因的转录和相应蛋白质的后续表达[8-10]。近年来,在运动人体科学领域有学者针对抗氧化与Nrf2相关通路展开了研究,但研究结果并不丰富。
天然抗氧化剂虾青素应用于医疗、食品、化妆品及养殖业等领域的研究已有广泛报道,但在运动领域其对运动机体产生抗氧化作用的分子机制仍不十分清晰。因此,本研究采用急性大强度运动诱导机体发生氧化应激,探讨虾青素对运动诱导氧化应激保护的相关分子机制,以期为虾青素在运动领域的应用提供依据。
1 对象与方法
1.1 研究对象
选用7周龄体重180~200 g雄性SD大鼠32只,适应性饲养5天后随机分为4组,每组8只,分别为:对照组(C组),单纯给药组(M组),单纯运动组(E组),运动加给药组(EM组)。
1.2 药物干预及运动方案
喂药方案:M组、EM组连续灌胃含天然虾青素豆油28天,虾青素含量为25 mg/kg/d[11](虾青素购于湖北雅仕达生物技术有限公司),C组、E组灌胃相同体积豆油作为对照。
运动方案:大鼠在具有电刺激功能的三跑道大鼠跑台上进行运动。分组后第1天,E组、EM组大鼠进行运动强度为3 m/min运动5 min的适应性运动。一周后进行实验运动强度预适应,适应性运动方案为以初始速度3 m/min运动3 min,间隔一分钟后速度增加3 m/min,依次递增,直至力竭。力竭标准为大鼠受电击后跑动,三秒内腹部贴地回到跑台最后端,重复5次[12]。实验结束前一周再次进行递增负荷运动测试,得到大鼠平均力竭速度为21 m/min(75%VO2max)[13]。休息7天后,E、EM兩组进行最终的大强度运动。根据递增负荷测试结果,把E组、EM组大鼠最终跑台运动试验方案确定为:跑台坡度为-10°,速度为24 m/min,每组运动时间为5 min,每组间歇1 min,每只大鼠运动8组[14]。
1.3 样本采集及保存
大鼠饲养4周称重后,C、M两组断头处死股动脉取血、剥离腓肠肌;E、EM两组大鼠运动后即刻进行同样样本采集。剥离出的腓肠肌经生理盐水清洗后分装,置于液氮迅速冷冻,之后放入-80℃冰箱保存待测。真空采血管从大鼠股动脉取血3~5 ml,室温静置3 min,3000 rpm离心15 min,分离血清后分装并保存于-80℃冰箱待测。
1.4 试剂及检测方法
1.4.1 试剂
丙二醛(MDA)试剂盒;超氧化物歧化酶(SOD)试剂盒;RNA提取试剂盒(Transzol up);cDNA转录试剂盒;Tip Green qPCR Super Mix;小鼠单抗β-actin(42KD)1∶500;兔多抗Nrf2(C-20)(100KD)1∶500;小鼠单抗AKT-Phospho-S473(60KD)1∶4000;兔多抗HO-1/HMOX1(33KD)1∶1000。
1.4.2 RT-PCR检测mRNA表达量
使用反转录试剂盒进行反转录后,再扩增进行RT-PCR,所用引物如表1。
1.4.3 Western Blot检测蛋白表达
取150 mg大鼠腓肠肌匀浆后加入裂解液充分裂解后进行离心(4℃下12 000 rpm离心5 min),取上清分装于0.5 ml离心管中并置于-20℃保存。用BCA试剂盒测定蛋白浓度并进行浓度定量。
以40 μg总蛋白上样进行SDS-PAGE电泳,转膜、封闭过夜后转入PVDF膜上。加Nrf2抗体(1∶500)、p-Akt抗体(1∶1000)及HO-1抗体(1∶4000)、β-actin抗体(1∶500)4 ℃孵育过夜。加羊抗鼠IgG-Biotin(1∶1000)孵育50 min,经PBST 洗膜后加ECL化学发光底物于膜上,5 min后置于转移膜上进行曝光、显影、定影,采用凝胶成像系统对FLK-1或BFGF与β-actin蛋白条带的灰度扫描并用比值表示。
进行SDS-PAGE电泳,转膜(电流14 V,100 Ma,转印2 h)、封闭过夜后转入PVDF膜上。加FLK-1、BFGF抗体(均为1∶1000)、β-actin抗体(1∶500)4 ℃孵育过夜。加羊抗鼠IgG-Biotin(1∶5000)孵育2 h,经PBST 洗膜后加ECL化学发光底物于膜上,5 min后置于转移膜上,用X光胶片压片后依次放入显影液显影、定影液定影,冲洗胶片。晾干胶片,扫描胶片,采用IPP分析胶片灰度值。
1.5 数据统计与分析
实验数据均用“平均数±标准差”表示,组间差异使用单因素方差分析(One way ANOVA)方法进行检验,用LSD方法检验方差齐性。实验结果中的图表使用Microsoft Excel、SPASS24.0以及Graphpad prism6进行统计分析,P<0.05为有显著性差异,P<0.01为有极显著性差异。
2 实验结果
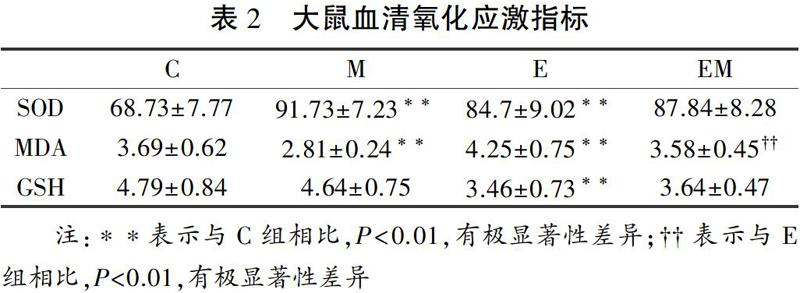
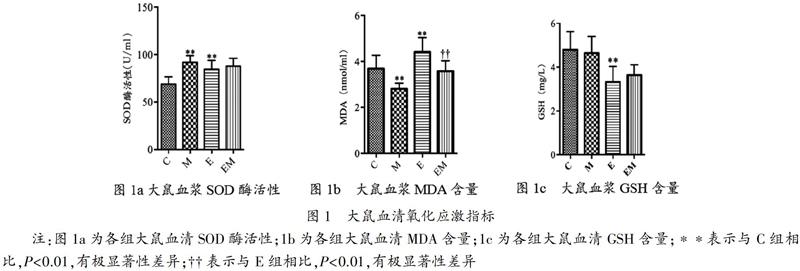
2.1 各组大鼠血液氧化应激水平的变化
安静状态下,与C组相比M组SOD活性显著升高(P<0.01,表2,图1a),MDA含量显著降低(P<0.01,表2,图1b),GSH水平无明显变化(表2,图1c)。说明安静状态下,虾青素补充可提高血清中抗氧化酶SOD活性,减少脂质过氧化。运动后即刻,E组血清SOD酶活性及MDA含量均显著高于C组(P<0.01,表2,图1a、1b), GSH活性显著低于C组(P<0.01,表2,图1c), 表明急性大强度运动对大鼠血清SOD、GSH及MDA都有显著影响,可提高SOD酶活性、消耗GSH并导致氧化应激。运动后即刻,EM组大鼠血清中MDA含量显著低于E组(P<0.01,表2,图1b)。可见,中等剂量补充虾青素4周可以明显缓解急性大强度运动导致的脂质过氧化。
2.2 各组大鼠腓肠肌RT-PCR检测结果
各组大鼠腓肠肌细胞RT- PCR实验结果见图2。与C组相比,M、E两组Akt及Nrf2表达量均无显著性差异(图2a,2b),但M组HO-1基因表达量显著升高(P<0.05,图2c)。与E组相比,EM组HO-1相对基因表达量也显著升高(P<0.05,图2c)。这表明补充虾青素可促进大鼠腓肠肌中抗氧化酶HO-1基因表达。
2.3 各组大鼠腓肠肌Western Blot检测结果
对大鼠腓肠肌蛋白进行Western Blot实验,电泳结果见图3。结果显示,安静状态下M组大鼠腓肠肌Akt磷酸化水平极显著高于C组(P<0.01);急性大强度运动后E组大鼠腓肠肌Akt磷酸化水平降低但未达到统计学水平;与E组相比,EM组Akt磷酸化水平显著升高(P<0.05)。这表明补充虾青素可提高安静状态下及运动后大鼠骨骼肌中Akt的磷酸化水平(图3b)。
M组大鼠腓肠肌中Nrf2相对蛋白表达量与C组相比略有升高,但差异不显著;E组大鼠在运动后即刻腓肠肌中Nrf2相对蛋白表达量显著下降(P<0.01);EM组大鼠腓肠肌中Nrf2相对蛋白表达与E组相比显著升高(P<0.05)。可见,急性大强度运动可降低大鼠腓肠肌Nrf2相对蛋白表达量,而补充虾青素则可以明显提高急性大强度运动后大鼠骨骼肌中Nrf2蛋白表达水平(图3c)。
M组大鼠腓肠肌中HO-1蛋白表达量高于C组,差异非常显著(P<0.01);E组大鼠腓肠肌中HO-1蛋白表达量相比于C组有所降低,但差异不显著;EM组大鼠腓肠肌中HO-1蛋白表达量显著高于E组(P<0.05)。这表明补充虾青素可提高安静状态下及运动后大鼠腓肠肌中HO-1蛋白表达(图3d)。
3 分析与讨论
3.1 急性大强度运动对大鼠机体抗氧化机能的影响
研究表明,急性大强度运动使骨骼肌内产生大量自由基,破坏了其氧化还原平衡从而导致氧化应激产生[15-16]。
SOD被誉为机体抗氧化的第一道防线,可催化两分子超氧阴离子(-O2)歧化为过氧化氢(H2O2)和氧气(O2),从而使超氧阴离子的危害性大大降低[17]。SOD的活性越高,机体抗氧化能力越强。大强度运动会使机体在短时间内产生大量氧自由基(ROS),ROS作为信号分子刺激SOD活性急剧升高,因此短时间内SOD的活性随ROS的增加而上升[18]。Nogueira等研究表明,大鼠连续30 min进行80%VO2max运动后血液中SOD活性极显著升高[19]。Roh等人的研究同样显示,健康男性进行急性间歇性大强度运动后,ROS水平及SOD活性极显著升高[20]。本研究中,大鼠进行急性大强度运动后血清SOD活性极显著高于C组,表明本实验运动强度引起机体发生强烈氧化应激,刺激SOD活性增强。
丙二醛(MDA)是ROS引起的脂质过氧化的主要产物,MDA含量增多往往被视为是机体氧化应激的标志。急性大强度运动导致的MDA水平升高主要发生在血液、骨骼肌和肝脏等器官和组织[21-22]。Lovlin等人最早发表关于MDA与运动引起ROS升高具有相关性的报道[23]。Sureda等人证实,成年女性自行车运动员高强度运动至力竭后,血液中MDA含量极显著高于运动前[24]。同时也有研究证明,中小强度运动会降低大鼠血清MDA含量,而运动强度大于70%VO2max时MDA水平显著升高[25-26]。Quindry等人的研究也证实了这一观点,并且他们发现并提出之前关于血液MDA含量与运动强度无关的研究可能是受限于当时的检测手段比较落后[27-28]。Belviranli等人的实验也证实了这一看法[18, 26, 29]。本研究中E组血清MDA含量显著升高(P<0.01)再次说明运动大鼠机体发生强烈氧化應激。
谷胱甘肽(GSH)在抵抗脂质过氧化过程中发挥重要作用,尤其是对剧烈运动引起的脂质过氧化。此外,GSH在体内还有其他多种作用,如:氧化还原信号转导的调节,半胱氨酸的储存和运输,细胞的增殖调节及免疫应答调节,前列腺素代谢等[30]。有研究表明,ROS升高后需要消耗大量GSH来清除,因此急性大强度运动引起ROS上升导致机体出现氧化应激的同时往往伴随着GSH含量降低,GSH氧化水平极显著升高[31]。Altinoz等人的研究证明,大鼠进行急性游泳运动后即刻血液中GSH含量显著下降[29]。Kerksick的研究也表明,长时间大强度运动后即刻,血清中谷胱甘肽的总水平显著上升,其中氧化型谷胱甘肽(GSSG)水平显著上升,GSH水平显著下降[32]。本研究中,E组大鼠血清GSH含量显著低于C组,说明急性大强度运动导致大鼠机体进入氧化应激状态,体内GSH大量消耗。
核因子E2相关因子2(Nrf2)是表现机体抗氧化能力的转录因子。氧化应激发生后,Nrf2被转运至细胞核并与抗氧化反应元件(ARE)结合,以启动抗氧化基因的转录和相应蛋白质的后续表达。有研究表明,经过4周强度为70%VO2max的有氧训练后,大鼠骨骼肌中Nrf2的mRNA表达量及蛋白表达量显著升高[33],而一次性游泳至力竭的大鼠心肌中Nrf2蛋白表达量显著降低[34]。还有研究表明,4周高强度间歇运动大鼠骨骼肌组织中 Nrf2 、SOD、GSH-PX 和 CAT 的蛋白水平显著升高,表明高强度间歇运动可通过激活 Nrf2/ARE 信号通路来提高机体抗氧化能力并减弱氧化应激损伤[35]。刘永敬等研究表明,Nrf2 敲除导致了大鼠骨骼肌中抗氧化酶的抑制及 ROS 的过量累积,从而造成了骨骼肌损伤并降低了运动能力;低氧运动可通过上调 Nrf2 的表达,进而激活 HIF-1α 及抗氧化酶活性,从而提高运动能力,并防止骨骼肌损伤[36]。本研究中,E组大鼠运动后即刻,骨骼肌中Nrf2/β-actin的相对蛋白表达量极显著下降(P<0.01)。p-Akt以及HO-1的相对蛋白表达量和Akt、Nrf2及HO-1的mRNA表达量均未见显著差异。说明急性大强度运动对Akt磷酸化、HO-1的蛋白表达量及Akt、Nrf2以及HO-1基因表达量影响并不显著,主要对抗氧化通路关键蛋白Nrf2发生作用,可明显降低其相对蛋白表达量,这可能是急性大强度运动导致机体氧化应激的主要原因。
3.2 补充虾青素对大鼠机体抗氧化机能的影响
虾青素是一种叶黄素类胡萝卜素,具有极强的抗氧化及抗炎活性[4, 37]。它可通过诱导超氧化物歧化酶(SOD)的表达以及淋巴细胞瘤-2基因和细胞凋亡相关基因Bax表达,在1-甲基- 4-苯基吡啶离子(MPP +)诱导的培养细胞中显示出抗氧化和抗凋亡作用[38];还可以增加脂肪酸转位酶(FAT / CD36)与肉碱-棕榈酰转移酶I(CPT I)的共定位,并阻止运动中CPT I的氧化修饰,更有利于脂肪的转运[39]。在6-羟基多巴胺处理的人骨髓神经母细胞瘤细胞(SH-SY5Y)中,虾青素补充能显著抑制细胞凋亡、线粒体异常和细胞内ROS的产生[40]。
有研究表明,大鼠每天以≥ 20 mg/kg的剂量补充虾青素,抵抗氧化应激效果更为明显,可以使安静状态下大鼠血浆中的SOD等抗氧化酶活性提高、MDA水平降低,但其作用机制尚不清楚[41-42]。补充虾青素可以使处于氧化应激状态下大鼠不同组织都产生相似变化即:SOD显著增加,MDA显著减少[43-45]。本研究中补充虾青素组大鼠SOD酶活性极显著高于对照组大鼠(P<0.01),MDA水平极显著低于对照组(P<0.01),与前人的研究结果一致。
有研究指出,安静状态下补充虾青素是通过使机体产生少量ROS刺激SOD、谷胱甘肽过氧化物酶(GSH-Px)等抗氧化酶活性增高同时刺激细胞中Nrf2/ HO-1抗氧化系统,使Nrf2以及HO-1表达量上升[42]。Zhu等人的研究表明,补充抗氧化剂可通过PI3K- Akt通路激活Nrf2进而发挥作用[46]。补充抗氧化剂17 β-estradiol (βE2)后,SD大鼠视网膜中Nrf2的mRNA表达量以及蛋白活性显著升高,同时显著降低了ROS水平。然而,分别用PI3K- Akt特异性抑制剂LY294002或ICI182780进行预处理,可显著抑制βE2对于Nrf2的有益作用。Li等人的研究也表明,以上理论同样适用于虾青素,补充虾青素有助于减少H2O2干预下细胞的氧化应激状态,刺激Nrf2的表达,提高Nrf2与ARE的结合活性,并且在添加PI3K- Akt通路抑制剂后,Nrf2的表达量及活性显著降低[47]。Li的研究也有类似结果,虾青素对视网膜和神经节细胞的保护作用随Nrf2基因敲除而降低[48]。上述研究均表明抗氧化剂主要通过Nrf2发挥作用,而PI3K- Akt可能是调节Nrf2的主要途径之一。
本研究中,M组相对于C组p-Akt相对蛋白表达量极显著升高(P<0.01),Nrf2相对蛋白表达量有所上升,SOD活性显著升高(P<0.01),HO-1mRNA表达量(P<0.05)及相对蛋白表达量均显著上升(P<0.01),与前人的研究结果相类似,表明安静状态下补充虾青素可以通过Akt信号通路激活Nrf2,从而提高下游抗氧化酶活性、提高机体抗氧化能力。
3.3 补充虾青素对急性大强度运动大鼠机体抗氧化机能的影响
Fan等人研究表明,补充虾青素可以提高急性运动时骨骼肌内SOD、GSH-Px等抗氧化酶的活性,同时降低MDA含量,从而抑制运动导致的骨骼肌损伤,且每日补充虾青素量越大,对骨骼肌的保护作用越明显[49]。Guo等人的研究表明,长期补充虾青素可以缓解运动后机体的氧化应激状况,MDA含量显著低于单纯运动组、SOD活性增高[50]。Liu等研究表明,虾青素补充与运动训练相结合的方式,可以明显改善参加运动老年人肌肉的运动强度和运动能力[51]。Aoi等研究表明,ASTA还可以在运动过程中提高脂质作为能量底物的利用率来缓解运动导致的疲劳[39]。不仅如此,补充虾青素还可以减轻运动导致的骨骼肌和心肌损伤,减少运动引起的延迟性肌肉酸痛[52-53]。本研究中,EM组MDA水平显著低于E组,表明补充虾青素可以有效降低大强度运动导致的脂质过氧化。
有研究证明,连续6周每天补充虾青素20 mg/kg,在大强度运动后即刻,补充虾青素组大鼠心肌中Nrf2及HO-1的蛋白含量顯著高于单纯运动组,心肌细胞凋亡显著低于单纯运动组[50]。说明虾青素可以作用于运动机体的Nrf2信号通路,提高其下游HO-1的表达,从而降低6周大强度运动引起的大鼠心肌过氧化和心肌细胞凋亡[50]。李锋等研究表明补充虾青素可以介导Nrf2通路,上调Nrf2、p-Nrf2、HO-1的蛋白表达,提高抗氧化酶SOD和T-AOC的活性,进而缓解6周大强度运动训练诱导的大鼠肾脏细胞氧化应激和过度凋亡,保护肾脏结构和功能正常[54]。本研究中EM组大鼠腓肠肌中HO-1的mRNA表达量显著高于E组,且EM组大鼠p-Akt、Nrf2及HO-1的相对蛋白表达量(/β- actin)均显著高于E组,说明中等剂量补充虾青素4周可激活骨骼肌Akt、Nrf2,提高下游抗氧化酶HO-1的表达量,显著提高急性大强度运动大鼠骨骼肌的抗氧化能力。以上研究均表明虾青素可作用于机体Nrf2信号通路,对大强度运动机体的骨骼肌、心肌和肾脏等器官起到保护作用。
[14]BEDFORD T G, TIPTON C M, WILSON N C, et al. Maximum oxygen consumption of rats and its changes with various experimental procedures[J]. Journal of applied physiology:respiratory, environmental and exercise physiology, 1979,47(6):1278-1283.
[15]PEAKE J, SUZUKI K. Neutrophil activation, antioxidant supplements and exercise-induced oxidative stress[J]. Exercise immunology review, 2004(10):129-141.
[16]KELKAR G, SUBHADRA K, CHENGAPPA R K. Effect of Antioxidant Supplementation on Hematological Parameters, Oxidative Stress and Performance of Indian Athletes[J]. Journal of Human Ecology, 2008, 24(3):209-213.
[17]IGHODARO O M, AKINLOYE O A. First line defence antioxidants-superoxide dismutase (SOD), catalase (CAT) and glutathione peroxidase (GPX):Their fundamental role in the entire antioxidant defence grid[J]. Alexandria Journal of Medicine, 2018,54(4):287-293.
[18]GüL I, GKBEL H, BELVIRANLI M, et al. Oxidative stress and antioxidant defense in plasma after repeated bouts of supramaximal exercise:the effect of coenzyme Q10[J]. J Sports Med Phys Fitness, 2011,51(2):305-312.
[19]NOGUEIRA J E, PASSAGLIA P, MOTA C M D, et al. Molecular hydrogen reduces acute exercise-induced inflammatory and oxidative stress status[J]. Free radical biology & medicine, 2018(129):186-193.
[20]ROH H T, CHO S Y, SO W Y. Obesity promotes oxidative stress and exacerbates blood-brain barrier disruption after high-intensity exercise[J]. Journal of sport and health science, 2017, 6 (2):225-230.
[21]DEMINICE R, JORDAO A A. Creatine supplementation reduces oxidative stress biomarkers after acute exercise in rats[J]. Amino Acids, 2012,43(2):709-715.
[22]李彤. 元寶枫油对一次性力竭运动大鼠氧化应激和炎症反应的影响[J]. 重庆医学, 2017, 46(22):3043-3045.
[23]LOVLIN R,COTTLE W,PYKE I,et al.Are indices of free radical damage related to exercise intensity[J].European journal of applied physiology and occupational physiology,1987,56(3):313-316.
[24]SUREDA A, TAULER P, AGUILó A, et al. Relation between oxidative stress markers and antioxidant endogenous defences during exhaustive exercise[J]. Free radical research, 2005, 39(12):1317-1324.
[25]KACZOR J J,HALL J E,PAYNE E,et al.Low intensity training decreases markers of oxidative stress in skeletal muscle of mdx mice[J].Free radical biology & medicine,2007,43(1):145-154.
[26]BELVIRANL M, GKBEL H, OKUDAN N, et al. Effects of grape seed extract supplementation on exercise-induced oxidative stress in rats[J]. The British journal of nutrition, 2012, 108(2):249-256.
[27]QUINDRY J C, STONE W L, KING J, et al. The effects of acute exercise on neutrophils and plasma oxidative stress[J]. Med Sci Sports Exerc, 2003, 35(7):1139-1145.
[28]ASHTON T, YOUNG I S, PETERS J R, et al. Electron spin resonance spectroscopy, exercise, and oxidative stress:an ascorbic acid intervention study[J]. Journal of applied physiology(Bethesda, Md :1985), 1999, 87(6):2032-2036.
[29]ALTINOZ E, OZMEN T, ONER Z, et al. Effect of crocin on oxidative stress in recovery from single bout of swimming exercise in rats[J]. General physiology and biophysics, 2016, 35(1):87-94.
[30]SEN C K. Glutathione homeostasis in response to exercise training and nutritional supplements[J]. Molecular and cellular biochemistry, 1999, 196(1/2):31-42.
[31]LEE J, CLARKSON P M. Plasma creatine kinase activity and glutathione after eccentric exercise[J]. Med Sci Sports Exerc, 2003, 35(6):930-936.
[32]KERKSICK C, WILLOUGHBY D. The antioxidant role of glutathione and N-acetyl-cysteine supplements and exercise-induced oxidative stress[J]. Journal of the International Society of Sports Nutrition, 2005, 2(2):38-44.
[33]何詩依. Nrf2在有氧运动训练中对小鼠骨骼肌抗氧化能力的作用[J]. 北京体育大学学报, 2017, 40(12):50-54.
[34]曹志永. 运动预适应通过调节Nrf2/Keap1通路发挥对力竭大鼠心脏的保护作用[J]. 中国分子心脏病学杂志, 2019, 19(4):3010-3014.
[35]王蒙,张海峰.高强度间歇运动通过调控 Nrf2/ARE 和NF-κB 信号通路调节高脂饮食诱导肥胖大鼠的氧化应激和炎症反应[J]. 基因组学与应用生物学,2020,39(5):2324-2331.
[36]刘永敬, 杜洁. 低氧运动对 Nrf2 基因敲除大鼠运动能力和氧化应激的影响[J]. 基因组学与应用生物学,2020,39(1):365-370.
[37]PASHKOW F J, WATUMULL D G, CAMPBELL C L. Astaxanthin:a novel potential treatment for oxidative stress and inflammation in cardiovascular disease[J]. Am J Cardiol, 2008, 101(10a):58d-68d.
[38]LEE D H, KIM C S, LEE Y J. Astaxanthin protects against MPTP/MPP+-induced mitochondrial dysfunction and ROS production in vivo and in vitro[J]. Food and chemical toxicology :an international journal published for the British Industrial Biological Research Association, 2011, 49(1):271-280.
[39]AOI W, NAITO Y, TAKANAMI Y, et al. Astaxanthin improves muscle lipid metabolism in exercise via inhibitory effect of oxidative CPT I modification[J]. Biochem Biophys Res Commun, 2008, 366(4):892-897.
[40]LIU X, SHIBATA T, HISAKA S, et al. Astaxanthin inhibits reactive oxygen species-mediated cellular toxicity in dopaminergic SH-SY5Y cells via mitochondria-targeted protective mechanism[J]. Brain research, 2009(1254):18-27.
[41]WU D, XU H, CHEN J, et al. Effects of Astaxanthin Supplementation on Oxidative Stress[J]. International journal for vitamin and nutrition research Internationale Zeitschrift fur Vitamin- und Ernahrungsforschung Journal international de vitaminologie et de nutrition, 2020, 90(1/2):179-194.
[42]NIU T, XUAN R, JIANG L, et al. Astaxanthin Induces the Nrf2/HO-1 Antioxidant Pathway in Human Umbilical Vein Endothelial Cells by Generating Trace Amounts of ROS[J]. J Agric Food Chem, 2018, 66(6):1551-1559.
[43]YANG M, CHEN Y, ZHAO T, et al. Effect of astaxanthin on metabolic cataract in rats with type 1 diabetes mellitus[J]. Experimental and molecular pathology, 2020(113):104372.
[44]KIM S H, LIM J W, KIM H. Astaxanthin Prevents Decreases in Superoxide Dismutase 2 Level and Superoxide Dismutase Activity in Helicobacter pylori-infected Gastric Epithelial Cells[J]. Journal of cancer prevention, 2019, 24(1):54-58.
[45]Z. Z, MIN W, L. H, et al. Astaxanthin alleviates lipopolysaccharide-induced acute liver injury of mice[J]. Journal of South China Agricultural University, 2019, 40(1):40-45.
[46]ZHU C, WANG S, WANG B, et al. 17β-Estradiol up-regulates Nrf2 via PI3K/AKT and estrogen receptor signaling pathways to suppress light-induced degeneration in rat retina[J]. Neuroscience, 2015(304):328-339.
[47]LI Z, DONG X, LIU H, et al. Astaxanthin protects ARPE-19 cells from oxidative stress via upregulation of Nrf2-regulated phase II enzymes through activation of PI3K/Akt[J]. Molecular vision, 2013(19):1656-1666.
[48]Li Yan,Wang Qiang,Chu Cuiying,Liu Shu. Astaxanthin protects retinal ganglion cells from acute glaucoma via the Nrf2/HO-1 pathway[J]. Journal of Chemical Neuroanatomy,2020,110:1-8.
[49]Fan Gao-Xiang. Protective effects of Astaxanthin on exercise-induced oxidative damage in rats[J]. AGRO FOOD INDUSTRY HI-TECH, 2017, 28(2):73-76.
[50]GUO X, CAO J, WANG Y, et al. PL-011 astaxanthin reduces high intensity training induced myocardial cell apoptosis via activating Nrf2 in rats[J]. Exercise Biochemistry Review, 2018, 1(1):PL011.
[51]LIU S Z, ALI A S, CAMPBELL M D, et al. Building strength, endurance, and mobility using an astaxanthin formulation with functional training in elderly[J]. J Cachexia Sarcopenia Muscle, 2018, 9(5):826-833.
[52]AOI W, NAITO Y, SAKUMA K, et al. Astaxanthin limits exercise-induced skeletal and cardiac muscle damage in mice[J]. Antioxid Redox Signal, 2003, 5(1):139-144.
[53]BROWN D R, GOUGH L A, DEB S K, et al. Astaxanthin in Exercise Metabolism, Performance and Recovery:A Review[J]. Front Nutr, 2017(4):76.
[54]李鋒,曹卉,曹建民.虾青素介导Nrf2信号通路对大强度运动诱导大鼠肾脏损伤的保护作用[J].山东体育学院学报,2020,36(2):71-78.

