保肾通络方对高糖培养下肾小球系膜细胞外基质增生及外泌体miR-192表达的影响
崔方强 王悦芬 高彦彬 江心灿 赵文景
(首都医科大学附属北京中医医院肾病科,北京 100010)
糖尿病肾病(diabetic nephropathy,DN)是临床常见的糖尿病并发症之一,其发病率逐年升高,已经成为终末期肾病的主要原因[1]。DN的发病机制十分复杂,至今尚未完全阐明,有研究认为肾小球系膜细胞过度增殖及细胞外基质增生是DN早期特征性的病理改变[2]。而系膜细胞外泌体miR-192在系膜细胞肥大及细胞外基质增生方面发挥着重要作用[3],还会通过自分泌或旁分泌途径影响系膜细胞及足细胞,进而介导系膜细胞及足细胞损伤[4]。因此,系膜细胞外泌体miR-192水平异常被认为是导致DN进展的重要病理机制。保肾通络方是我们临床治疗DN的经验方,临床研究已经证实其对DN具有很好的治疗效果,可明显降低患者蛋白尿水平,改善肾功能[5]。同时,前期实验研究也证实,保肾通络方可以有效减轻DN小鼠足细胞损伤,改善肾脏病理表现[6]。为进一步探讨保肾通络方治疗DN的作用机制,我们拟通过观察其对高糖培养下肾小球系膜细胞基质增生及外泌体miR-192表达的影响,结果如下。
1 材料与方法
1.1 实验动物及细胞
1.1.1 实验动物 清洁级SD大鼠20只,8周龄,体质量(203.28±14.67)g,由北京华阜康生物科技股份有限公司提供,实验动物许可证号:SCXK(京)2014-0004。
1.1.2 实验细胞 永生化小鼠肾小球系膜细胞,由中国科学院上海生命科学研究院细胞资源中心提供,批号:SV40 MES 13。
1.2 实验药物 保肾通络方颗粒剂,主要由黄芪、熟地黄、菟丝子、刘寄奴、鬼箭羽、水蛭及丹参组成,由首都医科大学附属北京中医医院药剂科制备,每1 g颗粒剂含4.01 g生药。
1.3 主要试剂及仪器 小鼠胶原蛋白Ⅳ(Collagen Ⅳ)抗体、纤维连接蛋白(FN)抗体(英国Abcam公司);细胞增殖活性检测CCK-8试剂盒(上海碧云天生物技术有限公司);异硫氰酸荧光素(FITC)标记的羊抗小鼠免疫球蛋白G(IgG)(江苏凯基生物技术股份有限公司);外泌体提取试剂盒(美国System Biosciences公司);Trizol总RNA抽提试剂盒 (美国Invitrogen公司);M-MLV逆转录酶[宝生物工程(大连)有限公司];HPX-9162MBE电热恒温培养箱(上海博迅医疗生物仪器股份有限公司);3K18高速离心机(德国Sigma公司);ZS-3板式酶标仪(北京市新风机电技术公司);Fusion FX6-XT凝胶化学发光成像分析系统(法国Vilber公司);迷你双垂直电泳槽、迷你转印电泳槽(北京六一生物科技有限公司);PRISM 7700实时荧光定量聚合酶链式反应(Real-time PCR)仪(美国ABI公司);倒置显微镜、激光扫描共聚焦显微镜(德国Leica公司)。
1.4 含药血清制备 将20只SD大鼠随机分为正常对照组、保肾通络方低剂量组、保肾通络方中剂量组及保肾通络方高剂量组,每组5只。保肾通络方低、中、高剂量组大鼠分别予浓度为0.5、1.0、2.0 g/mL的保肾通络方颗粒剂药液灌胃,每次灌胃2 mL,每日2次。正常对照组大鼠予等容积蒸馏水灌胃。各组大鼠连续灌胃7 d,末次灌胃后1 h待血药浓度稳定后,通过腹主动脉取血,分离血清,然后将血清56 ℃水浴30 min,最后采用无菌滤器过滤除菌,-80 ℃保存。
1.5 细胞分组及给药方法
1.5.1 细胞分组 将永生化小鼠肾小球系膜细胞分为正常对照组、高糖对照组、保肾通络方低剂量组、保肾通络方中剂量组及保肾通络方高剂量组。
1.5.2 给药方法 将肾小球系膜细胞放入恒温培养箱中静止培养(37 ℃,5%二氧化碳),待其生长至80%融合并且生长状态良好时,进行干预给药。正常对照组细胞予DMEM低糖培养基+正常对照组大鼠血清培养,高糖对照组细胞予含30 mmol/L葡萄糖的高糖培养基+正常对照组大鼠血清培养,保肾通络方低、中、高剂量组细胞分别予高糖培养基+10%的保肾通络方低、中、高剂量含药血清培养。
1.6 检测指标及方法
1.6.1 细胞增殖活性CCK-8检测 首先按照1.5.1中的细胞分组方法将永生化小鼠肾小球系膜细胞分为5组,并制成细胞悬液种植于96孔板中,每组设3个复孔,并设空白对照组,保证每孔的细胞数目一致。然后按1.5.2给药方法分别对5组细胞进行干预培养,空白对照组只加等量培养基,培养24 h后对各组细胞进行增殖活性CCK-8检测。向每个孔板加入10 μL的CCK-8溶液,在37 ℃下孵育2 h,然后将96孔板放入酶标仪内,在540 nm条件下检测各组光密度(OD)值,并对细胞增殖活性进行比较。细胞增殖活性=(加药细胞OD值/空白对照组细胞OD值)×100%。
1.6.2 免疫荧光检测 首先按照1.5.1中的细胞分组方法将永生化小鼠肾小球系膜细胞分为5组,将消毒好的玻片放入12孔板,每组设3个复孔,然后将各组细胞分别种植于玻片,保证每孔的细胞数目一致。然后按1.5.2给药方法分别对5组细胞进行干预培养,培养24 h后对各组细胞外基质蛋白Collagen Ⅳ及FN表达情况进行免疫荧光检测。加入4%多聚甲醛进行固定,透膜后,加入一定浓度的一抗(Collagen Ⅳ 1∶500,FN 1∶500),4 ℃孵育过夜,然后加入相应的二抗,37 ℃孵育2 h,DAPI细胞核染色后,甘油封片,在激光扫描共聚焦显微镜下观察Collagen Ⅳ及FN表达情况,每组随机选取15个视野,采用配套的图像处理软件计算荧光强度,并对灰度值进行比较。
1.6.3 Real-time PCR检测 先按照1.5.1细胞分组方法将永生化小鼠肾小球系膜细胞分为5组,然后按1.5.2给药方法分别对5组细胞进行常规干预培养,每组设3个复孔,培养24 h后对各组细胞Collagen Ⅳ、FN及外泌体miR-192的mRNA表达情况进行检测。首先将细胞培养液进行收集,离心机3 000 r/min离心15 min,去除细胞和细胞碎片,将上清液移入10 mL无菌离心管,在上清液中加入适量的外泌体提取试剂,混匀后4 ℃过夜(至少12 h),在1 500 r/min离心30 min,并吸出上清液,然后用1 500 r/min离心法将沉淀离心5 min,吸弃上清液,沉淀即为外泌体。然后对肾小球系膜细胞及收集的外泌体总RNA进行提取,向样本中加入5 mL的Trizol,室温放置5 min,然后加入0.2 mL氯仿,震荡混匀,保存5~10 min,离心后取出最上层,依次加入预冷异丙醇、75%焦碳酸二乙酯(DEPC)乙醇,离心后,去除乙醇,加入DEPC处理过的水溶解沉淀。最后用反转录试剂盒将mRNA转录为cDNA,Real-time PCR仪进行扩增及荧光定量。β-actin为内参基因。采用 2-△△CT法进行Collagen Ⅳ、FN及外泌体miR-192 mRNA表达的相对定量分析。每个基因重复3次,利用Primer 5.0软件设计引物序列,见表1。

表1 引物序列
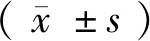
2 结 果
2.1 各组小鼠肾小球系膜细胞增殖活性比较 见表2。
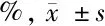

组 别n细胞增殖活性(%)正常对照组3100.00±2.02高糖对照组3210.87±21.29∗保肾通络方低剂量组3164.28±19.76△保肾通络方中剂量组3152.39±13.28△保肾通络方高剂量组3139.87±14.95△
与正常对照组比较,*P<0.05;与高糖对照组比较,△P<0.05
由表2可见,与正常对照组比较,高糖对照组细胞增殖活性升高,比较差异有统计学意义(P<0.05)。与高糖对照组比较,保肾通络方低、中、高剂量组细胞增殖活性均降低,比较差异均有统计学意义(P<0.05)。保肾通络方低、中、高剂量组组间细胞增殖活性比较差异均无统计学意义(P>0.05)。
2.2 各组小鼠肾小球系膜细胞Collagen Ⅳ及FN表达的灰度值比较 见表3。
由表3可见,与正常对照组比较,高糖对照组Collagen Ⅳ及FN灰度值均升高,比较差异均有统计学意义(P<0.05)。与高糖对照组比较,保肾通络方低、中、高剂量组Collagen Ⅳ及FN灰度值均降低,比较差异均有统计学意义(P<0.05)。保肾通络方低、中、高剂量组组间Collagen Ⅳ及FN灰度值比较差异均无统计学意义(P>0.05)。
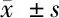

组 别nCollagen Ⅳ灰度值FN灰度值正常对照组1560.12±12.4363.34±16.45高糖对照组152 143.87±24.59∗265.43±26.42∗保肾通络方低剂量组15154.39±20.17△178.67±19.74△保肾通络方中剂量组15132.99±21.38△154.84±22.37△保肾通络方高剂量组15112.63±19.07△138.79±21.05△
与正常对照组比较,*P<0.05;与高糖对照组比较,△P<0.05
2.3 各组小鼠肾小球系膜细胞Collagen Ⅳ、FN及外泌体miR-192的mRNA表达水平比较 见表4。
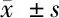
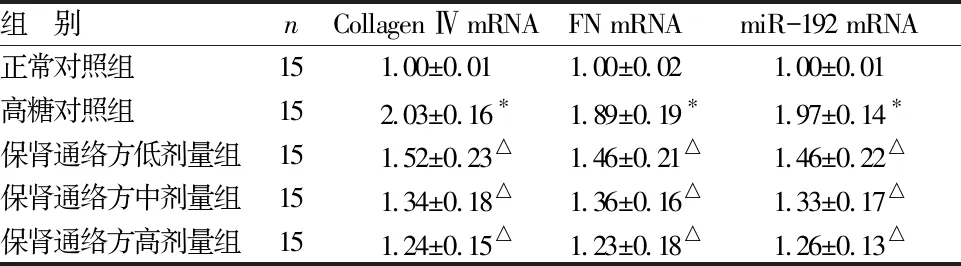
组 别nCollagen Ⅳ mRNAFN mRNAmiR-192 mRNA正常对照组151.00±0.011.00±0.021.00±0.01高糖对照组152.03±0.16∗1.89±0.19∗1.97±0.14∗保肾通络方低剂量组151.52±0.23△1.46±0.21△1.46±0.22△保肾通络方中剂量组151.34±0.18△1.36±0.16△1.33±0.17△保肾通络方高剂量组151.24±0.15△1.23±0.18△1.26±0.13△
与正常对照组比较,*P<0.05;与高糖对照组比较,△P<0.05
由表4可见,与正常对照组比较,高糖对照组Collagen Ⅳ、FN及外泌体miR-192的mRNA表达均上调,比较差异均有统计学意义(P<0.05)。与高糖对照组比较,保肾通络方低、中、高剂量组Collagen Ⅳ、FN及外泌体miR-192的mRNA表达均下调,比较差异均有统计学意义(P<0.05)。保肾通络方低、中、高剂量组组间Collagen Ⅳ、FN及外泌体miR-192的mRNA表达组间比较差异均无统计学意义(P>0.05)。
3 讨 论
近年来,随着糖尿病发病率的不断升高,DN的发病率也逐年增加,且DN的病情发展往往非常迅速,患者一旦出现肾功能异常,将会很快进入终末期肾病阶段,对患者的生命健康造成严重威胁[7-8]。DN早期的病理改变主要为肾小球肥大、系膜细胞增殖、细胞外基质增生及基底膜增厚等。临床治疗主要以积极控制血糖、血压,早期使用血管紧张素转化酶抑制剂(ACEI)或血管紧张素受体拮抗剂(ARB)类药物为主,但并不能完全阻断疾病的进展[9]。研究表明,高血糖可刺激并介导肾小球系膜细胞的活化,促使系膜细胞分泌细胞外基质增多,这也是DN蛋白尿产生及肾小球硬化的重要病理机制[10-11]。Collagen Ⅳ及FN是细胞外基质中的主要成分。Collagen Ⅳ是一种基膜胶原,是肾小球细胞外基质的主要成分,并在系膜细胞间相互交叉呈网状结构[12]。FN作为一种大分子糖蛋白,在细胞外基质中相互交叉,形成网络,可为其他细胞外基质成分沉积提供支架[13]。Collagen Ⅳ及FN水平升高,可明显促进肾组织纤维化[14]。外泌体是一种机体细胞分泌的具有脂质双层膜的微小膜泡,其作为细胞间通讯的媒介,在细胞稳态、生理学和病理生物学等许多方面都发挥着至关重要的作用[15]。有研究表明,DN肾小球系膜细胞外泌体miR-192的表达明显上调,而系膜细胞异常分泌的外泌体可以进入足细胞并引起足细胞损伤。因此,外泌体miR-192表达异常,进而介导系膜细胞活化及足细胞损伤也可能是DN重要的病理机制,而抑制系膜细胞活化,并调控外泌体miR-192的表达可有效延缓DN病情进展[16-17]。本研究结果也显示,与正常对照组比较,高糖对照组采用高糖培养基培养后系膜细胞增殖活性明显升高(P<0.05),Collagen Ⅳ及FN的表达均明显增多(P<0.05),Collagen Ⅳ、FN及外泌体miR-192的mRNA表达水平均明显上调(P<0.05)。
DN属于中医学水肿、尿浊、关格等范畴,为本虚标实之证,不同的医家对DN的病因病机进行了不同的阐述。吕仁和等[18]认为,DN主要是由于消渴治不得法,伤阴耗气,痰浊瘀血互相胶结,积聚于肾络,形成微型癥瘕导致,并提出了“微型癥瘕”的病机学说。南征教授则认为,消渴病久者,必然本体大伤,久病致络病瘀血,血瘀痰生,热结毒生,毒伤肾络,肾络瘀塞,不能蒸化水液,水液潴留,进一步发展为DN,并提出了“毒损肾络”的病机学说[19]。我们认为,DN初期多为气阴两虚,阴虚燥热,继而出现气血凝滞,络脉闭阻,日久耗伤肾之气精,导致肾失封藏,精微下泄,“肾气不足,肾精亏虚,肾失封藏,肾络闭阻”是DN发病的核心病机,治宜补肾活血通络。保肾通络方方中熟地黄补肾填精;黄芪健脾益气;菟丝子滋补肝肾,固精缩尿;刘寄奴、鬼箭羽活血祛瘀通经;丹参祛瘀生新,活血调经;水蛭破血利水,达到血行则水行之效。诸药合用,共奏益肾填精、活血通络之功。本研究结果显示,与高糖对照组比较,保肾通络方低、中、高剂量组含药血清细胞增殖活性明显受到了一定程度的抑制,均明显降低(P<0.05),Collagen Ⅳ及FN的表达均明显减少(P<0.05),Collagen Ⅳ、FN及外泌体miR-192的mRNA表达水平均明显下调(P<0.05),但保肾通络方不同剂量组组间比较差异均无统计学意义(P>0.05)。
前期研究表明保通络方对DN模型小鼠足细胞有保护作用[6],并能有效阻止蛋白尿的发生,延缓疾病进展[20]。本研究结果表明,保肾通络方还可以降低DN肾小球系膜细胞增殖活性,抑制细胞外基质增生,减少Collagen Ⅳ及FN蛋白的表达,并且能够下调Collagen Ⅳ、FN及外泌体miR-192 mRNA的表达,从多途径对DN进行干预治疗。综上所述,保肾通络方对DN的防治具有多靶点效应。

