红火蚁巢穴土壤中生物碱成分分析
李晓玲, 陈 立, 方守国
(1. 长江大学农学院, 湖北荆州 434025; 2. 中国科学院动物研究所, 农业虫害鼠害综合治理研究国家重点实验室, 北京100101)
红火蚁Solenopsisinvicta是一种社会性昆虫,在土壤中建立巢穴,巢穴高度可达30~40 cm (Vinson, 1997)。蚁后产卵、哺育幼虫、化蛹、羽化、贮存粮食及种群活动等行为均发生在地下巢穴中。蚁巢不仅保护蚁群不受入侵者的侵害,还提供了一个对蚁群生存至关重要的微气候调节系统(Hölldobler and Wilson, 1990)。蚂蚁的筑巢、觅食活动能造成土壤结构改变和养分积累,进而改变土壤的物理性质和营养状况(Lafleuretal., 2005)。除了土壤的物理性质如渗透和滤出特性的改变(Greenetal., 1998),红火蚁的建巢活动还会改变土壤的化学性质,如元素富集(Herzogetal., 1976)。蚁巢是蚂蚁活动的中心场所,蚁群活动也可以将自身的一些化学物质带入巢内土壤中:一方面红火蚁会主动将代谢产物排泄到蚁巢土壤中,另一方面红火蚁和土壤的频繁接触也会使体表化合物等次生代谢物被动地进入蚁巢土壤中。例如,Vander Meer和Lofgren (1988) 在红火蚁巢穴土壤中发现了红火蚁表皮烃类化合物。
Chen等(2009)利用正己烷浸提红火蚁工蚁,用GC-MS鉴定红火蚁毒液生物碱的主要成分是2-甲基-6-烷基哌啶生物碱混合物:2-甲基-6-十三碳烯基-6-哌啶(C13∶1),2-甲基-6-十三烷基-6-哌啶(C13∶0),2-甲基-6-十五碳烯基-6-哌啶(C15∶1),2-甲基-6-十五烷基-6-哌啶(C15∶0),2-甲基-6-十七碳烯基-6-哌啶(C17∶1)以及2-甲基-6-十七烷基-6-哌啶(C17∶0)。一头红火蚁工蚁的毒囊中含有约10~15 μg的毒液,所以每个蚁巢都拥有大量的毒液生物碱(Storeyetal., 1991)。红火蚁利用毒液进行防御和杀死猎物(Vander Meeretal., 1980)。红火蚁极具攻击性,一旦不小心触碰其巢穴,就会有大批红火蚁出来进行攻击。在攻击过程中,红火蚁会释放出大量的毒液,每头工蚁每次通过毒针释放大约0.66 nL毒液,约占其毒液总含量的3.1% (Haight and Tschinkel, 2003)。红火蚁栖息于真菌、细菌等微生物较丰富的巢穴环境中(Torsvik and Ovreas, 2002),易受多种真菌和细菌性病原体的侵染(Allen and Buren, 1974; Evans, 1982)。为了抵御病原菌浸染,红火蚁和其他社会性昆虫一样,会在24 h内将包括蚂蚁尸体在内的杂物清除出巢穴(Wilson, 1971)。这样感染真菌的尸体在产孢前被清除,就能有效地阻止分生孢子在蚁巢内的传播。在实验室给红火蚁种群接种白僵菌后,工蚁会在真菌孢子形成之前将蚂蚁尸体集中到蚁巢的一个角落(Storeyetal., 1991)。并且工蚁还用沙子覆盖尸体,从而限制了分生孢子的扩散。除了行为反应外,红火蚁还会产生具有显著抗菌活性的毒液生物碱(Blumetal., 1958; Jouvenazetal., 1972; Blum, 1988)。红火蚁会在巢穴内表面分泌毒液生物碱,对其生活环境和幼虫体表等进行消毒(Obin and Vander Meer, 1985);通过腹部快速振动向入侵者喷射毒液滴(Obin and Vander Meer, 1985; Storeyetal., 1991)。所以蚁巢土壤和蚂蚁身上可能存在高浓度的生物碱,并发挥抗菌、抑菌作用。
关于土壤中生物碱类化合物提取方法的研究比较多,比如用四氢呋喃∶水∶乙腈∶乙酸(50∶30∶20∶1, v/v)混合溶剂提取土壤中的α-茄碱(Jensenetal., 2007);用正己烷∶丙酮 (3∶1, v/v) 混合溶剂提取土壤中的咔唑类污染物(Mumboetal., 2015);用含硫酸镁和氯化钠的乙腈提取土壤中的阿托品和莨菪碱(Bothetal., 2017);用甲醇∶甲醇(85∶15, v/v)分步提取土壤中的吡咯西啶类生物碱(Hama and Strobel, 2019);用1.5 mol/L氢氧化钠溶液碱化土壤后,接着用氯化正丁酯提取土壤中的马钱子碱(Starretal., 1995, 1996);先用1 mol/L氢氧化钠溶液调整乙醇的pH值到8~9,再用碱性乙醇提取土壤中的苦参碱(郝佳等, 2016)等。土壤pH值影响土壤对生物碱的吸附能力,比如随着土壤pH值升高,吸附马钱子碱的能力增强(Kookanaetal., 1997)。红火蚁毒液呈弱碱性,而我国南方土壤主要呈酸性(杨志元, 2016),毒液生物碱与土壤中的酸性物质结合形成不溶于有机溶剂的盐,致使无法直接用有机溶剂提取土壤中的生物碱。三乙胺的碱性强于毒液生物碱,可优先与酸性物质反应。利用三乙胺排除酸性物质的影响后,就可以用有机溶剂提取红火蚁巢穴土中的毒液生物碱。
本研究探讨红火蚁巢穴土壤中的毒液生物碱的提取方法,测定红火蚁蚁巢毒液生物碱的含量,研究结果将有助于后期从微生境角度分析红火蚁入侵对土壤生态环境的影响,揭示入侵物种对新入侵地土壤微环境的适应机制等方面的工作。
1 材料与方法
1.1 仪器与试剂
1.1.1土壤样品:采自广州市华南农业大学东校区附近草坪和广州市黄浦区葡萄园附近草坪的红火蚁蚁巢的土壤。蚁巢土壤采集方法:随机选取4个红火蚁蚁巢(各蚁巢之间相距至少5 m),分别挖取蚁巢深度约15 cm处的土壤各约200 g,放置在蚁巢附近,待蚂蚁爬回蚁巢,土壤样品自然风干后,带回实验室。在制样板上碾压土壤颗粒,过2 mm孔径筛,得到直径<2 mm的蚁巢土壤样品,用自封袋封装,备注详细采集信息后,保存于4℃冰箱中。按上述方法采集蚁巢周边3 m处的土壤作为空白对照,并用于毒液添加回收实验。
1.1.2主要仪器:万分之一电子天平(AR224CN)、隔膜真空泵(N820.3FT.18)、旋转蒸发仪(R-3HB)、美国安捷伦公司Agilent Technologies气相色谱仪7890A(GC)、7890A-5975C气相色谱-质谱联用仪(GC-MS)、超声震荡仪(KQ-100E)。
1.1.3主要试剂:HPLC级正己烷(上海安谱实验科技股份有限公司)、二氯甲烷、乙酸乙酯、丙酮、甲醇、三乙胺(均为分析纯,北京市通广精细化工公司)。
1.2 红火蚁毒液生物碱的获取和添加毒液生物碱的土壤样品的制备
称取5.0 g红火蚁工蚁冷冻于-20℃冰箱,1 h后取出,用20 mL正己烷浸泡48 h,取出浸提液,加适量无水硫酸钠干燥12 h后,用氮气浓缩至5 mL,用硅胶柱层析法分离生物碱(Chen and Fadamiro, 2009)。柱层析分离所收集的流分用Agilent 7890A气相色谱仪进行成分分析,最后将收集到的生物碱流分合并,浓缩抽干洗脱溶剂即得红火蚁毒液生物碱样品。用毛细管取极少量毒液生物碱,用正己烷溶解后进行GC-FID分析,以检测其纯度。称取2.0 g蚁巢周边土壤样品于16 mL玻璃样品瓶中,加入40 μL红火蚁毒液生物碱样品,震荡混匀,使毒液与土壤充分混匀,即完成添加毒液生物碱的土壤样品制备。
1.3 GC-FID和GC-MS分析
GC-FID分析:检测器:FID(火焰离子化检测器);色谱柱:HP-5MS毛细管柱,规格30 m×0.32 mm×0.25 μm;进样量:2 μL,无分流进样;进样口温度270 ℃,检测器温度280℃。柱温箱升温程序:起始温度50℃,保持1 min,以5℃/min的速率升至100℃,保持0 min,然后以10℃/min升至240℃,保持10 min。
GC-MS分析:参照Liu等(2017)利用GC-MS鉴定红火蚁毒液生物碱和土壤样品中的生物碱。GC-MS的色谱柱、柱温箱升温程序和进样条件同GC-FID分析。MS的电离方式为EI,电离能量为70 eV,离子源温度为230℃,质量扫描范围50~500 amu。载气为氦气,流速为1 mL/min。
1.4 土壤样品中生物碱提取方法的优化
1.4.1毒液生物碱抽滤提取法:将加入提取溶剂的待测样品常温下浸提8 h后,超声震荡15 min;将超声后的样品用真空泵抽滤得到第1次回收提取液A;将滤渣再次加入等量的溶剂按上述方法提取,并重复3次,依次得到第2次回收提取液B,第3次回收提取液C,第4次回收提取液D;将上述4种提取液分别用旋转蒸发仪浓缩至近干,加入色谱级正己烷定容至1 mL,并过0.45 μm有机滤膜至1.5 mL样品瓶中,用于GC-FID分析。
1.4.2提取溶剂筛选:选择以下5种极性不同的溶剂进行比较,正己烷、二氯甲烷、乙酸乙酯、丙酮和甲醇。取4 mL溶剂加入到1.2节中的土壤样品中,同时分别向样品中添加1 mL三乙胺,利用1.4.1节方法抽滤提取样品中的毒液生物碱。计算不同溶剂处理的毒液总生物碱的回收率,筛选最佳提取溶剂。每种溶剂处理设4个重复。
1.4.3三乙胺添加方法:取4 mL正己烷加入到1.2节中的土壤样品中,同时分别向样品中添加0.125, 0.25, 0.5, 1和2 mL三乙胺,利用1.4.1节方法抽滤提取样品中的毒液生物碱。以合成的顺式2-甲基-6-十一烷基哌啶(cis-C11)为标准品用外标法(黄敏兴等, 2019)定量计算土壤样品中的生物碱含量。计算不同体积的三乙胺处理的毒液生物碱的回收率,筛选出三乙胺的最佳添加体积。实验重复4次。
1.5 红火蚁蚁巢土生物碱测定方法
称取10.0 g蚁巢土壤样品于50 mL离心管中,加入20 mL正己烷和5 mL三乙胺,采用1.4.1节中提取方法提取毒液生物碱,用于GC-FID分析。用外标法进行定量生物碱含量。用合成的cis-C11作为标准品,稀释成3.125~400 ng/μL共8个浓度,制作标准曲线。标准品的浓度(X)与色谱峰面积(Y)通过线性回归分析建立标准曲线。利用标准曲线计算出土壤样品中的生物碱浓度。每个蚁巢土壤样品重复4次。
1.6 数据分析
采用Microsoft Excel 2007及SPSS 20.0进行数据分析,并进行One-way ANOVA统计分析,以Tukey氏HSD进行显著水平检测。
2 结果
2.1 生物碱标准曲线和红火蚁工蚁毒液生物碱成分鉴定
基于生物碱标准品浓度(X)与色谱峰面积(Y)实验数据,通过线性回归建立的生物碱标准曲线为Y=11.476X+8.6009,R2=0.9999(图1),说明3.125~400 ng/μL的浓度范围内线性关系非常好。
红火蚁工蚁体内毒液生物碱提取的气相色谱图显示(图2),红火蚁工蚁毒液生物碱的主要成分为trans-C13∶1 (峰2)、trans-C13 (峰3)、trans-C15∶1(峰4)和trans-C15 (峰5),次要成分为trans-C11 (峰1)。选取其中4种主要成分用于定量分析。
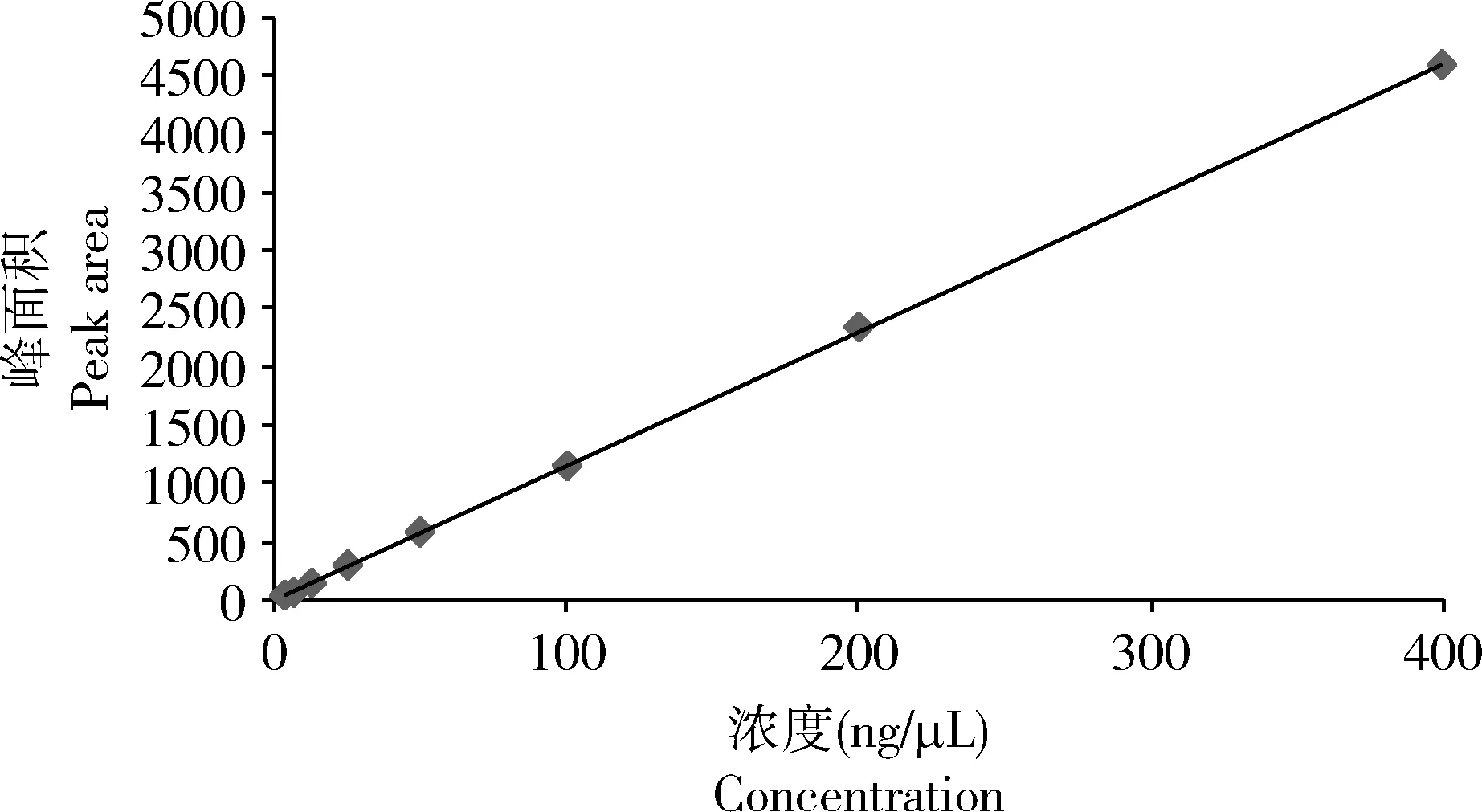
图1 cis-C11标准曲线Fig. 1 The standard curve of cis-C11
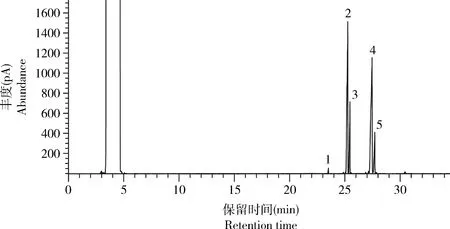
图2 红火蚁工蚁毒液生物碱气相色谱图Fig. 2 Gas chromatogram of venom alkaloids of workers of Solenopsis invicta1: trans-C11; 2: trans-C13∶1; 3: trans-C13; 4: trans-C15∶1; 5: trans-C15.
2.2 生物碱提取方法优化
2.2.1不同有机溶剂对土壤毒液生物碱的提取效率:正己烷、二氯甲烷、乙酸乙酯、丙酮、甲醇等5种不同极性的有机溶剂作为提取溶剂,并添加1 mL三乙胺到土壤样品中,采用抽滤法提取毒液生物碱。正己烷的提取效率最高,生物碱的回收率为65.50%±3.55%;丙酮的提取效率最低,生物碱的回收率为49.73%±3.32%;但不同溶剂处理生物碱回收率在0.05水平上无显著性差异(F4,15=1.407,P=0.279)(图3)。
2.2.2三乙胺的添加量对土壤毒液生物碱的提取回收率的影响:选取正己烷作为提取溶剂,4种毒液生物碱的第1次提取回收率随着三乙胺添加量的增加而提高。当加入三乙胺的量为1 mL时,4种生物碱的提取回收率达到最大,继续增加三乙胺的添加量到2 mL,提取回收率无显著性变化(P>0.05)(图4: A)。
将4次提取所得的提取回收率相加,得到总提取回收率。trans-C13∶1,trans-C13和trans-C15∶1这3种生物碱的总提取回收率没有随着三乙胺添加量的增加而发生显著变化,它们的总提取回收率都集中在55%~70%之间。trans-C15的总提取回收率在0.125 mL时最低,约为52%;而当三乙胺的添加量为0.25 mL及以上时,总提取回收率达到95%~120%之间(图4: B)。
将4种生物碱的含量相加,得到总生物碱的含量。总生物碱的第1次提取回收率随三乙胺量的增加而增加。当三乙胺为1 mL时,总生物碱第一次提取回收率均可达62%~69%。因此可以选取4 mL正己烷+1 mL三乙胺来提取2 g土壤中的毒液生物碱,且只需要进行1~2次提取即可提取到大部分生物碱(表1)。
2.3 蚁巢土壤中生物碱含量
红火蚁蚁巢生物碱种类主要为trans-C13∶1,trans-C13,trans-C15∶1和trans-C15。在4巢土样中,trans-C15∶1含量显著高于其他3种生物碱(P<0.05),含量为10.13±0.51 μg/g;trans-C13∶1的含量次之,为6.24±0.33 μg/g;trans-C13和trans-C15含量最低,分别为3.06±0.20 μg/g和2.85±0.36 μg/g,两者之间没有显著差异(P>0.05)(图5)。蚁巢土壤中的总生物碱含量为22.28±1.13 μg/g。
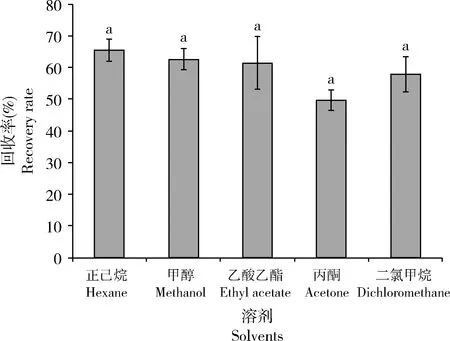
图3 不同溶剂对总生物碱回收率的影响Fig. 3 Effect of different solvents on recovery rate of alkaloids图中数据为平均值±标准误,柱上不同小写字母表示差异显著(P<0.05, Tukey氏HSD检验);图4和5同。Data in the figure are mean±SE. Different lowercase letters above bars indicate significant difference (P<0.05, Tukey’s HSD test). The same for Figs. 4 and 5.

图4 三乙胺添加量对4种生物碱第1次提取回收率(A)和总回收率(B)的影响Fig. 4 Effect of additive amount of triethylamine on the recovery rate of the first extraction (A)and total recovery rate (B) of four alkaloids
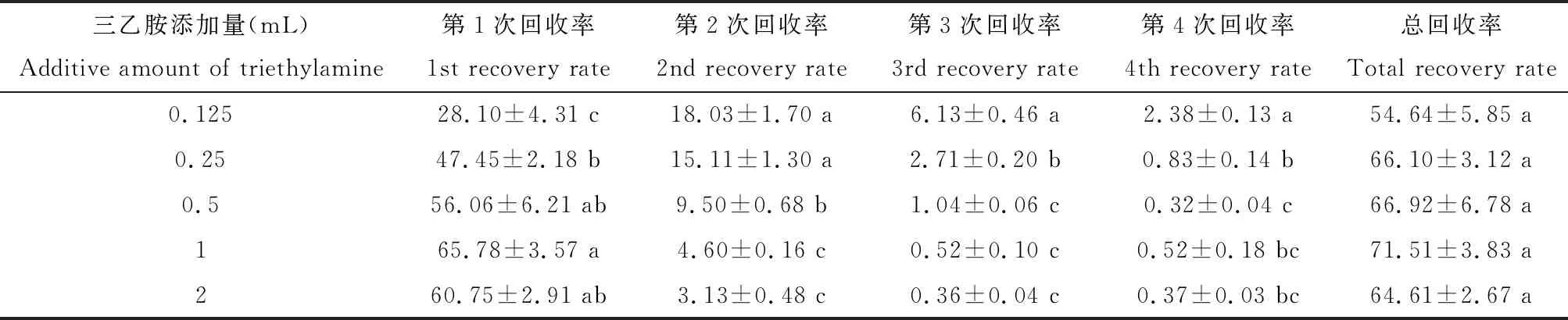
表1 4次三乙胺抽滤提取的总生物碱回收率(%)Table 1 Recovery rate (%) of total alkaloids with four triethylamine extractions
表中数据为平均值±标准误;同列数据后不同小写字母分别表示差异显著(P<0.05, Tukey氏HSD检验)。Data in the table are mean±SE. Different lowercase letters following the data in the same column indicate significant differences (P<0.05, Tukey’s HSD test).
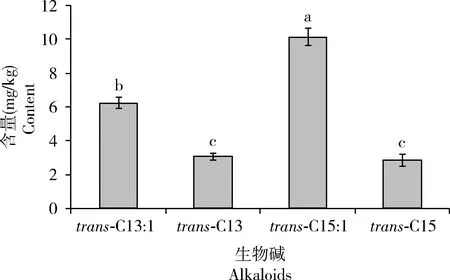
图5 红火蚁巢穴土壤中4种主要生物碱的含量Fig. 5 Contents of four major alkaloids in the soil of Solenopsis invicta nest
3 讨论
生物碱的提取方法主要有超声提取法、双水相萃取法、加速溶剂提取法、半仿生提取法等(张林等, 2017)。我国南方土壤主要呈酸性,而红火蚁毒液生物碱的主要成分呈弱碱性。在添加回收实验时,由于添加的毒液生物碱可能与土壤中的腐殖酸等酸性物质结合,生成不易溶于有机溶剂的盐,导致生物碱提取效率低甚至提取不出来,因此需要在提取溶剂中加入三乙胺。三乙胺的碱性强于毒液生物碱,可以优先与土壤中的酸性物质反应,使土壤中的毒液生物碱呈游离态,很容易用有机溶剂提取出来。我们在比较4次提取的回收率时发现,第1次提取回收率随着三乙胺添加量的增加而提高;当三乙胺的添加量达到1 mL时,通过1次提取就可回收大多数的生物碱。因此,当三乙胺与有机溶剂体积比为1∶4时,通过1~2次提取即可提取到土壤中的大部分生物碱。正己烷、二氯甲烷、乙酸乙酯、丙酮、甲醇等5种不同极性的有机溶剂作为提取溶剂时,提取效果相差不大,说明这5种溶剂都可以用作提取巢穴土壤中生物碱的提取溶剂。但是,丙酮和甲醇的极性、溶解性都比较强,导致土壤中的其他杂质的提取率也比较高,不利于生物碱成分的纯化,而且用丙酮作为溶剂易产生乳化现象。
本研究结果表明,在红火蚁巢穴土壤中,毒液生物碱trans-C13∶1和trans-C15∶1的含量显著高于其他两种生物碱,4次提取实验测得的总生物碱含量大概为22 μg/g;因添加回收实验所得的总生物碱的回收率最高为71.51%,所以蚁巢土壤中总生物碱含量理论值大概为31 μg/g。在采集巢穴土壤样品过程中,不可避免地破坏蚁巢,引起大量工蚁的防御反应,有些工蚁可能会释放毒液到土壤中,使得所测巢穴土壤生物碱含量要高于实际含量。所以综合提取效率和工蚁防御反应这两方面的影响,我们测定的蚁巢土壤生物碱含量可能非常接近其真实值。
红火蚁生物碱具有广泛的杀菌活性,稀释50倍的生物碱能有效地抑制化脓性微球菌Micrococcuspyogenes、化脓性链球菌Streptococcuspyogenes、大肠杆菌Escherichiacoli、干酪乳杆菌Lactobacilluscasei等多种真菌(Blumetal., 1958)。从红火蚁毒液分离出的哌啶和脱氢哌啶类生物碱对终极腐霉Pythiumultimum的菌丝生长有明显的抑制作用,也能抑制其孢子囊的萌发,其中哌啶生物碱的抑菌EC50为17.0 μg/mL,抑制孢子萌发EC50为12.3 μg/mL (Lietal., 2012)。毒液中的哌啶和脱氢哌啶类生物碱还能抑制番茄细菌性溃疡病菌Clavibactermichiganensissubsp.michiganensis的生长,其中哌啶生物碱的抑菌EC50为31.5 μg/mL,且在75.3 μg/mL的浓度下对该菌有完全抑制作用(Lietal., 2013)。合成的哌啶生物碱成分在低浓度下具有抑制多种细菌生长的能力(Urbani and Kannowsk, 1974);对金黄色葡萄球菌Staphylococcusaureus的杀菌浓度为4~12 μg/mL,对大肠杆菌E.coli的杀菌浓度为20~40 μg/mL (Jouvenazetal., 1972)。合成的脱氢哌啶生物碱成分2-甲基-6-十八烷基-Δ1,6-哌啶具有体外抗真菌活性,对新生隐球菌Cryptococcusneoforman的最低抑制浓度为6.6 μg/mL,对白色念珠菌Candidaalbicans的最低抑制浓度为12.4 μg/mL(Yanetal., 2017)。很显然,所测得的蚁巢土壤生物碱含量在抑菌活性浓度范围内。
蚂蚁对土壤微生物群落的影响及蚂蚁与真菌间的关系已成为社会昆虫学家、生态学家的研究热点。蚂蚁巢穴内微生物多样性的研究均显示,蚁巢土壤微生物的丰富度及多样性均高于巢外对照土壤(Dauber and Wolters, 2000; Zettleretal., 2002; Boultonetal., 2003; Bairdetal., 2007)。红火蚁巢穴中的毒液生物碱可能会参与调节蚁巢土壤微生物的丰富度和多样性水平。巢穴土壤中的微生物体系具有重要的化学转化作用,反过来又影响蚂蚁的种群活动。所以可以断言,红火蚁巢穴土壤中的毒液生物碱对红火蚁在新的生境中的定殖和入侵有重要的促进作用。

