药物联合治疗加超选择性肾上腺动脉栓塞术治疗原发性醛固酮增多症1 例分析
陈硕 周锐飞 熊洪亮 董一飞
1 临床资料
患者 男,35岁,主因“反复胸闷、气短、夜间不能平卧5个月”于2018年6月20日收入南昌大学第二附属医院治疗。自诉2018年1月始常于活动后出现胸闷、气短不适,伴大汗淋漓,休息后可缓解,夜间不能平卧,伴咳嗽、咳痰,痰中带血丝,量较多。既往发现血压升高5年余,最高达180/120 mmHg(1 mmHg=0.133 kPa),未予治疗;吸烟10余年,10~20支/d;无高血压病家族史。入院查体:心率102次/分,血压165/122 mmHg,颈静脉充盈,双肺可闻及湿性啰音,心尖搏动位于左锁骨中线外1 cm处,未触及震颤,双下肢重度凹陷性水肿,其余查体未见明显异常。实验室检查示:红细胞计数4.15×1012/L,血红蛋白86 g/L,红细胞平均体积74.5 fl,红细胞平均血红蛋白量20.7 pg;肌酐137 μmol/L,尿酸493.75 μmol/L;N末端B型脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-proBNP)2654 pg/ml(图1),心肌酶、肌钙蛋白未见明显异常。24 h动态血压全天平均值136/80 mmHg(入院后开始服用缬沙坦40 mg、每日3次,图2);24 h动态心电图示:偶发房性早搏,偶伴室内差传,偶发室性早搏(多种形态)。超声心动图示:左心室射血分数(left ventricular ejection fraction,LVEF)34%(图3),左心室舒张末期内径68 mm,左心室收缩末期内径57 mm,左心室肥厚(室间隔厚度12 mm)。X线胸片可见双肺水肿,左心室增大(图4)。肾上腺CT提示:右侧肾上腺腺瘤,左侧正常。2018年6月21日冠状动脉造影正常。
初步诊断:(1)高血压性心脏病:室性早搏,纽约心脏病协会(New York Heart Association,NYHA)心功能Ⅲ级;(2)高血压病3级(很高危);(3)右肾上腺腺瘤;(4)高尿酸血症;(5)贫血。入院后予螺内酯20 mg、每日1次利尿,缬沙坦40 mg、每日3次控制血压、改善心室重构等对症治疗后症状好转。出院后多次门诊随访复查并行药物方案调整:于2018年7月至9月,将沙库巴曲缬沙坦(诺欣妥)剂量从50 mg、每日2次快速滴定到靶剂量200 mg、每日2次;于2018年6月至11月,将琥珀酸美托洛尔(倍他乐克)剂量从25 mg、每日1次滴定到靶剂量200 mg、每日1次;螺内酯保持20 mg、每日1次(图3)。随访过程中超声心动图示:LVEF在治疗2个月后迅速恢复至完全正常(54%,图3),左心室舒张末期内径恢复正常(48 mm),NT-proBNP 快速下降至394 pg/ml(图1),并在后续迅速降至完全正常(图1)。随着心功能的恢复,在不到半年时间内患者血压快速升至全天平均170/102 mmHg(在服用四联降压药物情况下:沙库巴曲缬沙坦200 mg、每日2次+琥珀酸美托洛尔200 mg、每日1次+螺内酯20 mg、每日1次+氨氯地平10 mg、每日1次),室间隔厚度从12 mm升至14 mm,血肌酐有逐渐上升趋势(图5)。因考虑患者年龄<40岁,肾上腺CT提示:右侧肾上腺腺瘤,左侧正常(图6),且在治疗前血钾亦偏低(图7),四联降压药难以控制,推测患者可能患有原发性醛固酮增多症(primary aldosteronism,PA),但因抗心力衰竭药物对PA筛查影响较大且不宜停用进行药物洗脱,PA的初筛和确诊试验(表1)仅能作为参考。2018年11月在与患者充分交流的基础上,将螺内酯剂量调整至20 mg、每日3次,随后患者血压确实逐渐得到控制,2019年2月全天平均血压降至149/93 mmHg(图2)。因考虑患者血肌酐轻度偏高,长期大剂量服用螺内酯对肾功能、性功能有不良影响,以及拒绝行外科手术治疗,与患者沟通了PA微创手术治疗的可能性,并在2019年6月行分侧肾上腺静脉取血显示左侧优势(图8),优势侧并不在有腺瘤的右侧。鉴于患者无法停用抗心力衰竭药物进行药物洗脱,该结果准确性并不高,但是患者对医师信任使得治疗得以继续,在2019年6月20日患者接受了经皮超选择性肾上腺动脉栓塞术(superselective adrenal arterial embolization,SAAE)治疗(图9),术后醛固酮水平下降,肾素活性恢复正常,醛固酮与肾素比值(aldosterone-renin ratio,ARR)完全恢复正常(表1),术后将患者服用螺内酯剂量调整至20 mg、每日2次,在半个月后降至20 mg、每日1次,术后2个月随访全天平均血压完全恢复正常122/73 mmHg(图2)。
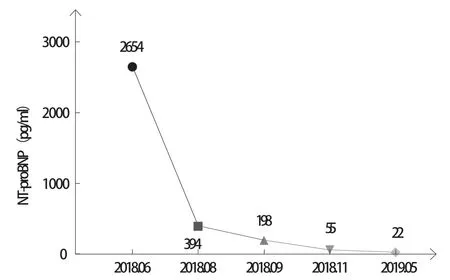
图1 患者NT-proBNP变化
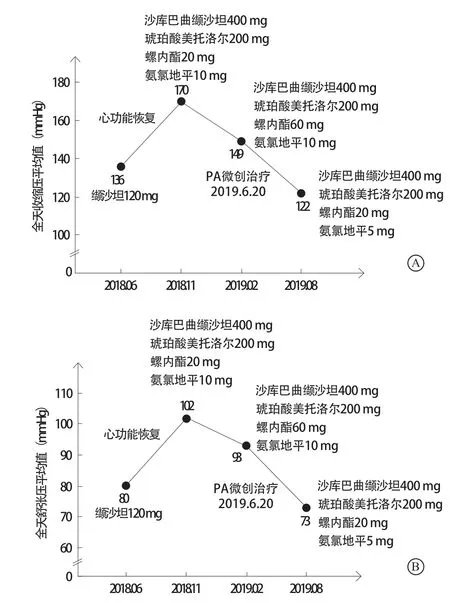
图2 患者24 h动态血压变化情况 A. 收缩压;B. 舒张压
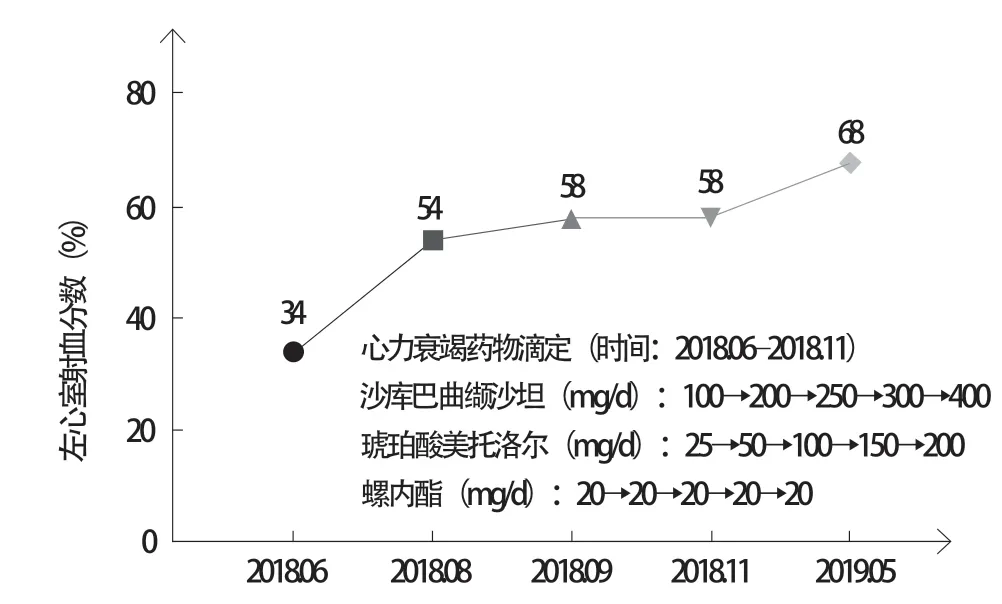
图3 患者左心室射血分数变化
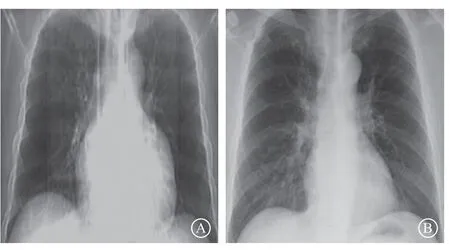
图4 患者不同时期X线胸片结果 A. 2018年6月胸片可见双肺水肿,左心室增大;B. 2018年11月胸片可见双肺水肿消失,左心室较图A明显缩小
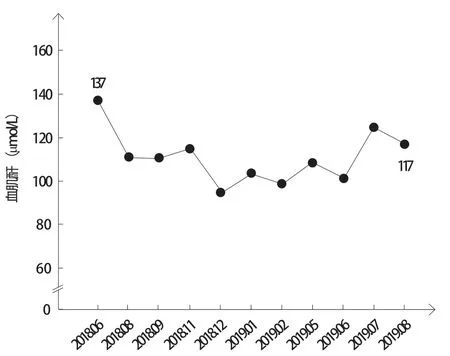
图5 患者血肌酐变化
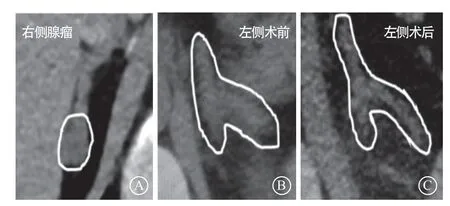
图6 患者肾上腺CT手术前后对比 A. 术前右侧腺瘤;B. 术前左侧正常;C. 术后左侧较前轻度萎缩
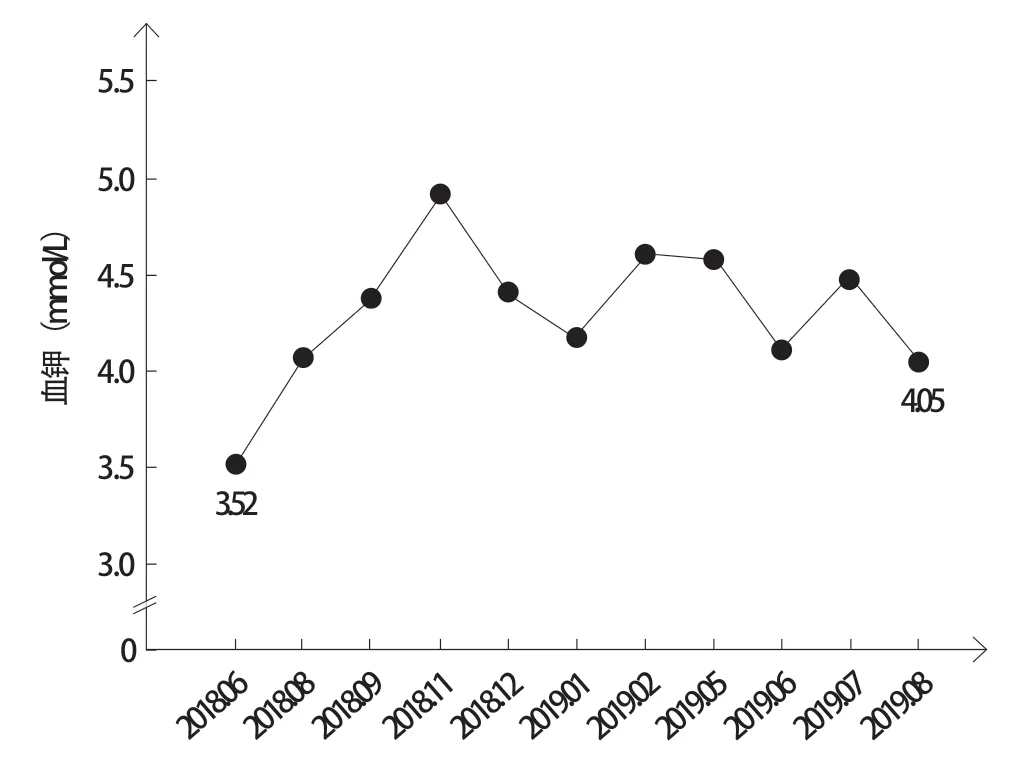
图7 患者血钾水平变化

表1 PA 初筛和确诊试验结果及术后对比
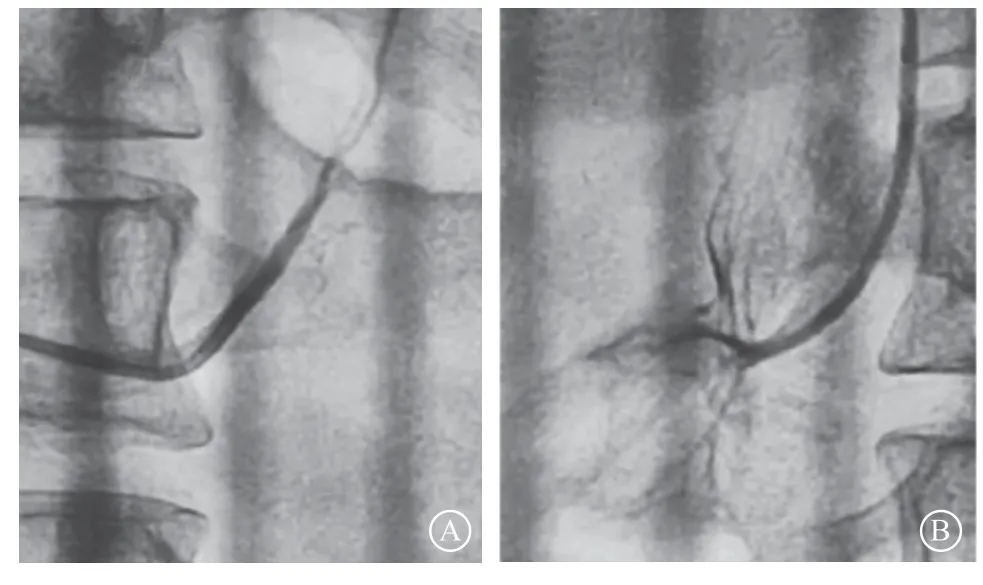
图8 患者肾上腺静脉采血及结果 A. 左侧肾上腺静脉造影;B. 右侧肾上腺静脉造影
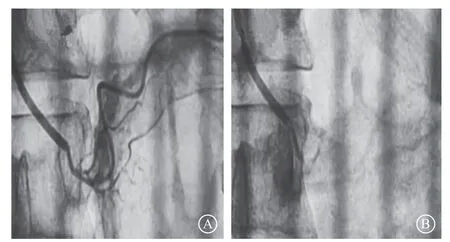
图9 超选择性肾上腺动脉栓塞手术前后造影 A. 栓塞手术前;B. 栓塞手术后
2 讨论
临床上,PA虽然被认为是继发性高血压的一种最常见和可治愈的病因,但其诊断往往可能被延误。从而导致严重的心血管疾病。研究表明,PA死亡的主要原因是心血管疾病[1-4]。相对于原发性高血压(essential hypertension,EH),PA患者心血管风险更高[5-7],其原因可能是慢性醛固酮升高通过长期刺激激活心脏盐皮质激素受体(mineralocorticoid receptors,MRs)导致心肌纤维化、心肌肥厚、心室重塑,最终致充血性心力衰竭[8]。在动物实验中,MR基因的缺失或失活会减弱左心室扩张、心肌肥厚和收缩性心力衰竭的发生,相反,心肌细胞中MR基因的过表达可导致心室重构和收缩性心力衰竭的发生[9-10]。因此,PA治疗的目的不应局限于血压正常化和低钾纠正,而应侧重于恢复过量醛固酮对心血管系统的有害影响。一项针对20例PA患者的小型前瞻性研究发现,在接受肾上腺切除术的患者中心肌胶原蛋白含量降低[11]。本例个案提示我们需关注PA对心脏结构和功能不利影响的这一重要临床特征。据相关调查显示,PA患者中心脑血管合并症总检出率可达26.2%(51/195),其中充血性心力衰竭检出率占2.6%(5/195)[12]。因此对于此类患者,早期诊断和病因治疗尤为重要。本例较为棘手的问题在于PA的确诊和分型诊断。对于难以行药物洗脱情况下初筛和确诊试验阳性患者,鉴于螺内酯诊断性治疗也提示PA极大可能性,综合本例患者治疗前血钾亦偏低以及CT提示右侧肾上腺腺瘤的特点,我们在临床上可诊断为PA[13]。
PA治疗方案取决于分型定位诊断和患者对药物的反应。由于本例患者的特殊性,肾上腺静脉采血术前准备并不能按常规进行,自然导致判定左侧优势结果可信度不高。面临这样的局面,国内外文献并没有相关经验借鉴。结合患者血肌酐轻度偏高,长期大剂量服用螺内酯对肾功能有不良影响,且拒绝行外科手术治疗,我们为患者实施了SAAE,目的是尽量将产生醛固酮的腺瘤的供血动脉全部栓塞,使其缺血坏死,达到与手术切除相同的效果。研究表明,与开放性手术及腹腔镜手术相比之下,SAAE没有发现严重的并发症,手术效果良好[14-17]。该患者术后2个月在维持原有降压方案并将螺内酯减量至20 mg、每日1次的基础上,全天平均血压完全恢复正常,手术效果显著。术后长期疗效有待进一步随访。
总结:(1)此病例的成功依赖于患者对医师的信任,所以珍惜患者的信任,这是作为医师的一笔无比珍贵的财富。(2)在不得以的情况下,不经过药物洗脱,如果初筛和确诊试验阳性,肾上腺静脉分侧取血的结果也许可以作为参考(不建议作为常规)。(3)PA所导致的继发性高血压比EH更容易在早期出现心脏扩大和心功能下降,如果能及时诊断和干预,心脏结构和功能可以快速恢复。

