丹红注射液联合替罗非班对急性脑梗死患者NF-κB炎症信号通路及疗效的影响
康梅娟,温昌明,刘义锋,孙 军,张保朝
(南阳市中心医院,南阳 473000)
急性脑梗死(acute cerebral infarction, ACI)是神经内科常见疾病,好发于中老年群体,多由于血栓形成或动脉壁上血栓脱落经血循环流入并阻塞脑动脉,导致相应部位供血、供氧不足或缺乏而诱发[1]。现阶段,临床治疗ACI应在尽早恢复脑血管血流供应、减少脑组织梗死范围的基础上,关注缺血再灌注损伤、血栓再形成风险,以减少ACI的后遗症或死亡率[2]。抗血小板聚集是现行治疗ACI的主要方法之一,而《2018年美国急性缺血性卒中早期管理指南》修改抗血小板药物替罗非班推荐级别为Ⅱb级,其不仅可抑制血小板聚集,还可阻止血栓形成、扩散[3]。丹红注射液是一种经现代科技提取而成的中药复方制剂,主要含有丹参酮、丹参酸及红花黄色素、红花酚苷等化学成分。有研究发现[4-5],其可通过抗血栓形成、促进血管生成、制约氧化修饰、减轻局部炎症级联反应等多种机制和途径发挥保护脑血管系统的作用。本研究就丹红注射液联合替罗非班治疗ACI的效果以及可能作用机制进行回顾性分析,报道如下。
1 资料与方法
1.1 一般资料
选取2018年5月~2019年8月于我院收治的ACI患者125例,均符合《中国急性缺血性脑卒中诊治指南》中的ACI诊断标准[6]。纳入标准:① 急性起病,且发病至入组时间<5 h。② TOAST分型为小动脉闭塞性卒中型及大动脉粥样硬化性卒中型。③ 近期未输血或接受抗凝药或抗血小板药治疗。④ 入选患者均自愿参加并签署知情同意书。排除标准:① 近3个月有创伤史或行外科手术的患者。② 伴有急性、慢性感染或严重凝血功能障碍者。③ 患有其他严重疾病,如心力衰竭、肝肾功能不全等。④ 对丹红注射液、替罗非班过敏或伴有影响药物吸收疾病者。⑤ 临床病历资料不完整患者。
本研究经医院伦理委员会批准,并按随机数字表法将纳入病例分为治疗组(n=65)和对照组(n=60)。治疗组男性37例、女性28例;年龄 40~81岁,平均年龄(55.42±5.99)岁;病程0.7~4.8 h,平均病程(3.19±0.88) h;体重指数(BMI)21.58~25.17 kg/m2,平均BMI(23.37±2.97) kg/m2;合并症:既往高血压40例,糖尿病25例;既往吸烟史34例,饮酒史31例。对照组男性35例、女性25例,年龄41~79岁;平均年龄(54.95±5.93)岁;病程0.6~4.9 h,平均病程(3.27±0.92) h;BMI 21.40~25.30 kg/m2,平均BMI(23.24±2.80) kg/m2;合并症:既往高血压37例,糖尿病23例;既往吸烟史32例,饮酒史28例。两组基线资料无统计学差异(P>0.05),具可比性。
1.2 给药方法
两组入院后经绿色通道尽快完成治疗前相关检查,合并高血压、糖尿病等患者给予相应的对症药物治疗,并根据病情控制血压、血糖,维持水电解质、酸碱平衡,同时予依达拉奉(西安利君有限公司,国药准字H20080495,批号:1911021,规格:20 ml∶30 mg)30 mg+100 ml 0.9%氯化钠注射液静脉滴注,bid,以清除自由基;予奥拉西坦注射液(河北医科大学生物医学工程中心,国药准字H20174066,批号:190315,规格: 5 ml∶1.0 g)4.0 g+250 ml 0.9%氯化钠注射液静脉滴注,qd,以保护神经。在此基础上,对照组予以盐酸替罗非班(鲁南制药集团股份有限公司,国药准字H20041164,批号:85191201,规格:100 ml∶5 mg)0.4 μg/(kg·min),静脉滴注30 min后,并以0.1 μg/(kg·min)的速度静脉微泵替罗非班,持续1天。停用盐酸替罗非班2 h前,口服硫酸氢氯吡格雷片(赛诺菲制药有限公司,国药准字H20123115,批号:181126,规格:75 mg/片)75 mg,1次/d;拜阿司匹林肠溶片(拜耳医药保健有限公司,国药准字J20171021,批号:BJ48737,规格:100 mg/片)100 mg/d,qd,并维持用药2周。
治疗组在对照组基础上加予丹红注射液(山东丹红制药有限公司,国药准字Z20026866,批号:18101023,规格:10 ml/支)20 ml+0.9%氯化钠注射液250 ml静脉滴注,qd,持续治疗2周。
1.3 观察指标
1.3.1NF-κB p50和p65 mRNA
采用荧光定量PCR法检测,即用Trizol试剂(上海联迈生物工程有限公司,货号LM-0010)提取血液中的总RNA,并参照试剂盒说明书逆转录为cDNA。据PCR试剂盒(上海联迈生物工程有限公司,货号KM-90408)操作说明,以β-actin为内对照,并用同一样品的cDNA和同样的PCR反应条件进行NF-κB p50、p65的mRNA扩增。完毕后以Primer软件设计引物,分析界面并计算样品中目的基因mRNA的相对表达量,其中目的基因mRNA相对表达水平为2-ΔΔCt。引物序列见表1。

表1 Real time-PCR引物序列及扩增产物长度
1.3.2NF-κB p50和p65蛋白
外周血加入200 μl红细胞裂解试剂(北京博蕾德科技发展有限公司),冰上放置30 min充分裂解细胞,3000 r/min离心10 min,收集上清为细胞裂解液。用Thermo Sdentific Pierce BCA蛋白检测试剂盒(赛默飞世尔科技有限公司)进行蛋白定量,即为RIPA提取脑组织蛋白,用BCA试剂盒测定蛋白浓度,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE,10%)分离蛋白质样品,上样量为30 μg/孔,转移至聚偏氟乙烯(PVDF)膜,10%脱脂奶粉室温振荡封闭2 h,然后加入1∶3000稀释的辣根过氧化物酶标记的抗鼠或抗兔的二抗(上海研生生化试剂有限公司)室温孵育过夜,ECL化学发光法显色、定影。设β-actin为内参照基因,采用软件对条带进行半定量分析,测出各条带IOD值,表示NF-κB p50、p65二者相对表达水平。
1.3.3炎症反应指标
分别于治疗前后,采集患者空腹外周静脉血 6 ml,以0.109 mol/L枸橼酸钠抗凝,抗凝剂与静脉血的比例为9∶1,轻轻充分混匀,以转速3000 r/min离心6 min,取上清液于-20 ℃保存待测,采用ELISA检测血清中白细胞介素-8(IL-8)、白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)。
1.3.4疗效判断
采用日常生活活动(ADL)评分测评生活质量,分值范围在0~100分,分值与生活质量呈正相关;采用美国国立卫生研究院卒中量表(NIHSS)评分测评患者的神经缺损情况,分值范围在0~42分,分值与生活质量呈负相关。
1.3.5用药安全性
观察并记录两组患者治疗期间出现与药物相关的不良反应。
1.4 统计学方法
2 结果
2.1 NF-κB p50、p65 mRNA和蛋白表达
治疗前,两组的NF-κB p50、p65 mRNA和蛋白无显著差异(P>0.05)。治疗后,两组的NF-κB p50、p65 mRNA和蛋白均下降,且治疗组低于对照组(P<0.01)。见表2。

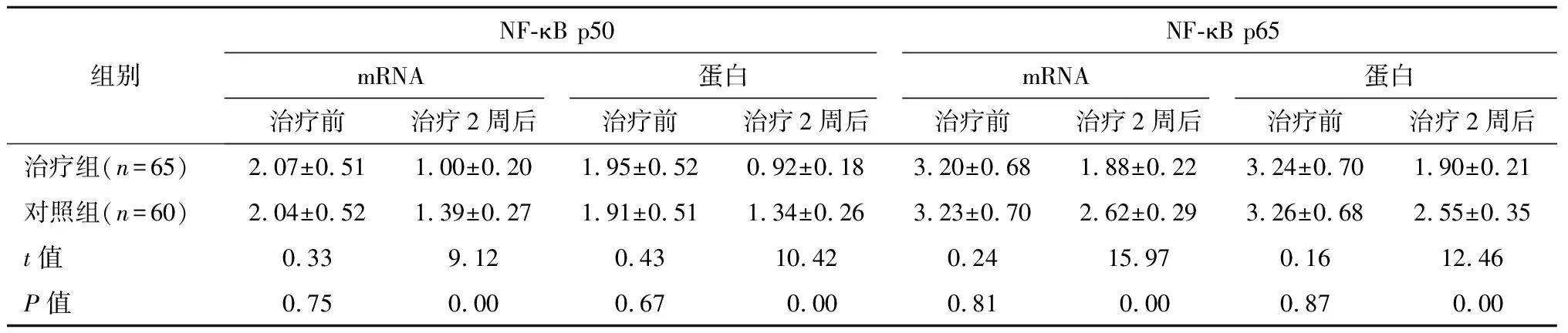
组别NF-κB p50NF-κB p65mRNA蛋白mRNA蛋白治疗前治疗2周后治疗前治疗2周后治疗前治疗2周后治疗前治疗2周后治疗组(n=65)2.07±0.511.00±0.201.95±0.520.92±0.183.20±0.681.88±0.223.24±0.701.90±0.21对照组(n=60)2.04±0.521.39±0.271.91±0.511.34±0.263.23±0.702.62±0.293.26±0.682.55±0.35t值0.339.120.4310.420.2415.970.1612.46P值0.750.000.670.000.810.000.870.00
2.2 炎症反应指标
治疗前,两组的血清TNF-α、IL-8、IL-1β无统计学差异(P>0.05)。治疗后,两组的血清TNF-α、IL-8、IL-1β均下降,且治疗组低于对照组(P<0.01)。见表3。


组别 TNF-α(ng/L)IL-8(pg/ml)IL-1β(ng/L)治疗前治疗2周后治疗前治疗2周后治疗前治疗2周后治疗组(n=65)30.50±5.2912.24±2.07349.47±38.92194.42±20.9020.16±4.617.52±2.31对照组(n=60)30.31±5.2219.50±3.26351.59±39.25237.72±28.5920.36±4.5912.34±3.60t值0.20114.730.309.600.248.83P值0.840.000.760.000.810.00
2.3 疗效判断
治疗前,两组的NHISS评分、ADL评分无显著差异(P>0.05)。治疗后,两组的NHISS评分均下降,且治疗组低于对照组(P<0.01);两组的ADL评分均上升,且治疗组高于对照组(P<0.01)。见表4。

表4 两组疗效判断比较 分
2.4 不良反应
125例患者全部完成试验,无病死与脱失病例,且治疗前后心电图、生化检查等未见显著变化,无低灌注等情况发生。
3 讨论
ACI多是供应脑部血液的动脉被粥样硬化、血栓或栓子堵塞所致的严重脑组织软化、坏死,在临床上具有发病急、进展快、治疗难度大等特点[7]。相关统计调查表明[8],生活节奏加快、人口老龄化程度加重以及高脂饮食、运动减少等均导致ACI患病率逐渐升高,约有65%~70%的患者有再次发生急性脑血管事件的风险,具有更高的病死率。
既往研究发现[9],NF-κB炎症信号通路的激活是ACI发展的重要病理机制,其既可维持脑内环境的稳定,又可介导病原特异性应答。NF-κB属NF-κB/Rel家族中的一员,正常生理条件下,NF-κB在细胞质中以p50/p65二聚体形式存在,并与其抑制蛋白IκB结合,滞留于细胞质中且无转录活性[10]。当炎症反应发生时,脑组织内TNF-α、IL-1β等炎症介质含量增多,可导致NF-κB的激活,而源于炎症反应激活的NF-κB可刺激诱导炎症因子、活性氧(ROS)等的产生,而二者又可反馈激活IκB激酶复合物IKKs,后者将三聚体p50/p65/IκB的IκB亚基调节位点的丝氨酸磷酸化,IκB蛋白从三聚体解离下来,使p50及p65暴露,继而释放p50/p65并发生核转位与相应靶基因上的κB位点结合调节TNF-α、IL-8、IL-1β、Bcl-2等靶基因转录[11]。研究结果显示[12],TNF-α、IL-8、IL-1β水平随缺血再灌注损伤病情进展不断升高,形成“瀑布效应”,加重脑组织损伤。TNF-α是炎症反应的触发因子,能够介导炎症细胞发生聚集与黏附,同时促进巨噬细胞等合成并分泌大量IL-1β等二级炎症因子,由此造成的炎症级联放大反应可造成远隔组织的功能损伤,而后者又正反馈调节NF-κB的激活,刺激多种凋亡相关基因的表达并造成神经元细胞凋亡,形成恶性循环[13]。IL-8多由于NF-κB过度表达所激活和释放,其可结合趋化因子受体IL-8受体α,诱导释放大量蛋白酶直接损伤脑组织,促进后续一系列病理生理级联反应,对细胞及缺血组织损伤加剧[14]。由此可见,ACI患者长期处于一种炎性损害循环中,而若ACI患者本身合并有高血压、糖尿病等慢性炎症疾病,NF-κB诱导的炎症反应对其影响更为严重,因此探究NF-κB的调控机制至关重要[15]。本研究结果可见,治疗组的NF-κB p50、p65 mRNA和蛋白表达以及炎症反应指标TNF-α、IL-8、IL-1β水平均低于对照组。提示丹红注射液辅助治疗能够抑制NF-κB炎症信号通路的激活和炎症因子的释放,这可能是该方案改善患者脑组织损伤、神经细胞凋亡的重要因素之一。
既往文献指出[16],对于ACI患者而言,生理、生活质量的综合康复在推动患者回归社会进程中起重要作用,因此,为更准确地提供上述领域细节上的信息,本研究采用ADL评分、NHISS评分进行评估。结果显示,经治疗干预后治疗组ADL评分高于对照组,NHISS评分低于对照组。提示丹红注射液联合替罗非班较单一应用替罗非班更能够有效减轻患者脑损伤程度,改善其神经功能及生活质量,治疗效果确切。分析原因可能是丹红注射液联合替罗非班均具有抗血小板作用,可发挥一定协同作用,促使血管舒张,增加血管通透性。同时,丹红注射液亦可激活内皮细胞功能、抑制动脉硬化进程,以恢复血脑屏障正常结构并改善脑内供血和供氧,保护脑组织内环境[9],进而达到治疗目的。
综上,丹红注射液联合替罗非班治疗ACI能进一步改善患者预后,其机制可能与抑制NF-κB炎症信号通路的活化及炎症因子释放有关。然而,本研究时间较短,可能对研究结果可信度造成一定影响,此为不足之处,因此该方案的中长期疗效尚有待更长期的大样本研究加以证实。

