显微手术治疗C1~C2硬膜内外神经鞘瘤的中长期随访结果*
林国中 马长城 王振宇 谢京城 刘 彬 陈晓东 孙建军 杨 军
(北京大学第三医院神经外科,北京 100191)
C1~C2神经鞘瘤多起源于C2神经根,部分肿瘤位于硬膜内外,切除时需兼顾脊髓和椎动脉的保护。C2棘突是重要的头颈肌肉附着点,也需要尽量保留。2010年7月~2019年5月,我们收治57例C1~C2硬膜内外神经鞘瘤,均采用显微手术治疗,中位随访3.5年,效果良好,报道如下。
1 临床资料与方法
1.1 一般资料
本组57例,男33例,女24例。年龄18~74岁,平均37.6岁。
临床表现:枕颈部疼痛53例,枕颈部麻木26例,对侧肢体无力6例。病程3个月~5.5年,中位数1.5年。首发症状为枕颈部疼痛50例,枕颈部麻木7例。体格检查,枕颈部针刺觉减退28例,对侧肢体肌力下降6例(均为Ⅳ级),对侧腱反射活跃5例,病理征均为阴性。脊髓功能状态按McCormick分级[1]标准,Ⅰ级51例(神经功能无损伤,运动正常,可有轻微感觉减退),Ⅱ级6例(轻度运动及感觉障碍,生活自理)。
影像学检查:均行CT和MRI检查。CT检查可见C1~C2区域团块影,21例可见C1后弓和(或)C2椎板骨质受压变薄。MRI检查C1~C2病灶表现为等T1或稍长T1、等T2或稍长T2信号,17例病灶呈蜂腰改变,11例可见囊变,囊变多位于硬膜下部分,增强扫描明显强化,但囊变部分无强化。病灶长径1~4 cm,平均1.8 cm。病灶部位脊髓受压变窄,向对侧移位;23例蛛网膜下腔增宽(硬膜下肿瘤较大),34例蛛网膜下腔无明显增大,甚至缩窄。
病例选择标准:年龄18~75岁,全身情况稳定,无严重内科疾病,肿瘤硬膜外部分向椎旁生长<4 cm。
1.2 显微手术方法
气管内插管,全身麻醉,上头架,颈部过屈,头低俯卧位。连接电生理监测,包括体感诱发电位(somatosensory evoked potential,SEP)、运动诱发电位(motor evoked potential,MEP)和肌电图(electromyography,EMG)。设计枕外粗隆下方至C2棘突后正中切口,严格中线切开,直至C1后弓和C2棘突,根据肿瘤大小及位置,适度剥离患侧枕骨尾端和(或)C2头端肌肉附着,个体化椎板切开,可显露肿瘤边界即可(硬膜外肿瘤可直视确定,硬膜下肿瘤根据术前测量确定)。个别肿瘤较大(9例)需做C2棘突根部潜行切除,甚至需适度剥离对侧C2头端的少量肌肉附着,做C2棘突上缘根部切除和对侧椎板少量切开。
完成显露后,导入显微镜,沿神经根走行纵行切开硬膜外肿瘤包膜,切口外侧至肿瘤外缘,内侧至硬膜囊,但避免与后续硬膜囊切口相交。包膜内分离肿瘤,找到远端载瘤神经根,切断载瘤神经根,在肿瘤突破硬膜囊处横断,大多可将硬膜外肿瘤完整切除。如肿瘤较大或瘤体较硬(19例),无法完全在可视条件下完成手术,可先囊内分块切除肿瘤,再处理肿瘤两端,可将硬膜外肿瘤全切除。
纵行切开硬膜囊并悬吊,显露肿瘤硬膜下部分。在根袖起始处分离肿瘤与硬膜的粘连,游离肿瘤远端。轻柔松解肿瘤与脊髓之间的粘连,分离并保护肿瘤上附着的神经,电凝切断近端载瘤神经,将肿瘤切除。瘤腔止血,分别吻合包膜和硬膜,逐层关闭切口。
术后给予神经营养等治疗。术后3、6个月及1年复查MRI和颈椎X线片,如无异常可间隔2~3年复查一次。如出现术前类似症状或体征,复查MRI,判断是否复发。
1.3 评价指标
①采用McCormick分级标准[1]评价脊髓功能状态;②采用MRI评价肿瘤切除情况及复发,以未见异常肿物为无残留或无复发;③颈椎正侧伸屈开口位X线评估颈椎稳定性[2],以寰齿前间隙≥3 mm或两侧寰齿侧间距相差≥2 mm为上颈椎不稳定,以颈椎过伸过屈侧位片相邻椎体后缘前后滑移≥3 mm或相邻椎体矢状面成角≥10°为下颈椎不稳定。
2 结果
手术时间60~180 min,平均93.4 min;术中出血量10~100 ml,平均58.2 ml。术中3例SEP报警,1例MEP报警,手术结束时均恢复正常;术中38例EMG报警,暂停操作后恢复,手术结束时均无肌电爆发。结合术中情况及术后复查MRI,57例肿瘤均全切除。无椎动脉损伤、感染、脑脊液漏。7例有载瘤神经支配区麻木感,无其他新发神经功能障碍。术后病理均为神经鞘瘤。术后住院时间3~9 d,平均6.0 d。
随访6个月~9年,中位数3.5年,其中<3年18例,3~5年22例,>5年17例。术后新发症状情况:7例载瘤神经支配区麻木感术后6个月均恢复正常。术前症状情况:53例枕颈部疼痛症状术后1~2个月均完全缓解;26例枕颈部麻木者中24例术后6个月恢复正常,2例残留轻度麻木感;6例肌力减退均在术后1年内恢复正常。脊髓功能状态按McCormick分级标准,均达到Ⅰ级。MRI检查均未见肿瘤复发。颈椎正侧伸屈开口位X线检查均未见颈椎不稳定。典型病例图片见图1。
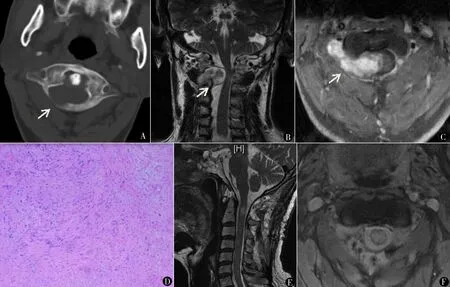
图1 C1~C2硬膜内外神经鞘瘤:术前水平位CT(A)显示C1后弓骨质被压迫吸收;冠状位MRI(B)显示哑铃形病变位于右侧C1/2间隙,骑跨硬膜内外,脊髓受压变窄并向左侧移位,相应部位蛛网膜下腔增宽;水平位增强MRI(C)显示硬膜内外病变明显强化,伴部分区域囊性变,椎动脉位于病变前极,被推挤向前移位;术后病理(D)见大量梭形细胞,胞质丰富,胞界不清,诊断神经鞘瘤(HE染色 ×40);术后3个月矢状位(E)和水平位MRI(F)显示肿瘤全切,脊髓水肿,C2棘突保留
3 讨论
C1~C2硬膜内外神经鞘瘤的手术涉及显露和周围重要结构的保护。从显露角度来看,C1~C2椎管较宽大,C1(寰椎)后弓与C2(枢椎)椎板之间的间隙也较宽大,这都有利于肿瘤的显露。该区域附近的重要结构包括C2棘突、椎动脉和脊髓神经。C2棘突是很多肌肉的附着点,对于维持颈椎稳定性非常重要。C1、C2硬膜外有椎动脉、C1和C2神经根、静脉丛等重要结构。椎动脉在横突孔内上行,自C1横突孔发出后向内侧沿寰枕间隙走行,穿寰枕膜中外1/2入颅底;C2神经根穿行于C1/2宽大的间隙,在椎动脉后方,位置较不固定,可牵拉。上述结构周围还有静脉丛围绕。在硬膜下有颈脊髓和神经根。C2棘突切除会影响颈椎稳定性,椎动脉损伤会造成失血、脑梗死甚至死亡,静脉丛损伤会引起意外出血,C1~C2脊髓损伤则可能造成高位截瘫、中枢性呼吸功能障碍等,因此,术前需充分了解该区域肿瘤大小、位置、与脊髓和椎动脉的关系。
由于局部空间较为宽大,且未形成封闭性骨管,C1~C2硬膜内外神经鞘瘤早期临床症状不明显,出现症状时肿瘤多已较大。神经鞘瘤起源于神经根,通常偏一侧生长,因此症状多为单侧。症状以神经根刺激引起的枕颈部疼痛为主,如果肿瘤已对神经根造成破坏,可能表现为枕颈部麻木或无力,甚至因脊髓受压出现半侧肢体无力及感觉障碍。
显露肿瘤时要尽量减少对颈椎稳定装置的破坏。肿瘤最远极距离中线大多不超过4 cm,可采用颈后正中入路[2~8]。但在切口上要个体化,一般只需剥离患侧枕部肌肉,C2上附着的肌肉根据肿瘤情况不剥离或做最小程度剥离即可。肿瘤硬膜下部分可能超过中线,需适度剥离对侧枕部肌肉。但C2肌肉主要附着在棘突上和椎板下缘,一般需剥离患侧棘突上肌肉附着,无需剥离对侧肌肉或患侧椎板下缘肌肉。尽量保留肌肉的正常附着,有利于预防术后鹅颈样畸形及颈部疼痛。如肿瘤向侧方生长超过4 cm,可考虑后正中入路联合侧前方入路[3,4,9],从肌肉间隙内切除肿瘤,避免肌肉剥离损伤。
对骨质的切除也应尽量个体化。C2在颈部的稳定性中起着重要的作用,C2棘突椎板破坏时,极易引起颈椎不稳定或畸形。由于C1/2间隙宽大,硬膜内外神经鞘瘤一般偏于一侧,也极少从C1后弓上缘一直蔓延至C2椎板下缘,所以应根据肿瘤的大小和位置,做个体化椎板切开,部分肿瘤甚至可不切除椎板[10]。C1没有重要的肌肉附着,但其后弓外侧有椎动脉经过。可借助增强MRI和CTA判断椎动脉走行。3D打印技术和容积再现等重建技术有助于术前准确判断椎动脉走行及与肿瘤的关系[11,12]。一般中线旁0.5~0.75 cm是安全的,超过0.75 cm最好避免使用咬骨钳,改用超声骨刀小心磨除后弓下缘,磨除范围以可显露肿瘤表面开始转折处即可。C2是颈部多块重要稳定肌肉的附着点,如肿瘤已经使C1/2间隙扩大,而肿瘤硬膜下部分较小,尽量不切开椎板;肿瘤较大时,尤其是硬膜下部分较大时,做患侧椎板选择性切开,同时尽量保留椎板下缘的连续。要尽量避免棘突的破坏,即便肿瘤超过中线,也可在棘突根部做潜行切除,或在棘突上缘做局限性棘突根部切除,辅以对侧椎板选择性切开(无须全部剥离对侧肌肉),大多可满足手术暴露的需要,而不要贸然将棘突全部切除[3]。
个体化肌肉剥离和椎板切开可保留棘突及大部分椎板,保留骨质的连续性和重要肌肉附着点,有利于维持颈椎稳定性,而且能避免内固定造成的颈椎活动受限。本组57例中位随访3.5年,均未见颈椎不稳,有力地证明这种个体化显露方法有利于颈椎稳定[3,13]。但为了显露椎管,对患侧肌肉尤其是枕骨肌肉剥离仍较为广泛。微通道可以最大化利用解剖空间,在提供同样的椎管显露的情况下,其肌肉剥离范围和切口长度均较传统牵开器小[14]。将个体化椎板切开与微通道相结合,可在达到同样椎管显露的同时,进一步减少对韧带和肌肉的破坏,从而更好地维持脊柱稳定性[14]。对于内侧不超过椎管2/3,外侧不超过3 cm的C1~C2硬膜内外神经鞘瘤,可尝试采用微通道手术。
肿瘤硬膜外与硬膜下部分的性质相同,但与周围结构的关系不同。一般先处理硬膜外部分,一方面可释放操作空间,利于后续处理硬膜下肿瘤时向外侧悬吊硬膜,显露和分离肿瘤,另一方面,正常的脑脊液也能起到缓冲作用,避免硬膜外操作引起脊髓损伤。神经鞘瘤起源于Schwann细胞,在其形成初期已有包膜[15]。肿瘤的硬膜外部分在生长过程中,根袖硬膜和周围纤维结缔组织等软组织在肿瘤周围形成假性包膜,故肿瘤的硬膜外部分要严格在包膜内切除。即便术前影像显示肿瘤与椎动脉关系密切,二者之间仍然存在间隙,在包膜内可全切肿瘤[3]。本组57例均无椎动脉损伤,说明严格包膜内切除是保证椎动脉不受损伤的有效措施。包膜切开应沿神经根走行纵行切开,外侧以可显露肿瘤外极为准,内侧至硬膜囊。切除肿瘤的硬膜外部分后,将硬膜囊纵行切开,显露肿瘤硬膜下部分。两切口不相交,以免形成“T”字形切口影响硬膜吻合。硬膜下肿瘤无假性包膜,其远端与硬膜外部分延续,常在根袖起始部造成硬膜缺损。切除肿瘤的硬膜外部分后,分离肿瘤与硬膜粘连,即可游离肿瘤远端。肿瘤近端与载瘤神经近端相连,切断载瘤神经后即可将肿瘤切除。但肿瘤近端可能与脊髓粘连,在分离时要轻柔,切勿强行撕扯,否则容易造成脊髓损伤。肿瘤腹侧可能有神经粘连,这些神经有的汇入近端的载瘤神经,因此,在电凝切断载瘤神经前,一定要仔细辨认,尽可能分离保留神经,只切断真正的载瘤神经。由于肿瘤骑跨硬膜内外生长,在神经根袖起始处常形成硬膜缺损,肿瘤切除后,要分别吻合硬膜和包膜切口。
手术中高位颈脊髓和神经根都存在受损风险,尤其是高位颈脊髓与脑干相连,重要的神经传导束密集,一旦受损,后果严重。为实时了解其功能状态,防止造成不可逆的医源性损伤,应在术中辅以电生理监测。SEP、MEP和EMG分别反映脊髓后索、皮质脊髓束和运动神经根的功能情况,应联合运用,进行多模式神经电生理监测(multimodal intraoperative monitoring,MIOM),全面监测并及时预警[16]。本组57例均在电生理监测下手术,未出现永久性神经功能障碍加重,也说明电生理监测辅助有助于手术的安全进行。
综上所述,C1~C2硬膜内外神经鞘瘤大多可通过后正中入路个体化椎板切开完全切除。尽量保留C2尤其是其棘突及肌肉附着,有利于维持颈椎稳定性。手术应先切除肿瘤硬膜外部分,再切除硬膜下部分。切除硬膜外部分肿瘤时严格包膜内切除可有效防止椎动脉损伤,切除硬膜下肿瘤时应尽量避免损伤脊髓。
——壮肾

