菱形二氧化铈的水热合成及发光机理研究
李向果,郭 淼,姚会敏,吕 静
(1.河南质量工程职业学院食品与化工系,河南平顶山467000;2.广西师范大学化学化工学院)
随着家居市场需求的不断扩大, 发光材料在智能照明系统领域的应用需求也在逐年增加。 二氧化铈(CeO2)是一种重要的稀土氧化物发光材料,在LED 照明系统、光电子器件、智能传感器、紫外屏蔽剂、燃料电池、催化剂、抛光材料等领域具有广泛的应用[1-6]。 尤其是CeO2中的Ce 离子同时存在+4 和+3 两种价态,当两种价态相互转换时,该材料具有很强的储氧功能[7],这一功能将导致CeO2具有高效的发光性能。不同的制备方法导致CeO2发光材料的微结构、表面形貌、缺陷态等不同,从而影响材料的光学性质和其他物理化学性质[8]。 因此,制备高储氧功能的CeO2稀土氧化物发光材料成为了一大挑战。
目前,合成CeO2发光材料的方法较多,包括溶剂热法[9]、阳极氧化铝模板法[10]、草酸 沉淀法[11]、蛋清蛋白辅助水热法[12]、沉淀滴定法[13]、真空热蒸镀法[8]、表面活性剂辅助水热法[14]、络合剂辅助水热法[15]、反相微乳液法[16]等。 在上述合成方法中,水热法是一种优异的制备方法, 尤其在制备不同形貌如八面体状、棒状、花状、蝴蝶状、空心球状等方面具有很大的优势,仅需引入矿化剂、表面活性剂、络合剂等原材料即可改善CeO2发光材料的形貌[14-15]。 然而,这些方法在前驱体溶液中引入了其他试剂,对CeO2发光材料的相纯度和性能都会产生不同程度的影响。 但是,不使用任何矿化剂、络合剂以及表面活性剂合成CeO2发光材料的简单水热合成法尚未见报道。 因此,采用简单一步水热合成法合成CeO2发光材料并研究它的光学、发光性能具有重要意义。
笔者采用简单的一步水热法合成CeO2发光材料,基于X 射线衍射仪(XRD)和X 射线光电子能谱仪(XPS)研究它的氧空位浓度以及吸附氧,建立晶胞结构。 通过扫描电镜观察制备的发光材料的形貌,研究扫描电镜(SEM)观察结果与XRD 计算结果的一致性。 采用紫外可见分光光度计和荧光分光光度计研究CeO2发光材料的光学和发光性质。 根据荧光发射谱,利用色度软件分析其色度坐标。基于实验结果和理论分析,研究CeO2发光材料的发光机理。
1 实验部分
1.1 材料的合成
采用一种简单的水热合成法制备菱形CeO2发光材料。 按照一定的化学剂量比称取六水合硝酸铈配制成水溶液,在充分溶解后除去不溶物,得到无色透明的Ce(NO3)3·6H2O 溶液。 用硝酸或氨水调节溶液的酸碱度为6。 量取上述溶液80 mL 置于聚四氟乙烯内衬的反应釜中, 将反应釜移入干燥箱中,在250 ℃保温12 h。 升温、降温速率均为10 ℃/min。 待冷却至室温后,将反应产物转移至烧杯中静置24 h,去除上层清液,用适量硝酸清洗数次,再用高纯酒精清洗两次,然后置于干燥箱中在135 ℃干燥12 h,获得菱形CeO2发光材料。
1.2 材料表征
采用DX-2700 型X 射线衍射仪对菱形CeO2发光材料的物相结构进行分析;采用Materials Studio 4.0 软件构建CeO2晶胞;采用JSM-7600F 型扫描电镜观察菱形CeO2发光材料的表面形貌;采用XSAM 800 型X 射线光电子能谱仪测量CeO2发光材料的光电子能谱;采用UV-2500 型紫外可见分光光度计测试CeO2发光材料的紫外可见漫反射光谱;采用RF-5301PC 型荧光分光光度计记录菱形CeO2发光材料的激发光谱和发射光谱,测量范围为200~800 nm,光源为200 W 氙灯。
2 结果与讨论
2.1 相结构分析
图1 为水热法合成CeO2的XRD 谱图。 从图1看出,在2θ 为28.915、33.106、47.489、56.718、59.109°处可以观察到5 个明显的衍射峰, 对应的晶面指数分别为(111)(200)(220)(311)(222)。全部的衍射峰属于立方相CeO2,空间群为Fm-3m(225),标准卡号为JCPDS No.34-0394。 利用MDI Jade 6 软件对其进行结构精修,R=13.45%,表明模拟结果可信,实验结果与拟合的结果基本一致。 根据谢乐公式(1),挑选XRD 谱线中的4 个强峰, 相关参数见表1, 计算CeO2平均晶粒尺寸为10.962 nm。

式中:D为晶粒尺寸;k为谢乐常数;λ 为入射X 射线波长;β 为衍射角半高宽;θ 为衍射角。
通过公式(2),可计算出CeO2晶胞参数a。 经计算,其晶胞参数为0.536 76 nm,结果见表1。

式中:d为晶面间距;(h、k、l) 为晶面指数;a为晶胞参数。
为研究样品中的氧空位浓度,通过公式(3)[17]和(4)[17]可计算出CeO2的氧空位浓度,见表1。
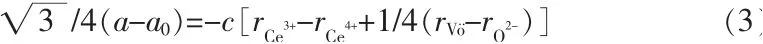
式中:a为CeO2样品的晶胞参数;a0为块体CeO2样品的晶胞参数,0.541 134 nm;c为氧空位浓度系数;rCe3+为Ce3+的离子半径,取值0.128 3 nm;rCe4+为Ce4+的离子半径,取值0.109 8 nm;根据文献[17],为氧空位半径, 取值0.138 nm,rO2-为O2-离子半径, 取值0.124 nm。

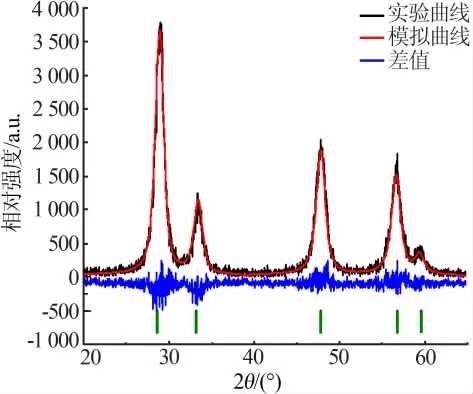
图1 水热法合成CeO2 的XRD 谱图
Zhou 等[18]合成了纳米尺寸的CeO2单晶,其氧空位浓度为4×1020cm-3。Choudhury 等[17]采用湿化学法合成了CeO2纳米颗粒,经不同温度烧结,其氧空位浓度随着烧结温度的升高而减少, 其最佳氧空位浓度接近5×1020cm-3。 Gao 等[19]采用辐照辅助聚丙烯酰胺凝胶法合成了CeO2纳米颗粒,观察到了一个相反的现象, 即氧空位浓度随着烧结温度的升高而增加,其氧空位浓度介于(1.27~3.96)×1020cm-3。 在本实验中,采用水热法合成的CeO2样品的平均氧空位浓度为1.723 7×1020cm-3。 根据Choudhury 等[17]和Gao等[19]的结论可知,高的氧空位浓度可能导致高的光催化活性;氧空位浓度相对较低,其发光性能较强。本实验中,CeO2样品的氧空位浓度居于两篇文献获得的最佳氧空位浓度之间,可能展示极好的发光性能。

表1 XRD 谱图分析获得的晶粒尺寸、晶胞参数和氧空位浓度
基于MDI Jade 6 软件结构精修和理论计算的结果, 利用Materials Studio 4.0 软件可获得CeO2晶体结构图。 CeO2是一种具有萤石结构的立方相晶体, 该结构的晶体主要由面心立方晶胞的阳离子和占据八面体空间的阴离子组成,见图2。 从图2 看出,每个Ce 离子与O 离子的8 个最近邻位置配位,每个O 离子与最近的4 个Ce 离子配位。

图2 水热法合成CeO2 晶体结构图
2.2 表面形貌和电子衍射分析
图3 为水热法合成CeO2的SEM 照片。从图3 看出, 该样品主要由菱形的大颗粒和一些晶粒尚未长大的小颗粒组成。 大的菱形颗粒的直径超过200 nm,这一结果与XRD 计算的结果有所不同。 尽管如此,却与XRD 获得的结果不矛盾。 其一,XRD 计算的是晶粒,而SEM 观察到的是颗粒,而颗粒是由许多小晶粒组成;其二,在采用谢乐公式对晶粒进行计算的过程中,是将所获得样品近似为球形颗粒计算的,故结果出现较大偏差。

图3 水热法合成CeO2 的SEM 照片
由于结晶度会对CeO2衍射峰半峰宽产生影响,因此通过选区电子衍射(SAED)检验了CeO2结晶度。图4 为水热法合成CeO2的SAED 图。 从图4 看出,电子衍射图包含5 个明显的衍射环。 经Digital Micrograph 软件作图可知, 晶面间距为0.311 99、0.270 49、0.192 01、0.162 98、0.119 99、0.103 98 nm,对应的晶面指数分别为(111)(200)(220)(311)(420)(511)。经分析表明,采用水热法合成的CeO2具有较好的结晶度。

图4 水热法合成CeO2 的SAED 图
2.3 XPS 表征
为研究CeO2的化学组分、电子能级、分子结构和表面缺陷, 采用X 射线光电子能谱仪获得了其XPS 图。图5a 为CeO2的Ce 分谱。用U 和V 分别表示3d5/2和3d3/2的自旋轨道耦合。 4 个主要3d5/2特征峰 在885.3、888.9、891.4、901.3 eV 分 别 对 应 于V、V′、V′′、V′′′组分;在902.5、905.3、908.6、918.5 eV 的3d3/2特 征 峰 分 别 对 应 于U、U′、U′′、U′′′组 分。Watanabe 等[20]研究认为,V、V′、V′′、V′′′4 个峰分别可分配给CeⅣ(3d94f2)O(2p4)、CeⅢ(3d94f1)O(2p6)、CeⅣ(3d94f1)O(2p5)、CeⅣ(3d94f0)O(2p6);相应的U结构的4 个峰与V 结构的峰对应。 图5b 为CeO2的O 分谱。 通过分峰处理可将谱线分为两个特征峰,分别为528.98 eV 和530.52 eV。 其中,528.98 eV 的峰对应于Ce—O 峰, 而530.52 eV 的峰对应于吸附氧的峰[21]。 吸附氧的峰越强,表明其荧光发射性能越好。结合XRD 结果的氧空位计算和XPS 氧分谱的分析可知,采用水热法合成的菱形CeO2具有较强的发光性能。

图5 水热法合成CeO2 的XPS 图
2.4 光学性质
紫外可见漫反射光谱可用于分析制备材料的光学性质, 图6a 为水热法合成CeO2的紫外可见漫反射光谱图。 从图6a 看出, 在200~220 nm 波长范围内,反射率随着波长的增加而逐渐减小;在220~350 nm 波长范围内,反射率随着波长的增加略有增加;在350~550 nm 波长范围内,反射率随着波长的增加而急剧增加;随后,波长继续增加,反射率基本保持不变。 根据K-M 公式(5),可获得CeO2的紫外可见吸收光谱图,见图6b。
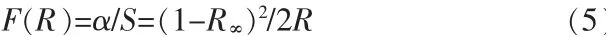
式中:R为反射率;α 为吸收系数;S为散射系数。 从图6b 看出,两个明显的吸收峰在285 nm 和330 nm能被观察到。 该结果表明,CeO2具有很强的紫外吸收能力。 而且吸收一直延伸到500 nm 左右,表明其还具有一定的可见光吸收能力。可见,该样品具有较强的光催化活性。基于紫外可见吸收光谱,可通过公式(6)计算出CeO2样品的光学带隙(Eg)值。

式中:α 为吸收系数;h为普朗克常数;n为频率;A为一个常数;n取1/2。 图6c 为(αhν)1/2与hν 的关系曲线图。将曲线斜率最陡处外延至与横坐标的交点,其交点值即为样品的Eg值。 由图6c 可知,水热法合成的CeO2样品的Eg为3.19 eV。 Ramasamy 等[22]采用化学沉淀法合成了CeO2纳米颗粒, 其Eg值比本实验获得的Eg值大,约为3.5 eV。Selvi 等[23]发现,采用共沉淀法合成的CeO2纳米颗粒的Eg值比采用化学沉 淀 法 合 成 的Eg值 更 大。 Hosseini 等[24]采 用 微 波辅助燃烧法合成了CeO2纳米颗粒,其Eg值约为3.26 eV。 由此可知,采用不同的方法合成同一种物质其Eg值均不同,表明CeO2样品的Eg值强烈依赖于合成路径。
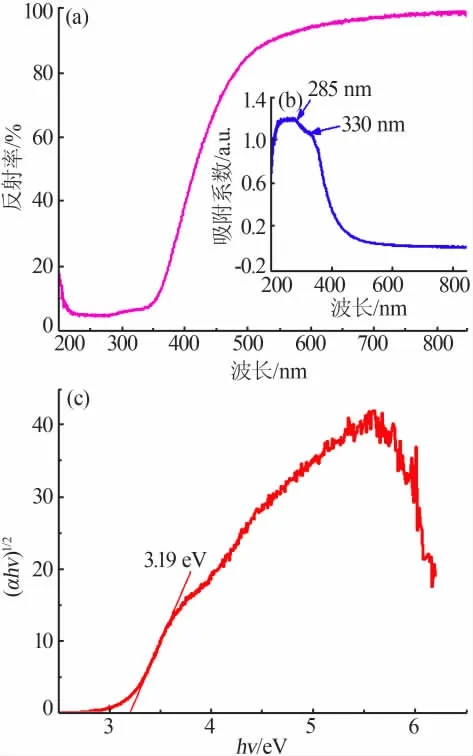
图6 水热法合成CeO2 的紫外可见漫反射光谱(a)、紫外可见吸收谱(b)、(αhν)1/2 与hν 的关系(c)图
2.5 发光性质

图7 水热法合成CeO2 的激发谱(a)、发射谱(b、c)、激发波长随发射强度的变化曲线(d)
为研究水热法合成CeO2的发光性质, 图7a 给出了CeO2的激发光谱图(发射波长为460 nm)。 从图7a 看到两个明显的激发峰在202 nm 和325 nm。 图7b 显示了CeO2的发射光谱图(激发波长为202 nm)。在350~700 nm 波长范围内,CeO2展示了一个宽的发射带。基于高斯拟合可将其分为4 个发射峰,分别位于460、470、540、580 nm。 在325 nm 波长激发下,其发射峰为460 nm,见图7c。与图7b 相比,图7c 发射峰的强度较弱, 这一结果与激发谱中观察到的现象一致。为研究不同激发波长对样品发射强度、峰位置等的影响, 采用不同激发波长激发获得了样品的发射峰。发射峰的位置几乎没有变化,然而其发射强度发生了明显变化,结果见图7d。 从图7d 看出,随着激发波长的增加,其发射强度不断减小,表明样品最佳的激发波长为202 nm。 除了光学性质强烈依赖于合成路径, 发光性质也表现出强烈依赖于制备方法和材料的维度。Gong 等[25]合成了一维杆状和三维莲花状CeO2氧化物, 其发射带分布在380~650 nm的宽范围内。 当采用温和的水热法合成立方相的CeO2时,其在452 nm 和470 nm 展示了两个明显的发射峰[26]。 另外,Meng 等[27]采用水热法合成了微结构的CeO2,展现了468 nm 和562 nm 两个明显的发射峰。 Phokha 等[28]采用一个简单的湿化学法合成了CeO2纳米颗粒,由于表面缺陷的作用,其在483 nm出现了一个弱的蓝绿光发射。 Choudhury 等[17]采用简单的溶液法合成了CeO2纳米颗粒,从紫外到可见展示了一个宽的发射带。 Kumar 等[29]采用一步水热法合成了CeO2纳米颗粒,出现了蓝色、绿色和黄色3个强的发射带。 Murugan 等[30]采用射频溅射法制备了CeO2薄膜,观察到了两个紫外发射峰、一个淡紫色发射峰和两个绿色发射峰。一般地,380~500 nm发射带可归因于不同缺陷能级到CeO2价带间的转变,500 ~675 nm 发射带能被归因于晶体中的氧空位[25]。为进一步阐述各发射峰产生的原因,将在发光机理部分对其进行详细分析。
基于GoCIE 色度软件,可研究水热法合成CeO2的显色性和色度坐标。 将获得的发射谱调入GoCIE色度软件, 获得相应的色度坐标, 其色度坐标值为(0.188,0.243),结果见图8。 由此可见,样品的发光颜色趋向于蓝绿色, 可将其作为一种蓝绿色发光材料的候选材料。
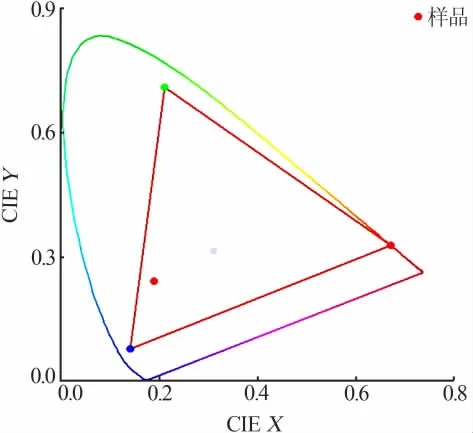
图8 水热法合成CeO2 的色度图
2.6 发光机理
为进一步理解水热法合成CeO2的发光机理,图9 提出了一个可能的解释机理。O2p和Ce4f分别组成了CeO2的价带和导带, 当激发光照射到CeO2发光材料上,电子在价带被激发跃迁到导带上,在价带留下空穴。 由于激发光能量大于Eg值,因此跃迁到导带的电子会通过振动驰豫下降到更低的能级。 在CeO2发光材料中,由于F++心的存在,通过振动驰豫下降到更低能级的电子会继续下降, 与Ce4f上的空穴发生复合,并产生发光现象。对于CeO2发光材料,其发射峰能量需大于2.6 eV 才能产生这一现象[30]。 因此,低波长的两个发射峰在460 nm 和470 nm 应归因于这一发射。 由于样品中存在大量的氧空位,电子可继续下降到氧空位所占据的能级,进一步下降到价带与空穴进行复合, 从而产生发光现象,发射峰的能量介于2.2~2.6 eV 之间[31],540 nm的荧光发射即由氧空位所引起。 同时,由于F0*心的存在,电子会在该能级短暂停留,并继续下降到F0心能级与空穴复合,释放的能量以光的形式发出,其发射峰能量位于2.1~2.2 eV之间[30],本实验中580 nm 的荧光发射即属于这一发射。
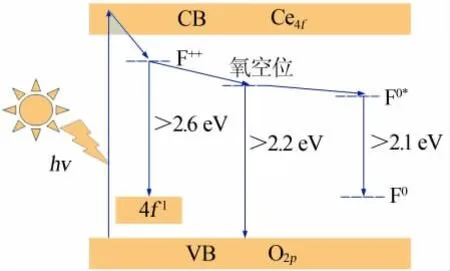
图9 水热法合成CeO2 的发光机理
3 结论
通过水热法制备了存在大量氧空位或吸附氧的CeO2发光材料, 经计算其晶胞参数为0.536 76 nm,氧空位浓度为1.723 7×1020cm-3。 紫外可见吸收光谱显示其在400 nm 以下具有强的光吸收能力,计算其Eg值为3.19 eV, 是一种强的紫外光光催化候选材料。 经202 nm 的光激发,荧光发射光谱出现了460、470、540、580 nm 4 个荧光发射峰, 色度坐标值为(0.188,0.243)。 经发光机理分析,CeO2发光材料中存在的F++心、 氧空位和F0*心在发光方面扮演了重要角色。

