炎症和非炎症环境下肝干细胞细胞学特性观察
黄俊凯,王 艳,杨奉天,李 婉,陈向金,杨 柳,徐丽红,3
肝干细胞起源于Hering管、小叶内胆管、胆管周围肝细胞和“空”细胞。当持续、严重的打击作用于肝脏而正常肝细胞增殖受阻,此时肝干细胞激活、增殖,并双向分化为胆管上皮细胞和肝细胞以修复、重建肝脏结构和功能。既往文献[1]提示,肝干细胞的异常分化或分化受阻的肝干细胞可能是肿瘤的起源细胞。肝再生过程中,非可控性炎症环境可使肝细胞和非实质细胞之间的协调平衡受损,导致细胞的遗传物质发生永久性变化,且其周围基质将变成有利于癌症发展的肿瘤微环境[2],促进肿瘤的发生。该实验旨在通过观察炎症环境及非炎症环境中肝干细胞的细胞学特性及亚细胞结构,初步分析2种环境中肝干细胞的细胞学特性及亚细胞结构差异。
1 材料与方法
1.1 主要试剂与仪器2-乙酰氨基芴(2-AAF,批号:SLBT5333)、2.5%戊二醛固定液(批号:G5882)、聚乙二醇400(批号:MKBZ4937V)购于美国Sigma公司;四氯化碳(CCl4,分析纯)购于天津永晟精细化工有限公司;玉米油为中粮集团产品;单克隆兔抗大鼠上皮细胞黏附分子(EpCAM)抗体(ab213500)、多克隆兔抗大鼠CD133抗体(ab16518)购于美国abcam公司;多克隆小鼠抗大鼠OV6抗体(MAB2020)购于美国R&D公司;山羊抗兔二抗(批号:ZB-2301)、山羊抗小鼠二抗(批号:ZB-2305)购于北京中杉金桥生物技术有限公司;水合氯醛(分析纯)购于天津福晨化学试剂厂。透射电子显微镜(型号:JEM-1230)购于日本JEOL公司。
1.2 肝卵圆细胞增殖模型的建立
1.2.1实验动物 15只SPF级SD雄性大鼠,5周龄,体质量180~200 g,购于新疆维吾尔自治区实验动物研究中心[许可证号:SCXK(新)2016-0001]。大鼠按体质量编号,随机分为对照组(n=5)、炎症环境肝干细胞增殖模型组(n=5)、非炎症环境肝干细胞增殖模型组(n=5)。于石河子大学医学院动物实验中心喂养,由实验中心统一提供饲料。饲养环境由实验室根据动物饲养标准条件控制。该实验经石河子大学医学院第一附属医院动物实验伦理委员会审查,批准号:A2017-151-01。
1.2.2非炎症环境肝干细胞增殖模型的建立 参照Chien et al[3]的研究建立非炎症环境肝干细胞增殖模型。2-AAF溶于聚乙二醇,配制成10 g/L溶液,按20 mg/kg体质量灌胃大鼠,每天1次,连续5 d,第6天10%水合氯醛按3 ml/kg体质量腹腔注射麻醉大鼠,行2/3肝切除术(切除肝左外叶和肝中叶),术后第2天继续按原剂量2-AAF连续灌胃6 d,继续正常喂养4 d,于术后第10天10%水合氯醛麻醉后开腹取大鼠肝脏,以备病理组织学及电镜检测。
1.2.3炎症环境肝干细胞增殖模型的建立 参照Chen et al[4]的研究建立CCl4/2-AAF炎症环境肝干细胞增殖模型。50% CCl4-玉米油溶液按3 ml/kg体质量背部皮下注射,每周2次,第5周开始予以20 mg/kg 2-AAF连续灌胃14 d,10%水合氯醛麻醉,开腹取大鼠肝脏,以备病理组织学及电镜检测。
1.2.4正常对照组大鼠 常规喂养4周后取大鼠肝脏备检测。
1.3 病理组织学观察
1.3.1HE染色 肝脏标本常规固定、石蜡包埋、切片、烘片,二甲苯Ⅰ、Ⅱ、Ⅲ脱蜡、乙醇溶液(无水乙醇、90%、80%、70%)水化,苏木精浸染5 min、伊红浸染3 min,乙醇溶液脱水,二甲苯透明,中性树脂封片镜检。
1.3.2免疫组化 肝脏标本常规固定、石蜡包埋、切片、烘片、脱蜡至水,微波及高压锅抗原修复,一抗(抗体浓度EpCAM:1 ∶ 100,CD133:1 ∶ 200,OV6:1 ∶ 100)4 ℃湿盒孵育过夜,滴加50 μl相应二抗(山羊抗兔二抗、山羊抗小鼠二抗)37 ℃孵育30 min,DAB显色,苏木精复染,脱水,透明后封片镜检。判定标准:细胞膜或细胞质染色呈棕褐色判定为阳性,染色阳性程度采用Image-Pro Plus 6.0软件分析平均吸光度(optical density, OD)值,每组分别随机选择6张200倍镜下图片分别测量各组EpCAM、CD133、OV6平均OD值。
1.4 电镜检测肝脏组织戊二醛固定20 min,制备大约5 mm×5 mm×1 mm的肝脏组织块。于新疆医科大学电镜室,PBS漂洗10 min×3次,1%锇酸固定1 h,PBS漂洗10 min×3次,依次用50%、70%、80%、90%、100%、100%丙酮梯度脱水,各浓度丙酮均脱水15 min,100%丙酮与包埋剂1 ∶ 1混合浸透1 h,100%丙酮与包埋剂1 ∶ 3混合浸透3 h,纯包埋剂浸透12 h,包埋(聚合)38 ℃、12 h,包埋(聚合)45 ℃、12 h,包埋(聚合)65 ℃、12 h,常规修块、半薄切片,甲苯安蓝染色定位、超薄切片、铅铀电子染色,JEM-1230型透射电镜观察,电镜电压均为80 kV。随机选择6个1 200倍镜下视野分别计数非炎症环境肝干细胞增殖模型、炎症环境肝干细胞增殖模型中异型肝干细胞数量。

2 结果
2.1 一般情况非炎症环境肝干细胞增殖模型组大鼠2只行2/3肝切除术后第2天死亡,原因可能为术中止血效果不佳,实际获得有效大鼠3只;对照组大鼠、炎症环境肝干细胞增殖模型组大鼠均存活;最终实际获得有效大鼠共13只。
2.2 肝脏大体组织学改变正常大鼠肝脏,结构完整,颜色红润,表面光滑,边缘锐利(图1A)。非炎症环境肝干细胞增殖模型大鼠残余肝脏(右外叶、乳头叶、三角叶)增生明显,呈暗红色,表面未见结节,质软(图1B),与正常大鼠肝脏外观相似。炎症环境肝干细胞增殖模型大鼠肝脏颜色苍白,表面不光滑,质韧,呈肝纤维化形成期组织学改变(图1C)。
2.3 显微镜下肝脏组织结构及细胞形态改变HE染色观察,正常大鼠肝脏结构规整,肝细胞形态正常、排列整齐(图2A)。非炎症环境肝干细胞增殖模型的大鼠肝脏显微结构与正常大鼠相似,无炎性细胞浸润(图2B)。炎症环境肝干细胞增殖模型的大鼠肝脏显微结构呈肝纤维化形成期改变,肝小叶结构受损,肝细胞排列紊乱,大量炎性细胞浸润(图2C)。
A:正常大鼠;B:非炎症环境肝干细胞增殖模型大鼠;C:炎症环境肝干细胞增殖模型大鼠
2.4肝干细胞标志物表达情况2种肝干细胞增殖模型的肝组织中均可于汇管区附近见OV6、EpCAM、CD133阳性细胞,体积约为正常肝细胞大小的1/4,核质比高(图3)。对照组、非炎症环境肝干细胞增殖模型组、炎症环境肝干细胞增殖模型组EpCAM、CD133、OV6平均OD值两两比较差异有统计学意义(F=85.696,P<0.05;F=33.308,P<0.05;F=77.478,P<0.05)(表1)。
2.5 肝干细胞超微结构特征及改变透射电镜观察,非炎症环境肝干细胞增殖模型及炎症环境肝干细胞增殖模型的肝脏组织中均可见卵圆形、核质比高、约为正常成熟肝细胞1/4大小的细胞,电镜表现符合肝干细胞的超微结构特点。同时,所见肝干细胞可大致分为3型,Ⅰ型:体积较小,约为5 μm,细胞核呈椭圆形,核质比高,细胞器少(图4A、D、G)。Ⅱ型:较Ⅰ型体积大,直径6~8 μm,见卵圆形细胞核,核质比高;细胞质较Ⅰ型丰富,但较胆管上皮细胞、肝细胞胞质仍少(图4B、E、H)。Ⅲ型:9~11 μm,体积较Ⅰ型细胞明显增大,胞质较多,与成熟肝细胞形态结构相似,可见细胞间紧密连接(图4C、F、I)。
A:正常大鼠;B:非炎症环境肝干细胞增殖模型大鼠;C:炎症环境肝干细胞增殖模型大鼠

图3 肝干细胞标志物表达情况 免疫组织化学染色 ×200
A、B、C:EpCAM、CD133、OV6正常对照;D、E、F:非炎症环境肝干细胞增殖模型的肝组织EpCAM、CD133、OV6免疫染色;G、H、I:炎症环境肝干细胞增殖模型的肝组织EpCAM、CD133、OV6免疫染色

表1 肝干细胞标志物免疫组化染色平均OD值分析
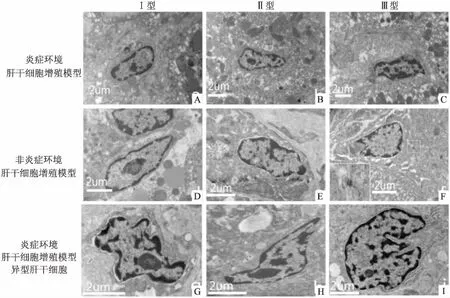
图4 肝干细胞超微结构
A、B、C:非炎症环境肝干细胞增殖模型中肝干细胞 ×12 000;D、E、F:炎症环境肝干细胞增殖模型中肝干细胞 ×20 000;G、H、I:炎症环境肝干细胞增殖模型中异型肝干细胞(G、H ×20 000,I×12 000)
炎症环境中的部分肝干细胞存在较为明显的细胞形态变异,细胞核及核仁异型性,细胞核边缘不规则,有大量切迹,见核仁边集现象,异染色质非均质化(图4G、H、I)。炎症环境中异型肝干细胞数量[(4.40±1.52)/个]较非炎症环境中异型肝干细胞数量[(0.80±0.84)/个]多,差异有统计学意义(t=4.648,P<0.05)。
2.6 炎症环境肝干细胞增殖模型中的胆管反应本次实验意外发现在炎症环境肝干细胞增殖模型的肝组织中可见EpCAM、OV6表达阳性的染色质较深染的肝干细胞参与了胆管的形成,同时,电镜观察发现由4个肝干细胞共同形成的管腔结构,有突起的微绒毛伸向管腔,相邻细胞间形成镶嵌连接和紧密连接,疑似新生胆管(图5)。
3 讨论
现肝干细胞增殖动物模型有2-AAF/部分肝切除模型、CCl4/2-AAF模型、CDE模型(胆碱缺乏-乙硫氨酸模型)、二氢三甲吡啶模型等,其中较为经典的有2-AAF/部分肝切除模型、CCl4/2-AAF模型。本研究中2-AAF/部分肝切除模型无炎细胞浸润,CCl4/2-AAF模型大量炎细胞浸润,同时2种模型的大鼠肝脏组织中均见EpCAM+、CD133+、OV6+且体积约为正常肝细胞1/4大小的肝干细胞,证实本研究成功构建了非炎症环境和炎症环境肝干细胞增殖模型。
肝干细胞细胞常见表面标志物有CK7、CK8、CK18、CD90、CD133、EpCAM、OV6等,其中EpCAM、OV6、CD133均常用于肝干细胞的筛选、鉴定。既往研究[5]提示OV6可促进肿瘤细胞的自我更新、提高肿瘤细胞的侵袭性和远处转移能力,EpCAM的表达可促进细胞增殖、迁移,并且EpCAM+的肝癌细胞具有更强的成瘤性和侵袭性[6],CD133参与肝脏肿瘤干细胞的自我更新的调节、促进肿瘤干细胞增殖和迁移,并与肿瘤细胞的上皮-间质转化、耐药性及瘤体血管形成密切相关[7]。在炎症环境和非炎症环境中均存在EpCAM+、CD133+、OV6+的肝干细胞,且炎症环境中OV6、CD133、EpCAM表达量均较非炎症环境中表达量高,提示炎症环境中的肝干细胞可能更具有转化为肝脏肿瘤干细胞的潜能。

图5 炎症环境肝干细胞增殖模型中胆管反应
近年来,已有学者[8-9]提出微环境的异常变化会影响正常干细胞的细胞学行为,并诱导干细胞转化为肿瘤干细胞,并指出干细胞的增殖、分化、归巢等细胞学行为可能与亚细胞结构密切相关,细胞形态改变可能在亚细胞水平影响干细胞的功能和转归。细胞核通过细胞骨架与细胞外基质相连接,可使细胞产生适应性反应。当细胞核发生严重形态改变时,细胞仍可存活甚至增殖、分化[10],且细胞核异型性持续存在[9]。本研究提示在炎症环境中增殖的肝干细胞核异型性的发生较非炎症环境中明显增多,但与细胞凋亡、坏死的亚细胞结构改变不同,而与肝癌细胞电镜下特征相符。此外,本次实验的炎症环境肝干细胞增殖模型中,肝干细胞参与了"胆管反应",既往有研究[11]显示参与胆管反应的肝干细胞恶性转化和迁移是肝癌侵袭和转移的基础。结合既往文献和本实验结果可以合理推测炎症环境中肝干细胞可能更具有转化形成肝肿瘤干细胞的潜能。同时,本次实验的炎症环境肝干细胞增殖模型的时间终点为第6周,组织学显示为肝纤维化形成早期,故认为炎症环境比预想更早地影响肝干细胞的亚细胞结构,对炎症环境中肝干细胞的亚细胞结构改变进行深入研究有助于肝干细胞肿瘤特性的早期识别。
目前,虽然靶点阻断肿瘤细胞的信号传导、抑制肿瘤血管生成等肝癌治疗策略提高了原发性肝癌患者的生存率,但对于慢性肝损伤中原发性肝癌的发生和复发并没有有效的抑制。结合干细胞亚细胞结构的研究成果和本研究结果,认为在早期炎症环境中观察EpCAM+、CD133+及OV6+肝干细胞的亚细胞结构改变可能有助于预测原发性肝癌的发生,以提前进行临床干预,但这需要对炎症环境中各时间点肝干细胞亚细胞结构的动态时相变化进行观察、验证。

