miR-146a-5p靶向IRAK1、TRAF6抑制小细胞肺癌耐药
梁 雪,吕 磊,钱立庭,李 明,韩丹丹
肺癌是全球癌症死亡原因之一,近十几年,它的发生率与病死率一直稳居所有癌症的榜首[1],而小细胞肺癌(small cell lung cancer, SCLC)多年来约占整个肺癌的10%~15%[2],相比较非小细胞肺癌(non-small cell lung cancer, NSCLC),它的恶性程度高、增殖时间短、病情发展快,且更容易转移[3],目前化疗仍然是SCLC最主要治疗手段之一,5年生存率不足10%,其中多药耐药(multidrug resistance,MDR)产生就是SCLC治疗中遇到的最大困窘[4]。
miRNAs是一种保守的、约19~25个核苷酸的非编码RNA,有关专家估算miRNAs至少可以调控3/5编码的基因[5],研究[6]已经证明miRNAs在癌症的发生发展、侵袭、转移、耐药等过程发挥着极其重要的作用。近几来,如Xu et al[7]报道了miR-146a-5p在雄激素依赖性前列腺癌细胞凋亡中发挥重要作用。Liu et al[8]发现在前列腺癌中FOXP3通过调控miR-146a-5p过表达发挥抑癌的作用。Yuwen et al[9]认为血清外泌体miR-146a-5p可作为预测顺铂(cisplatin,CDDP)治疗肺癌疗效和实时监测耐药的新的生物学标志物。以往对肺癌耐药miRNAs的研究主要集中在NSCLC耐药相关miRNAs的检测和表达研究,如Zhang et al[10]发现 miR-181c通过Wnt信号通路靶向调控WIF1促进 NSCLC对铂类耐药;Kwon et al[11]发现miRNA-128通过靶向BRM270抑制NSCLC耐药形成。但关于miR-146a-5p在SCLC中的研究尚未见报道,因此,临床需要可靠的预测SCLC耐药的标志物,为克服SCLC耐药提供理论支持。
1 材料与方法
1.1 实验材料
1.1.1细胞系 本研究所用SCLC 耐药细胞株(H69-AR)和敏感细胞株(H69)均来自中国科学技术大学生命科学院实验室馈赠。H69-AR细胞株培养于含20% FBS、1%青霉素-链霉素的RPMI1640培养基中;H69为悬浮细胞株培养于含10% FBS、1%青霉素-链霉素的RPMI1640培养基中;2种细胞株均放置在37 ℃、5% CO2, 饱和湿度条件下的培养箱里培养,H69-AR细胞株每天换液1次,H69细胞株每3~4 d换液1次。
1.1.2主要试剂 miRNA的qRT-PCR试剂盒(Buige-LoopTMmiRNA qRT-PCR Starter Kit)以及mRNA的qRT-PCR试剂盒(riboSCRIPTTMmRNA qRT-PCR Starter Kit) 均购自中国广州锐博生物科技公司,批号:201906060008;has-miR-146a-5p inhibitor、has-miR-146a-5p mimic、has-miR-146a-5p negative control均购自上海吉玛有限公司;慢病毒滴度均为5×109TU/ml购自上海制药有限公司;一抗兔抗白介素受体1相关激酶(interleukin-1 receptor-related kinase 1,IRAK1)、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-related factor 6,TRAF6)、GAPDH均购自美国Cell Signaling Technology公司;二抗为抗兔IgG-HRP购自上海碧云天生物公司;CCK-8试剂盒购自上海贝博生物科技有限公司。
1.1.3主要仪器 PCR仪(上海ABI公司);qRT-PCR仪(加拿大Funglyn Biotech 公司);荧光倒置显微镜(日本奥林巴斯公司);二氧化碳恒温细胞培养箱(美国ThermoFisher公司);超净化工作台(深圳创美实业有限公司);全自动Western blot成像工作站、电泳仪(上海天能科技有限公司)。
1.2 方法
1.2.1miRNA qRT-PCR 细胞中总的RNA是用TRIzol提取,按照广州锐博生物科技公司生产的miRNA试剂盒(Buige-LoopTMmiRNA qRT-PCR Starter Kit )说明书进行10 μl体系反转录反应合成cDNA,反应程序为:42 ℃、60 min→70 ℃、10 min;然后继续使用miRNA试剂盒进行20 μl体系miRNA qRT-PCR反应,反应程序为:1×95 ℃、10 min→40×95 ℃、2 s;60 ℃、20 s;70 ℃、10 s(收集信号)→1×(70~95) ℃(熔解曲线分析);反应引物合成序列为:
miR-146a-5p ForwardPrimer 5′-GGGTGAGAACT GAATTCCA-3′,ReversePrimer 5′-CAGTGCGTGTCGT GGAGT; U6 snRNA ForwardPrimer 5′-TCCGATCGT GAAGCGTTC-3′,ReversePrimer 5′-GTGCAGGGTCCG AGGT-3′;相对表达用U6(small nuclear RNA,snRNA)作参照,结果用2-△△Ct值表示。
按照广州锐博生物科技公司生产的mRNA试剂盒(riboSCRIPTTMmRNA qRT-PCR Starter Kit)进行10 μl体系反转录反应合成cDNA,反应程序为:42 ℃、60 min;70 ℃、10 min; 然后继续使用mRNA试剂盒进行20 μl体系mRNA qRT-PCR反应,反应程序为:1×95 ℃、10 min→40×95 ℃、5 s;60 ℃、30 s;72 ℃、30 s(收集信号); 反应引物合成序列为:
IRAK1 Forward Primer 5′-CCTGGAAGGCAGA AAAGTTGG-3′,Reverse Primer 5′-CGCAAGAGGACA CTCGGTTAC-3′;TRAF6 Forward Primer 5′-GAACAC CCAGTCACACATGAGAA-3′;Reverse Primer 5′-GAA ATTCCGGACCTCTGAGATATAC-3′,GAPDH Forward Primer 5′-GAACGGGAAGCTCACTGG-3′,Reverse Primer 5′-GCCTGCTTCACCACCTTCT-3′;相对表达用GAPDH作为参照,相对结果用2-△△Ct值表示。
1.2.2构建慢病毒载体 根据GenBank中检索到的序列,委托上海吉玛有限公司合成:has-miR-146a-5p inhibitor:AACCCATGGAATTCAGTTCTCA;has-miR-146a-5p mimic:TGAGAACTGAATTCCATGGGTT;has miR-146a-5p negative control(NC) :TTCTCCGAAC GTGTCACGT。
1.2.3H69-AR细胞株慢病毒转染 分H69-AR NC(对照组)和 H69-AR mimic(实验组);以每孔2×105个/ml、含20% FBS RPMI1640完全培养基接种于24孔板中,24 h后,用miR-146a-5p mimic或miR-146a-5p NC(1×109TU/ml)慢病毒载体按1 ∶100与含20% FBS RPMI1640完全培养基混合稀释转染;利用qRT-PCR和荧光显微镜进行细胞转染效率检测,建立稳定转染的H69-AR mimic细胞株及H69-AR NC细胞株。
1.2.4H69细胞株慢病毒载体转染 分H69 NC(对照组)和H69 inhibitor(实验组),配制成每孔4×105个/ml细胞数、终浓度5 μg/ml Polybrene、 miR-146a-5p inhibitor或miR-146a-5p NC(1×109TU/ml)慢病毒原液按1 ∶ 20与含有10% FBS RPMI1640完全培养基混合稀释转染;应用qRT-PCR和荧光显微镜进行细胞转染效率检测,建立稳定转染的H69 inhibitor细胞株及H69 NC细胞株。
1.2.5细胞划痕实验 将转染后H69-AR mimic和H69-AR NC都稀释成5×105个/ml悬液500 μl分别加入24孔板,待细胞贴壁铺满皿底约70%时, 用10 μl枪头在单层细胞呈“一”字型垂直于24孔板内表面划竖线,倒置显微镜下拍照,之后用不含有小牛血清的RPMI1640培养24、48 h,在同一位置,荧光显微镜下拍照。
1.2.6CCK-8细胞增殖-毒性实验检测细胞抑制率 以每孔2×105个/ml 100 μl加入96孔板中,每孔分别加入10、20、40、80、100 μg/ml不同浓度的CDDP,另设对照组(有细胞+CCK8,不加药物)和空白对照组(无细胞+CCK8,不加药物)。在培养箱培养72 h后加入CCK-8试剂10 μl混匀,再培养1~4 h后,最后室温下使用酶标仪在450 nm波长检测吸光度(optical density,OD)值。计算CDDP对细胞的抑制率:抑制率=(对照组OD值-加药组OD值)/(对照组OD值-空白组OD值)×100%。
1.2.7Western blot实验验证miR-146a-5p对靶基因的调控 提取转染后细胞总蛋白,使用上海碧云天生物科技公司BCA试剂盒对总蛋白定量,制作10%分离胶和5%浓缩胶,取20 μl总蛋白上样,经SDS-PAGE电泳后,转移到PVDF膜上,5%脱脂牛奶封闭;PVDF膜分别与一抗兔抗IRAK1、TRAF6、GAPDH(1 ∶ 1 500)摇床上4 h;与二抗抗兔IgG-HRP(1 ∶ 2 000)室温下1 h;全自动Western blot成像显影拍照,Gel-Pro软件分析灰度结果,以GAPDH作为蛋白内参。

2 结果
2.1 H69-AR和H69细胞株中miR-146a-5p的表达比较通过qRT-PCR检验H69-AR和H69细胞株中miR-146a-5p的表达情况,结果显示,H69-AR相比H69细胞株中miR-146a-5p的表达下调(22.71 ∶ 1.00),差异有统计学意义(P<0.01,t=10.66)。见图1。
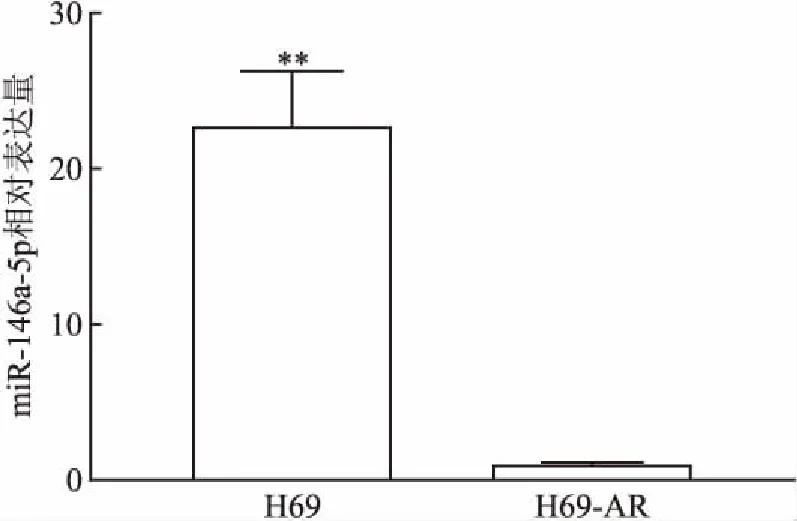
图1 qRT-PCR检测miR-146a-5p H69与H69-AR的表达
与H69-AR比较:**P<0.01
2.2 IRAK1和TRAF6是miR-146a-5p潜在的靶基因查阅了大量文献以及应用目前公认的TargetScan生物学软件进行分析,初步选定IRAK1、TRAF6为miR-146a-5p潜在的靶基因。通过qRT-PCR检测结果显示,H69-AR细胞中mIRAK1、mTRAF6的表达水平与H69比较上调(4.92 ∶1.00)、(2.76 ∶ 1.00),差异有统计学意义(P<0.01,t=19.03)、(P<0.05,t=3.75),见图2A、B。慢病毒转染成稳定H69-AR mimic,见图2C、D。以及转染成稳定H69 inhibitor,见图2E、F。转染H69-AR mimic后细胞中mIRAK1、mTRAF6的表达水平与对照组(H69-AR NC)比较下调(1 ∶ 00 ∶ 14.55)、(1 ∶ 00 ∶ 3.20),差异有统计学意义(P<0.01,t=12.38)、(P<0.01,t=4.24),见图3A、B。H69 inhibitor细胞中mIRAK1、mTRAF6的表达水平与对照组(H69NC)比较上调(10.86 ∶ 1.00)、(4.64 ∶1.00),差异有统计学意义(P<0.01,t=16.62)、(P<0.01,t=4.77),见图3C、D。
2.3 CCK-8细胞增殖-毒性实验检测miR-146a-5p对CDDP在SCLC中的抑制率CCK-8实验方法检测细胞抑制和增殖情况,实验结果显示,在不同浓度CDDP的H69组均高于H69-AR组的细胞抑制率,差异有统计学意义(P<0.05),见图4A。为了进一步检测miR-146a-5p对CDDP的影响,向转染后H69-AR mimic、H69-AR NC、H69 inhibitor、H69 NC的细胞中加入不同浓度的CDDP,实验结果显示,不同浓度 CDDP的H69-AR mimic组均高于对照组NC的细胞抑制率,差异有统计学意义(P<0.05),见图4B。不同浓度CDDP的H69 inhibitor组均低于NC组的细胞抑制率,差异有统计学意义(P<0.05),见图4C。此结果说明miR-146a-5p抑制SCLC对CDDP的耐药。
2.4 细胞划痕实验观察miR-146a-5p对SCLC细胞迁移的影响转染后H69-AR mimic细胞和NC细胞,用不含有小牛血清的培养基培养24、48 h后荧光显微镜下拍照,H69-AR mimic组与NC组比较迁移速率明显减缓,差异有统计学意义(P<0.05)。见图5。
2.5 Western blot实验检测miR-146a-5p对IRAK1、TRAF6蛋白表达的影响通过Western blot实验检测转染后IRAK1、TRAF6蛋白表达情况。见图6。H69-AR mimic与NC比较细胞中IRAK1、TRAF6蛋白表达均下调;H69 inhibitor与NC比较细胞中IRAK1、TRAF6的表达水平均上调。

图2 mIRAK1、mTRAF6分别在H69-AR和H69细胞中的差异表达和has-miR-146a-5p慢病毒分别在H69-AR和H69细胞中转染情况
A:mIRAK1在H69-AR和H69细胞株的表达;B:mTRAF6在H69-AR和H69细胞株的表达;C:H69-AR与NC细胞72 h侵染图片×100;D:miR-146a-5p在H69-AR mimic组和NC组中的表达;E:H69与NC细胞72 h侵染图片×100;F:miR-146a-5p在H69 inhibitor组和NC组中的表达;与H69细胞株比较:*P<0.05,**P<0.01;与NC组比较:##P<0.01
3 讨论
本研究课题前期通过选取2对化疗敏感和化疗耐药血浆标本(同一患者耐药前后),采用超高速离心法提取血浆外泌体,再通过高通量测序技术筛选出SCLC 耐药前后外泌体内显著差异的miRNAs,结果显示SCLC耐药后外泌体中miR-146a-5p表达水平较耐药前显著下调,结果提示miR-146a-5p可能跟SCLC 耐药有关。本研究首先使用qRT-PCR检测了H69-AR和H69细胞中miR-146a-5p的表达水平,结果显示H69-AR相比H69细胞株中miR-146a-5p的表达水平下调,与之前在血浆中高通量测序结果一致。然后通过慢病毒载体稳转染使其H69-AR细胞中miR-146a-5p过表达以及使其H69细胞中miR-146a-5p低表达,通过CCK-8、划痕实验检测到转染过表达后可以抑制肿瘤的增殖速率、迁移、转染,低表达后结果正好与之相反,说明miR-146a-5p可以起到类似抑癌基因作用抑制SCLC耐药或是使其SCLC重新敏化。
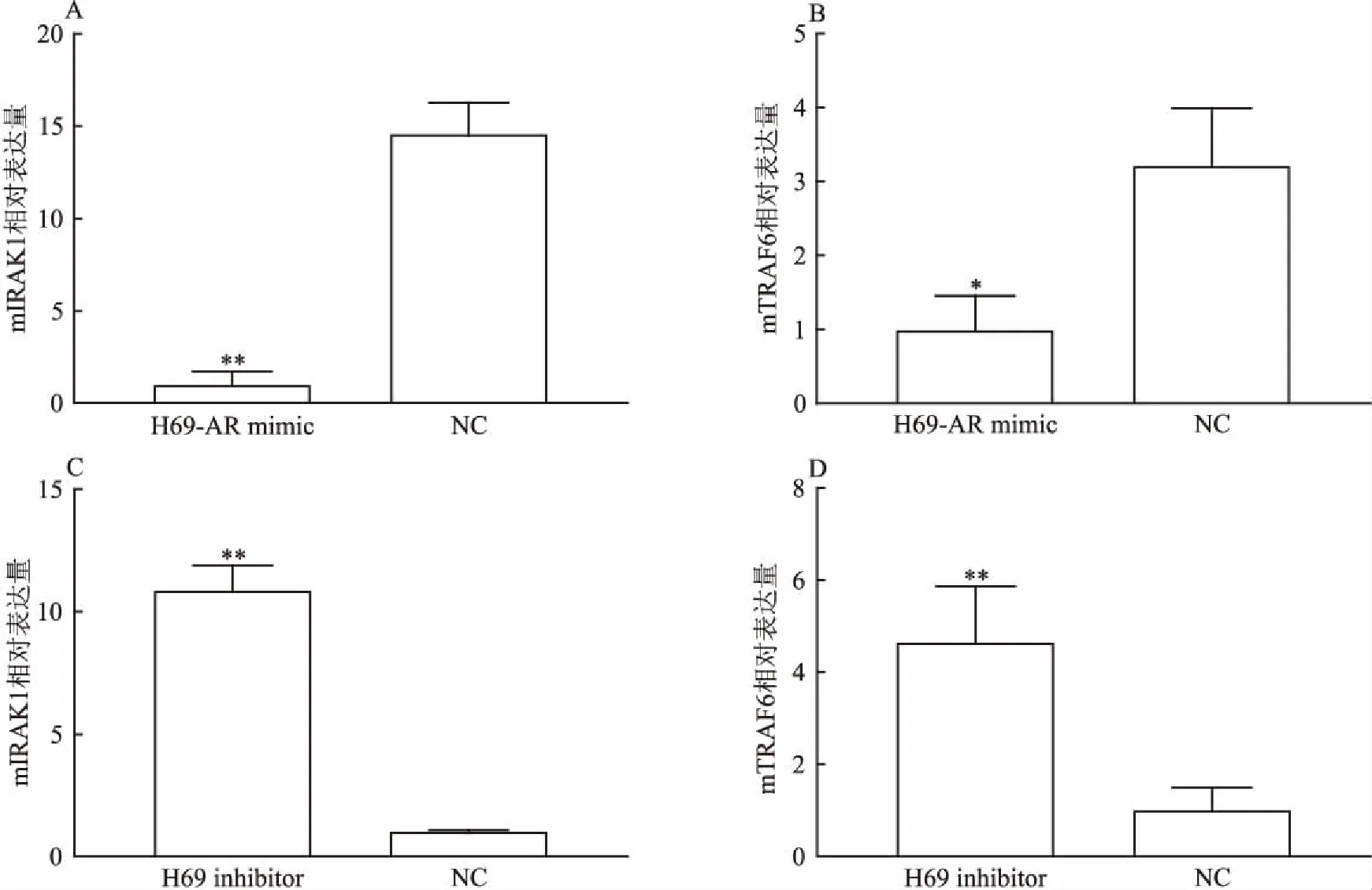
图3 mIRAK1、mTRAF6分别在H69-AR mimic和H69 inhibitor细胞中的差异表达
与NC组比较:**P<0.01,*P<0.05
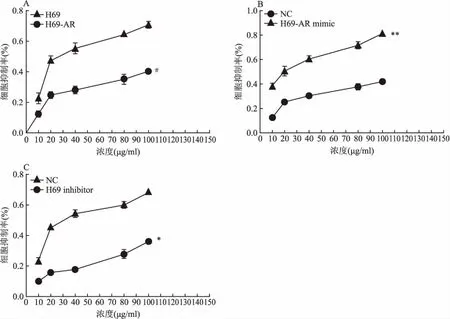
图4 CCK-8检测miR-146a-5p在不同浓度CDDP下对细胞抑制的影响
A:H69-AR组在不同浓度CDDP中细胞抑制率;B:H69-AR mimic组在不同浓度CDDP中的细胞抑制率; C:H69 inhibitor组在不同浓度CDDP中的细胞抑制率;与H69组比较:#P<0.05;与NC组比较:**P<0.01,*P<0.05
利用生物信息学软件以及查阅相关大量文献发现miR-146a-5p的潜在靶基因为IRAK1、TRAF6。I-RAK1是白介素1受体相关激酶家族中重要的一员,它不仅是一种调控炎症的信号分子,同时也是托尔样受体信号通路的信号分子,当缺失激活托尔样受体信号通路时,可能与癌症、自身免疫性、和败血症疾病等相关[12]。TRAF6是肿瘤坏死因子家族信号通路里非常重要的一种信号分子[13], TRAF6参与了肺癌、骨肉瘤、食管癌、结直肠癌和乳腺癌等多种癌症的进展[14]。本研究结果显示,H69-AR细胞相比H69细胞中mTRAF6、mIRAK1表达水平均下调,又通过慢病毒载体转染,结果显示,TRAF6、IRAK1在H69-AR mimic细胞中蛋白表达低于对照组细胞中蛋白表达;TRAF6、IRAK1在H69 inhibitor细胞中蛋白表达高于对照组细胞中蛋白表达,以上这些结果说明miR-146a-5p表达水平与mTRAF6、mIRAK1表达水平以及他们的蛋白表达都呈负相关,由此可以认为miR-146a-5p与IRAKl、TRAF6存在负调控关系,同时也提示miR-146a-5p、TRAF6、IRAK1可能共同参与了SCLC耐药。蒋亮 等[15]在前列腺肿瘤细胞中利用双荧光素酶报告基因实验,已证实miR-146a-5p可以直接结合在IRAK1和TRAF6基因的3′-UTR区域,抑制荧光素酶的表达。关于在SCLC细胞中miR-146a-5p与IRAKl、TRAF6的靶点如何结合,今后还需要应用双荧光素酶报告基因检测进一步证实。

图5 H69-AR mimic与NC在24、48 h时间下观察细胞划痕迁移情况
A:H69-AR组与NC组分别在0、24、48 h迁移情况×100;B:H69-AR组在24、48 h迁移距离;与NC组比较:*P<0.05

图6 转染H69-AR mimic、H69-AR NC、H69 inhibitor、H69 NC细胞后,IRAK1和TRAF6的蛋白表达

