SENEX基因通过活化Rb/E2F通路促进弥漫大B细胞淋巴瘤增殖与复发
完颜智翔,王极宇,潘 莹,朱凤凤,易浏颖,翟志敏
弥漫大B 细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)是成人淋巴瘤最常见的一种类型,是一组在临床表现和预后等方面具有高度异质性的淋巴造血系统恶性肿瘤[1]。自由环磷酰胺、阿霉素、长春新碱和强的松组成的标准化疗方案被用于治疗DLBCL 以来,完全缓解率达60%~70%[2]。联合利妥昔单抗进一步提高了疗效,但仍有30%~40%左右的患者复发并最终死亡[3]。SENEX 最早在2004 年被认定克隆成功,是一个与细胞衰老密切相关的新型基因[4],主要控制细胞的生长周期、衰老和凋亡[5-6]。最早在2010年,有学者[4]首次报道了关于SENEX基因通过调控内皮细胞中p16INK4a 途径诱导细胞应力性早衰形成的研究。但其在DLBCL中的表达及作用目前尚未见相关报道。该研究拟探讨SENEX基因在DLBCL中的表达及其对DLBCL复发的影响及其可能的作用机制。
1 材料与方法
1.1 材料人DLBCL细胞株(LY8)购自上海细胞所;RPMI-1640培养基购自美国Hyclone公司;胎牛血清购自美国Gibco公司;SENEX-SiRNA及其阴性对照(negative control,NC)购自上海生工公司;人外周血淋巴细胞分离液购自天津灏洋华科生物科技公司;细胞裂解液购自上海碧云天公司;PVDF膜购自美国millipore公司;High-sig ECL Western Blotting Substrate试剂盒购自上海天能公司;人与腺病毒E2启动子结合的转录因子(transcription factor binding to the adenovirus E2 promoter,E2F)1转录因子ELISA试剂盒购自美国OmnimAbs公司;Cell Counting Kit-8购自日本Dojindo公司;TRIzol购自美国Invitrogen公司;逆转录试剂盒购自美国Thermofisher公司;TB Green PCR试剂盒购自日本Takara公司。Western blot抗体购自美国Cell Signaling technology公司,见表1。PCR 引物均由上海生工生物有限公司合成,见表2。
1.2 方法
1.2.1病例资料 选择2019年2~7月在安徽医科大学第二附属医院血液科经细胞形态学、分子生物学、免疫学、细胞遗传学确诊的DLBCL患者,其中DLBCL初诊患者3例,男1例,女2例,年龄分别为:51、67、68岁;获得细胞形态学缓解的DLBCL患者3例,男2例,女1例,年龄分别为:52、56、70岁;缓解后复发的DLBCL患者3例,男2例,女1例,年龄分别为:47、50、65岁。所有缓解及复发的DLBCL患者均为骨髓缓解及复发。
1.2.2外周血单个核细胞分离 收集患者外周血5 ml,经等体积生理盐水稀释后缓慢加入淋巴细胞分离液中,离心,收集中间白膜状细胞层,经生理盐水洗涤后,离心去除上清液,留取细胞沉淀,待用。

表2 用于qRT-PCR引物和SiRNA转染的序列
1.2.3Western blot检测 使用人外周血淋巴细胞分离液提取患者外周血中的单个核细胞,使用细胞裂解液分别提取外周血单个核细胞和转染后LY8细胞中的总蛋白。通过凝胶电泳分离蛋白,后将蛋白转移至PVDF膜上。转膜结束后将PVDF膜放入溶于TBST的5%脱脂牛奶中封闭,4 ℃条件下相应一抗孵育过夜,二抗(1 ∶ 5 000)室温孵育1 h后显影。
1.2.4qRT-PCR检测 使用适量TRIzol分别提取外周血单个核细胞和转染后LY8细胞中的总RNA,使用逆转录试剂盒逆转录生成cDNA。通过使用TB Green PCR试剂盒在荧光定量PCR仪上进行qPCR实验。所有引物均由上海生工合成。磷酸甘油醛脱氢酶用作内参基因。使用2-△△Ct法计算目的基因的相对表达量。
1.2.5SiRNA转染实验 将LY8细胞接种至6孔板中,并更换为无血清培养基。分别将opti-MEM与SENEX-SiRNA/NC和Lipofectamine®2000转染试剂混匀后孵育5 min,再分别将两者混合室温孵育20 min后加入6孔板中,37 ℃培养。4 h后更换为完全培养基。转染后48 h,验证其转染效率。
1.2.6细胞增殖实验 将已成功转染SENEX-SiRNA/NC的LY8细胞,按105个细胞/孔的密度接种在96孔板中,每孔加入10 μl CCK-8溶液,37 ℃孵育2 h后上机检测450 nm各孔的吸光度(optical density,OD)值。同时设置空白孔、对照孔,且每组设立5个复孔。
1.2.7ELISA检测 将已成功转染SENEX-SiRNA/NC的LY8细胞,通过离心除去沉淀留取上清液,将样品储存在-20 ℃避免反复冻融。使用ELISA试剂盒测量转录因子E2F的浓度。使用原溶液(8 000 pg/ml)配置2倍稀释梯度(包括4 000、2 000、1 000、500、250 pg/ml)。根据标准曲线将所有标准品和样品一式两份加入包被板中,并将空白孔作为零,在添加终止溶液后15 min内测量450 nm处的OD值。
1.3 统计学处理采用SPSS 16.0软件进行统计学分析。符合正态分布的两组间数据比较均采用t检验方法。以P<0.05为差异有统计学意义。
2 结果
2.1 SENEX基因在初诊、复发与缓解DLBCL患者中的表达情况为研究DLBCL患者中SENEX的表达水平,课题组分别提取了初诊、复发和完全缓解DLBCL患者外周血中的单个核细胞,并检测了细胞中SENEX基因及其编码蛋白ARHGAP18的表达水平,结果如图1所示。与初诊组和完全缓解组相比,复发组ARHGAP18蛋白表达水平增高(F=148.0,P<0.01)(图1C),与此结果一致的是,SENEX基因水平也升高(F=10.60,P<0.01)(图1A)。此外,外周血磷酸化视网膜母细胞瘤蛋白(phosphorylation retinoblastoma, pRb)水平在复发患者中升高,完全缓解患者中降低,差异有统计学意义(F=31.21,P<0.01),视网膜母细胞瘤蛋白(retinoblastoma, Rb)表达水平则显示出相反的趋势(F=10.69,P<0.05)(图1B、C)。这些结果表明复发DLBCL患者的SENEX水平增加并伴随着Rb途径的激活。
2.2 LY8细胞中SENEX-SiRNA的转染与验证为了研究SENEX基因在人DLBCL细胞株LY8中的功能,将靶向SENEX基因的SiRNA(SENEX-SiRNA)及其阴性对照(negative control, NC)转染至LY8细胞中,并从基因水平和蛋白水平验证其转染效率。结果如图2所示,与对照组(未经任何处理的LY8细胞)和NC组(图2A)相比,SENEX-SiRNA组中SENEX mRNA的表达降低(F=104.3,P<0.01),并且SENEX-SiRNA组中ARHGAP18的水平也低于对照组和NC组(F=19.06,P<0.01)(图2B)。这些结果表明,转染SENEX-SiRNA成功沉默了DLBCL细胞中的SENEX基因表达。在此基础上,课题组继续研究了干预SENEX表达对DLBCL细胞功能和相关通路的影响。

图1 SENEX基因在初诊、复发与缓解DLBCL患者中的表达情况
A:qRT-PCR方法检测SENEX基因表达结果;B:Western blot检测蛋白表达结果;C:pRb、Rb和ARHGAP18的相对表达量;与初诊组和完全缓解组比较:**P<0.01,*P<0.05;与初诊组和复发组比较:△△P<0.01

图2 3组细胞中SENEX基因mRNA和ARHGAP18表达情况
A:SENEX基因mRNA在3组细胞中的表达;B:ARHGAP18在3组细胞中的表达;与对照组和NC组比较:**P<0.01
2.3 干预SENEX基因表达对细胞增殖能力的影响在转染后12 h比较各组细胞增殖能力的差异,结果如图3所示。与对照组和转染NC组相比,转染SENEX-SiRNA组细胞增殖能力减低(F=16.38,P<0.01)(图3A),在转染后24 h,SENEX-SiRNA组细胞增殖能力继续降低,与对照组和NC组相比,差异均有统计学意义(t=8.575,P<0.01;t=2.705,P<0.05)(图3B)。结果表明,沉默DLBCL细胞中的SENEX基因表达将抑制细胞增殖。
2.4 干预SENEX基因表达对Rb/E2F通路的影响为了进一步探究SENEX基因促进DLBCL细胞增殖的分子机制,课题组分析了细胞中周期相关蛋白和细胞因子,显示与对照组和NC组相比,SENEX-SiRNA组中pRb水平降低(F=53.54,P<0.01)(图4A);与NC组相比,SENEX-SiRNA组中游离的E2F1浓度出现降低(t=4.526,P<0.05)(图4B)。这些结果表明SENEX基因能够促进Rb蛋白和E2F1活化,提示了SENEX基因具有活化细胞周期开关—Rb/E2F转录调控通路的能力。
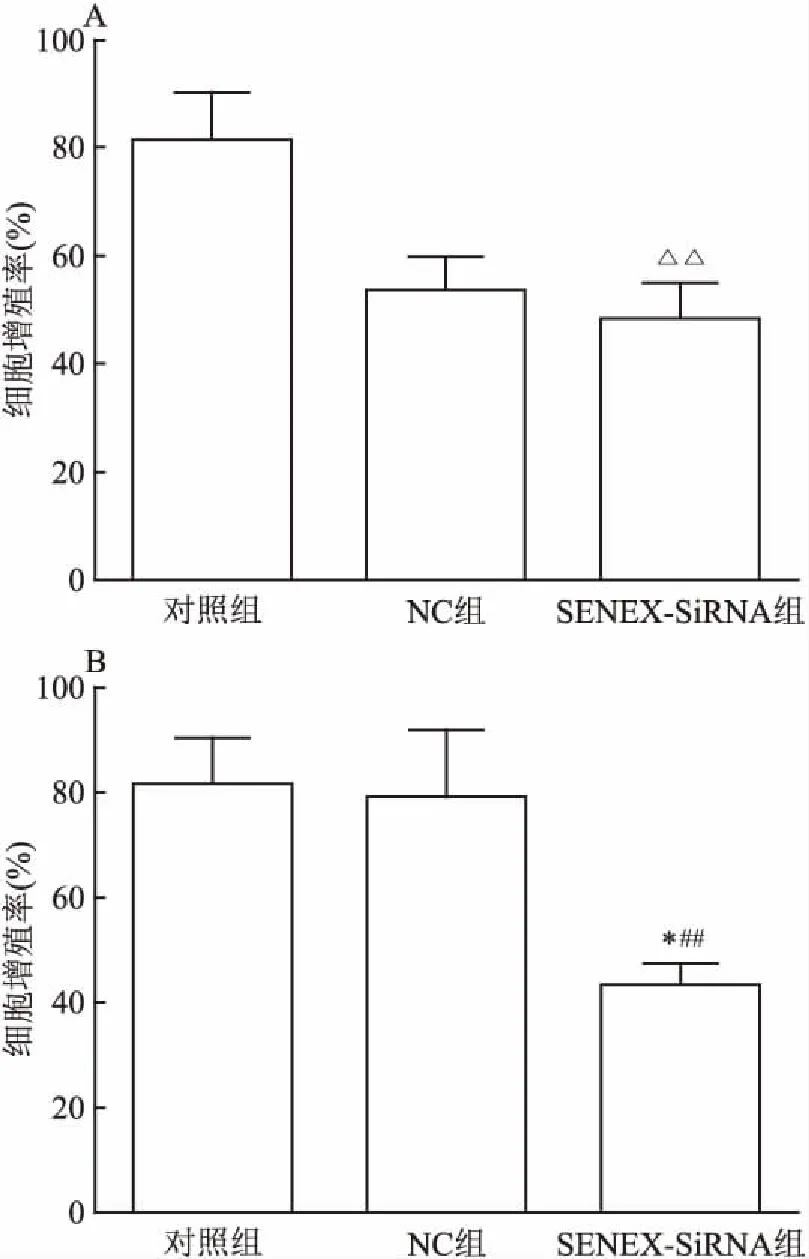
图3 转染后3组细胞的细胞增殖率
A:转染12 h细胞增殖率;B:转染24 h细胞增殖率;与对照组和NC组比较:△△P<0.01;与NC组比较:*P<0.05;与对照组比较:##P<0.01
3 讨论
近年来,细胞免疫治疗的兴起特别是CAR-T技术的应用为血液系统恶性肿瘤的治疗带来了重要突破,尤其是CAR-T-CD19治疗复发难治急性B淋巴细胞白血病获得了高达80%~90%的完全缓解率,但是在DLBCL 等B细胞淋巴瘤中CAR-T治疗并未获得类似满意疗效,反应率仅在50%左右,有研究[7]认为这与淋巴瘤复杂的免疫逃逸机制有关。SENEX基因是一种与细胞衰老相关的新型基因,已被证明在心脏、肺、骨骼肌、肾、胰腺、脾脏、脑、睾丸组织和外周血白细胞中都有不同程度表达,主要控制细胞的生长周期、衰老和凋亡,也有研究[4-6,8]称其参与肿瘤的生长和转移。课题组之前的研究[9]表明,SENEX增加会引起促凋亡基因表达减少,细胞因子合成受到干扰,导致调节性T细胞增殖,从而促进膀胱癌的发生和转移;后又在急性髓细胞白血病患者中发现SENEX 基因异常表达且与与骨髓原始细胞的负荷密切相关[10]。但是在DLBCL中SENEX基因的表达及作用目前尚未见相关报道。本研究显示SENEX基因(及其编码蛋白ARHGAP18)在复发DLBCL患者外周血中表达较初诊组升高,且当患者达到完全缓解时,SENEX基因和蛋白表达水平均降低。这个结果提示SENEX基因水平与DLBCL复发密切相关。因此,需要在细胞水平进一步探索SENEX的功能。当在人DLBCL细胞株LY8中沉默SENEX基因表达后,12、24 h的细胞增殖活性也出现降低。结果提示沉默SENEX基因会抑制DLBCL细胞增殖。
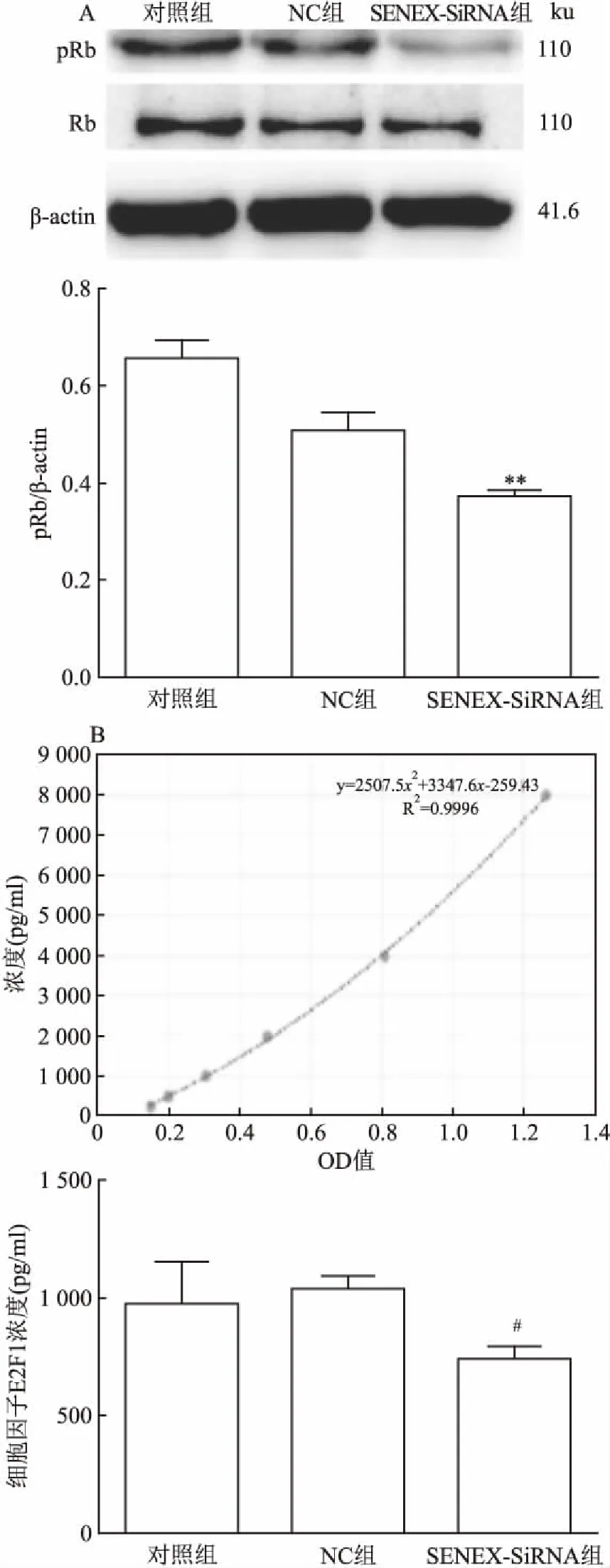
图4 3组细胞中Rb的表达和细胞因子E2F1的浓度
A:Rb在3组细胞中的表达;B:细胞因子E2F1在3组细胞中的浓度;与对照组和NC组比较:**P<0.01;与NC组比较:#P<0.05
Rb基因是最早发现的抑癌基因,被发现于儿童的视网膜母细胞瘤。研究[11-13]认为Rb在细胞周期调控、细胞衰老、细胞凋亡和生长抑制等方面均具有重要作用。Rb以其磷酸化和去磷酸化的形式决定着转录因子E2F的活性,在细胞周期调控中处于中心环节,控制着细胞的生长和分化,Rb蛋白磷酸化(失活)将导致转录因子E2F的释放激活细胞周期进入S期。磷酸化的Rb解离E2F1,游离的E2F1激活细胞周期蛋白,并启动DNA复制和增殖;而去磷酸化的Rb可以通过募集共抑制因子来抑制E2F的转录激活结构域等方式导致细胞生长停滞。有研究[14-15]显示,通过介导Rb/E2F转录调控通路可能调节肿瘤的发生和转移。在课题组的研究中,复发DLBCL患者的pRb水平显著高于初诊组和完全缓解组,但是Rb表达则呈现相反的趋势。之后研究了SENEX基因对DLBCL细胞中pRb/Rb表达的影响,显示SENEX沉默引起pRb水平降低和游离E2F1的显著减少。这些结果表明,SENEX基因诱导的pRb/E2F转录调控通路活化可能在DLBCL的增殖和复发中起重要作用。
综上所述,本研究探讨了SENEX基因在DLBCL中的表达及其对DLBCL复发的影响及其可能的作用机制。结果提示SENEX基因通过活化Rb/E2F1通路促进DLBCL增殖与复发。患者外周血中高水平的SENEX表达可能提示DLBCL复发可能,对于临床预后判断有一定的指导意义。SENEX基因在DLBCL发生发展中的机制研究仍有待深入,未来有望成为治疗DLBCL患者尤其是复发患者的新靶点。

