神经妥乐平对阿尔茨海默病大鼠自噬的影响
赵仲艳,刘 涛,赵二义,黄仕雄,徐志育
阿尔茨海默病(alzheimer disease,AD)是一种进行性发展的神经系统退行性疾病,其发病机制尚不清楚,临床治疗主要以控制精神症状、改善患者认知功能为主[1]。建立相应的动物模型来研究其发病机制,寻找更有效的药物对于AD的治疗具有重要意义。神经妥乐平(neurotropin,NTP)是牛痘疫苗接种家兔后,从其炎症皮肤中提取的一种小分子活性物质[2]。NTP可以调节机体的免疫系统、神经系统等,具有神经修复、抗感染、镇痛等作用,临床常用于腰痛症、肩周炎、变形性关节炎等的治疗[3]。近年来,研究[4]显示,NTP可以调节机体的信号通路,保护神经元损伤。因此,该研究建立AD体外模型,旨在分析NTP对AD大鼠的作用及其具体作用机制,为新药物的开发提供新的思路。
1 材料与方法
1.1 动物、仪器与试剂SPF级SD雄性大鼠45只,体质量220~250 g,由北京维通利华实验动物技术有限公司提供,动物许可证号SCXK(京)2017-0022,饲养于本院动物中心实验室,保持室温恒定为25 ℃,模拟昼夜,自由摄食与饮水。HT-7700透射电镜购自日本日立公司;NTP购自日本Nippon Zoki Pharmaceutical,注册证号 S20140085;β淀粉样蛋白(Aβ1-42)购自美国Sigma公司;TUNEL检测试剂盒购自上海秉新生物科技有限公司;Notch1、NICD、Hes5、Caspase-3、Bcl-2、Bax、Beclin1、LC3-Ⅱ、LC3-Ⅰ单克隆抗体均购自美国Santa Cruz公司;β-actin和辣根过氧化酶(HRP)标记羊抗兔IgG购自DAKO公司。
1.2 动物造模及给药大鼠预饲养1周后,随机均分为对照组、模型组和NTP组。模型组和NTP组每日上午腹腔注射D-半乳糖(100 mg/kg)[5],6周后,模型组和NTP组麻醉后,海马区缓慢注入5 μl β淀粉样蛋白(Aβ1-42),对照组注射等体积生理盐水。若造模后大鼠出现反应迟钝、动作迟缓等,则为造模成功[6]。造模后,NTP组腹腔注射1 ml NTP溶液(1.2 Nu/kg);模型组和对照组腹腔注射等体积生理盐水,连续治疗2周。于治疗后处死大鼠,迅速断头取脑,无菌取大鼠海马组织。
1.3 各组大鼠行为学测试及脑组织病理学检查造模前,将大鼠放入温水中自由游泳5 min,熟悉水迷宫[6]。于术后第10 天至术后第14 天采用Morris水迷宫测试各组大鼠的行为学。定位航行实验:将大鼠从一个象限轻放入水,若120 s内大鼠能找到平台,记录其时间为逃避潜伏期,若120 s后仍未找到,则逃避潜伏期为120 s,连续试验4 d。空间探索实验:实验第5天将平台拿走,将大鼠从一个象限轻放入水,记录120 s内大鼠在原平台象限停留的时间及占总路程的百分比。
1.4 各组大鼠脑组织病理学检查取大鼠海马组织,采用4%多聚甲醛固定,进行常规切片制作,进行HE染色,在光镜下观察组织的病理变化,每张切片随机取5个视野拍照。
1.5 各组海马组织CA1区神经元凋亡的观察取大鼠海马组织,采用4%多聚甲醛固定,进行常规切片,采用TUNEL法进行染色,严格按照试剂盒说明操作,于荧光显微镜下观察细胞凋亡情况,根据阳性细胞数与总细胞数,计算出细胞凋亡率。采用Western blot测定组织中Caspase-3、Bax和Bcl-2的表达量。
1.6 各组海马组织CA1区神经元自噬的观察取大鼠海马组织,采用2.5%戊二醛和2%多聚甲醛的磷酸缓冲液的混合固定液固定,梯度酒精脱水、浸泡、包埋,醋酸铀-枸橼酸铅双染色,电镜下观察。采用Western blot测定组织中Beclin1、LC3-Ⅱ和LC3-Ⅰ的表达量。
1.7 Western blot检测海马组织Notch信号通路的表达取海马区脑组织,匀浆,使用细胞裂解液严格按照蛋白裂解步骤提取总蛋白,采用BCA法进行蛋白定量,取50 ng总蛋白进行SDS-PAGE凝胶电泳,电转膜至PVDF膜,室温密封2 h,采用洗膜缓冲液洗膜并加一抗(稀释比例均为1 ∶ 1 000)4 ℃孵育过夜,洗膜加二抗(稀释比例均为1 ∶ 5 000)室温孵育2 h。再用ECL化学发光显示,选用β-actin作为内参,凝胶图像处理系统分析对比条带强弱。

2 结果
2.1 NTP对AD大鼠学习记忆能力的影响Morris水迷宫试验结果显示:与对照组比较,模型组和NTP组大鼠逃避潜伏期在第2、3 和4 天明显增加(P<0.05),第5天在原象限停留的时间比和路程比明显降低(P<0.05);与模型组比较,NTP组大鼠逃避潜伏期在第2、3和4天明显降低(P<0.05),第5天在原象限停留的时间比和路程比明显升高(P<0.05)。见图1。
2.2 NTP对AD大鼠海马CA1组织病理变化的影响HE染色结果显示,对照组大鼠海马组织细胞结构完整,神经元细胞形态正常;模型组大鼠海马组织大量细胞出现核固缩呈三角形,胞质嗜伊红,正常细胞数减少;NTP组大鼠海马组织细胞形态趋于正常,仅见少量核固缩的细胞。见图2。
2.3 NTP对AD大鼠海马CA1组织凋亡的影响TUNEL结果显示,与对照组比较,模型组和NTP组海马组织细胞的凋亡率明显升高(P<0.05);与模型组比较,NTP组海马组织细胞的凋亡率明显降低(P<0.05)。Western blot实验显示,与对照组比较,模型组和NTP组海马组织Caspase-3、Bax蛋白的表达明显上调(P<0.05),Bcl-2蛋白的表达明显下调(P<0.05);与模型组比较,NTP组海马组织Caspase-3、Bax蛋白的表达明显下调(P<0.05),Bcl-2蛋白的表达明显上调(P<0.05)。见图3。
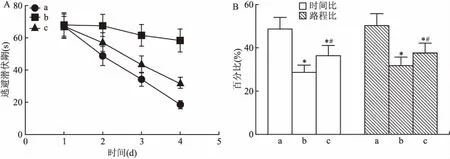
图1 NTP对AD大鼠学习记忆能力的影响
A: Morris水迷宫定位航行实验统计结果;B:水迷宫空间探索实验统计结果;a:对照组;b:模型组;c:NTP组;与对照组比较:*P<0.05;与模型组比较:#P<0.05

图2 NTP对AD大鼠海马组织形态学影响 HE×400
A:对照组;B:模型组;C:NTP组
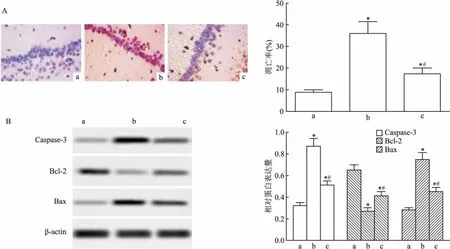
图3 NTP对AD大鼠海马组织凋亡的影响
A:TUNEL染色检测AD大鼠海马组织的凋亡×400;B:Western blot检测蛋白的表达;a:对照组;b:模型组;c:NTP组;与对照组比较:*P<0.05;与模型组比较:#P<0.05
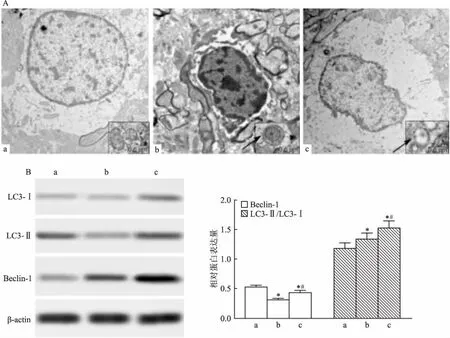
图4 NTP对AD大鼠海马CA1组织自噬的影响
A:电镜检测AD大鼠海马组织的自噬,箭头所指为凋亡小体×20 000;B:Western blot检测蛋白的表达;a:对照组;b:模型组;c:NTP组;与对照组比较:*P<0.05;与模型组比较:#P<0.05
2.4 NTP对AD大鼠海马CA1组织自噬的影响电镜显示,对照组大鼠海马组织细胞结果完整,偶见个别的自噬体;模型组大鼠海马组织的自噬体数量明显增多;NTP组大鼠海马组织的自噬体数量明显减少。Western blot实验显示,与对照组比较,模型组海马组织Beclin-1蛋白的表达明显下调,LC3-Ⅱ/LC3-Ⅰ比例明显上调(P<0.05);与模型组比较,NTP组海马组织Beclin-1和LC3-Ⅱ/LC3-Ⅰ比例均明显上调(P<0.05)。见图4。
2.5 NTP对AD大鼠海马组织Notch信号通路表达的影响与对照组比较,模型组和NTP组大鼠Notch1、NICD和Hes5蛋白的表达明显下调(P<0.05);与模型组比较,NTP组大鼠Notch1、NICD和Hes5蛋白的表达明显上调(P<0.05)。见图5。
3 讨论
AD是一种神经系统退行性疾病,腹腔注射D-半乳糖注射造模是一种最为简便有效的方式,海马区注射Aβ多肽是模拟AD病理损害的一种重要的方法[7]。因此,本研究采用腹腔注射D-半乳糖联合海马区注射Aβ1-42建立大鼠AD模型。NTP干预可以显著缩短AD大鼠在Morris水迷宫试验中延长的逃避潜伏期。Morris水迷宫是常用的评估动物学习记忆能力的实验,包括陈述性记忆和空间参考记忆两个方面,提示NTP干预可以显著改善AD大鼠降低的学习记忆能力。本研究中,NTP干预可以明显改善AD大鼠海马组织的病理损伤。李波 等[8]的研究显示,NTP可以调节中枢神经系统,对于脑缺血、脑水肿、神经痛等具有良好的临床疗效,提示NTP可能通过调节机体的信号通路,改善AD大鼠的学习记忆障碍,减轻脑组织损伤。
本研究中,AD大鼠海马组织的溶酶体和自噬体数量明显增加,经NTP干预后溶酶体和自噬体数量明显减少。临床研究[9]显示,AD患者存在异常增强的自噬作用,可以参与Aβ的产生、转运和清除,参与AD的发生发展,本研究结果与之基本一致,提示NTP可能通过调节自噬,减轻AD的病理损伤。本研究中,NTP干预可以下调AD大鼠海马组织中降低的Beclin1水平,上调LC3-Ⅱ/LC3-Ⅰ的比例。LC3是一种典型的自噬体标志物,在自噬状态下,LC3-Ⅰ会转变为一种膜结合形式即LC3-Ⅱ,临床常用LC3-Ⅱ/LC3-Ⅰ比值来衡量自噬活性;Beclin1是一个参与自噬和调控自噬的关键基因,与自噬吞噬小泡的形成初期有关[10]。Pomilio et al[11]的研究显示,早期诱导自噬可以加快病理蛋白的清除,减轻Aβ的神经毒性,本研究结果与之基本一致,提示NTP可能通过诱导自噬,加快Aβ的清除,减轻AD大鼠的病理损伤。本研究中,NTP干预可以明显下调凋亡蛋白Caspase-3和Bax的表达,上调Bcl-2的表达,降低AD大鼠升高的细胞凋亡率。Zhang et al[12]的研究显示,Beclin-1是可以与Bcl-2等抗凋亡蛋白结合,抑制其抗凋亡作用,本研究结果与之基本一致,提示NTP可能通过调节机体的自噬作用,抑制神经元细胞凋亡,保护脑组织损伤。
Notch信号通路是一种高度保守的信号通路,广泛的存在于脊椎动物和非脊椎动物中,可以参与多种中枢神经系统疾病的发生发展,包括AD、脑缺血损伤等。本研究中,AD大鼠海马组织中Notch1、NICD和Hes5蛋白的表达显著下调,经NTP干预后,表达明显上调。Notch 1是一种单次跨膜受体,与相邻配体结合可以活化γ-分泌酶,促进NICD的释放并与核内的转录因子结合,增强下游靶基因Hes的表达,Hes5是Notch1信号通路的关键靶基因,可以参与调控多个细胞的发育、增殖、凋亡等[13]。Kong et al[14]的研究显示,AD患者的海马组织中Notch1的表达水平显著高于正常组,其机制可能与β淀粉样前体蛋白、早老素等有关,本研究结果与之有所差异,可能是由于本研究采用Aβ1-42建立大鼠AD模型,抑制Notch1的表达,引起神经退行性变化。张丽 等[15]的研究显示,Aβ可以抑制Notch1的表达,抑制神经干细胞的增殖分化,本研究结果与之基本一致,提示NTP干预可能通过激活Notch信号通路,促进神经干细胞分化,提高AD大鼠的学习记忆能力。

图5 各组大鼠海马组织Notch信号通路的表达
a:对照组;b:模型组;c:NTP组;与对照组比较:*P<0.05;与模型组比较:#P<0.05

