含转导域重组神经肽对D-半乳糖致免疫衰老小鼠胸腺功能的影响
刘贞银,梁 阳,欧阳军,郑丹丹,余榕捷,张华华
免疫衰老是指生物体的免疫系统随年龄增加而产生的一系列退化、代偿和重建。免疫衰老的主要历程包括初始 T 细胞的耗竭、胸腺的退化、T 细胞受体的基因多态性消减、记忆/效应 T 细胞累积及衰老的慢性炎症状态。且胸腺的退化和萎缩是免疫衰老过程中最主要的免疫学表现,胸腺退化会直接导致胸腺内初始T细胞的发育障碍以及向外周T淋巴细胞输出减少,从而导致 T 淋巴细胞介导的免疫能力减弱,使机体免疫自稳功能紊乱并加快衰老[1]。胸腺的状态和功能直接影响机体的免疫功能, 胸腺的萎缩是机体免疫衰老的直接原因[2]。垂体腺苷酸环化酶激活肽(pituitary adenylate cyclase activating polypeptide,PACAP)是一种多功能性神经多肽,与其衍生物均具有修复神经损伤、调节神经递质/调质、保护神经细胞作用;参与 T 淋巴细胞分化、增殖以及调节相关免疫功能和维持机体免疫自稳等作用,而这些作用都基于活化的受体刺激细胞内第二信使 cAMP 的产生[3]。已有研究[4]表明,PACAP通过与免疫细胞上特定受体结合,在细胞免疫系统中发挥关键作用。为了使其有更好的稳定性及穿膜能力,利用基因重组制备技术重组神经肽: 含蛋白转导域(protein transduction domain,PTD) 的重组 PACAP(PACAP-PTD)。它是一种介导大分子跨膜的运载工具,能够穿透生物膜,介导各种分子在细胞之间自由传递,而且对机体细胞没有明显不良反应[5]。该研究从初始T 细胞耗竭、胸腺退化的角度展开系统研究,探讨 PACAP 和 PACAP-PTD 对免疫衰老模型小鼠胸腺功能的影响, 初步明确其延缓免疫衰老的作用机制。
1 材料与方法
1.1 材料半乳糖(北京 Solarbio 公司);血液/细胞/组织全基因组 DNA 抽提试剂盒(北京天根公司);丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京建成生物工程研究所);SYBR Green qPCR SuperMix-UDG试剂盒、TRIzol(美国Invitrogen公司);Prime ScriptTMRT reagent 试剂盒、TAKARA TaqTMPCR 试剂盒(日本TaKaRa公司);Anti-mouse CD3-PercpTMCy5.5、CD4-FITC、CD8-PE(美国 BD 公司);ABI 7500型实时荧光定量PCR仪(美国Applied Biosystem 公司);雄性BALB/c小鼠SPF级,许可证号:SCXK(粤)2011-0015,SPF级动物房饲养(南方医科大学实验动物中心);Real-time PCR测定的引物见表1,由上海生工生物合成。
1.2 方法
1.2.1D-半乳糖(D-Gal)致衰老模型小鼠的建立及生物学鉴定 6~8 周龄 BALB/c 雄鼠 30 只(18~22 g)随机分成对照组和模型组,对照组5只小鼠,每天皮下注射生理盐水(500 mg/kg);模型组25只小鼠,注射等量 D-Gal 溶液,连续 42 d。整个实验中小鼠自由饮水进食。最后一次注射后称量小鼠体质量,摘眼球取血,处死小鼠并称取脾脏和胸腺重量。胸腺、脾脏指数(mg/10 g)=脏器重量(mg)/[体质量(g)×10]。分别采用黄嘌呤氧化酶法、TBA 比色法测定血清中 SOD 活性和 MDA 含量。
1.2.2Real-time PCR测定衰老小鼠T细胞中sjTREC含量 D-Gal 致衰老小鼠模型18只,随机分为D-Gal组、PACAP组、PACAP-PTD组,每组6只;PACAP组和PACAP-PTD组分别每天腹腔注射10 nmol/ml PACAP和 PACAP-PTD溶液(12.5 ml/kg),D-Gal组腹腔注射等量的生理盐水,连续注射14 d。
获取胸腺和脾脏淋巴细胞,抽提基因组DNA,进行Real-time PCR反应,建立标准曲线,体系反应的条件:95 ℃ 2 min去UDG,95 ℃ 3 min预变性,95 ℃ 30 s,62 ℃ 15 s,进行50个循环。制备标准以及阳性重组质粒。在同1次反应中,稀释标准重组质粒反应组:108、107、106、105、104、103拷贝/μl,设置标准质粒阴性对照组、TREC片段PCR组、TREC阳性对照组、TREC阴性对照组、RAG2阳性对照组、RAG2片段PCR组,每组均设置两个平行重复。由Real-time PCR反应Ct值和标准曲线得出样本中RAG2和TREC的拷贝数(copies),根据公式:[(TREC copies1 + TREC copies2)/(RAG2 copies1+RAG2 copies2)]×2×106计算出106个细胞中信号结合T细胞受体(T cell receptor,TCR)重排删除环(signal joint T cell receptor rearrangement excision circles,sjTREC)的拷贝数。
1.2.3real-time PCR检测衰老小鼠胸腺功能和状态相关基因表达 获取胸腺和脾脏细胞,抽提淋巴细胞 RNA,设计并合成引物,设置 42 ℃除去基因组 DNA,RNA 反转录成互补 DNA(cDNA),进行逆转录real-time PCR反应,建立扩增曲线,体系反应:95 ℃ 30 s 预变性1次,95 ℃ 5 s,60 ℃ 34 s,40 个循环。在同 1 次反应中,设置样品T 淋巴细胞易位蛋白(LIM domain only 2, LMO2)、白细胞介素-7(interleukin-7, IL-7)、叉头蛋白N1(forkhead box protein N1,Foxn1)、甘油醛-3-磷酸脱氢酶(glyceraldehydE-3-phosphate dehydrogenase, GAPDH)片段PCR组和阴性对照组,每组均设置两个平行重复;PCR反应完成后设定阈值,利用软件输出Ct值;根据比较Ct值法得到不同基因表达比率,公式为:2-ΔΔCt,其中ΔΔCt=(Ct目的基因-Ct管家基因)实验组-(Ct目的基因-Ct管家基因)对照组。
1.2.4流式细胞术检测小鼠全血中CD3、CD4、CD8 加入100 μl EDTA抗凝血于离心管中,用红细胞裂解液2 ml,室温、裂解15 min(1 000 r/min离心5 min),弃上清液;加入 1 ml PBS 缓冲液洗涤2次(1 000 r/min离心5 min);用50 μl PBS缓冲液重悬细胞,细胞悬液移入流式管;每管分别加入2.5 μl Anti-mouse CD3-PercpTM Cy5.5、CD8-PE、CD4-FITC混匀,4 ℃避光孵育30 min;PBS洗涤1次,用4%多聚甲醛400 μl混匀固定样品后,进行FACS Canto Ⅱ流式细胞仪检测。

2 结果
2.1 D-Gal致衰老小鼠动物模型建立成功
2.1.1小鼠的生物学行为和一般状态 小鼠注射D-Gal 溶液建立衰老模型,连续注射42 d后小鼠无死亡。与对照组相比,模型组小鼠呈现明显衰老体征,脊椎渐现隆起,皮肤松弛,体型瘦削,毛发蓬松直竖且稀疏失去光泽,行动迟缓少动且喜蜷缩,对照组小鼠则无相应形态状况。见图 1。
2.1.2小鼠体质量及脾脏和胸腺指数变化 建立模型期间每周称取小鼠体质量,与对照组小鼠比较,模型组小鼠体质量增长较慢。根据主效应和交互效应方差分析的结果显示,不同时间之间体质量有差异(F=30.06,P<0.01);时间与组别之间不存在交互效应(F=1.98,P>0.05);模型组与对照组间体质量无差异(F=10.14,P>0.05)。单独效应分析模型组与对照组做两两比较,从 35 d起模型组小鼠与对照组相比体质量有差异(35 d:t=5.02,P<0.01;42 d:t=6.40,P<0.01)。见图2。建模完成后,模型组小鼠的胸腺及脾脏指数均低于对照组 (P<0.01)。见表2。
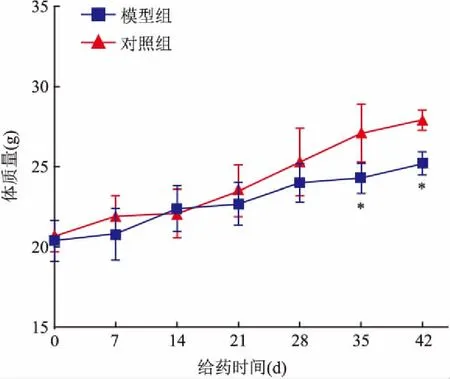
图2 模型组与对照组小鼠体质量变化
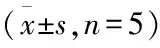
表2 模型组与对照组小鼠胸腺和脾脏重量及指数的比较
与对照组比较:*P<0.01
2.1.3小鼠血清中SOD活力和MDA含量变化 与对照组比较,模型组小鼠血清中SOD活力下降,MDA含量升高,确定建模成功。见表3。

表3 D-Gal致衰老小鼠血清中SOD活力和MDA含量变化
与对照组比较:*P<0.01
2.2 衰老模型小鼠T细胞中sjTREC含量结果
2.2.1Real-time PCR反应 Real-time PCR反应后核酸扩增过程中的动力学曲线呈S型,熔解曲线为单一峰,证明了产物的特异性。见图3。
2.2.2标准曲线 用梯度稀释标准质粒的Ct值为纵坐标(Y),标准质粒浓度自然对数为横坐标(X),得到一条直线型标准曲线,并获得一元回归方程:Y= -3.33X+43.05,斜率为-3.33,R2=0.999。保证了此方法的准确性。见图4。
2.2.3Real-time PCR测定sjTREC含量的结果 经公式可以计算出各个样本相同细胞数目中的TREC copies,从而进行样本间的比较。Real-time PCR检测显示,与D-Gal组比较,PACAP组和PACAP-PTD组胸腺(F=27.24,P<0.01)和脾脏(F=59.90,P<0.01)T淋巴细胞中sjTREC含量上升(P<0.01)。PACAP组和PACAP-PTD组比较,胸腺(P<0.01)和脾脏(P<0.05)中sjTREC含量上升,差异有统计学意义。见图5。
2.3 衰老小鼠胸腺功能和状态相关基因表达结果
2.3.1Real-time PCR扩增 Real-time PCR反应最后可得到反应核酸扩增过程的S型动力学曲线和熔解曲线。扩增曲线呈S型,不同基因表达的熔解曲线为单一峰,证实了产物的特异性。见图6。

图3 Real-time PCR结果
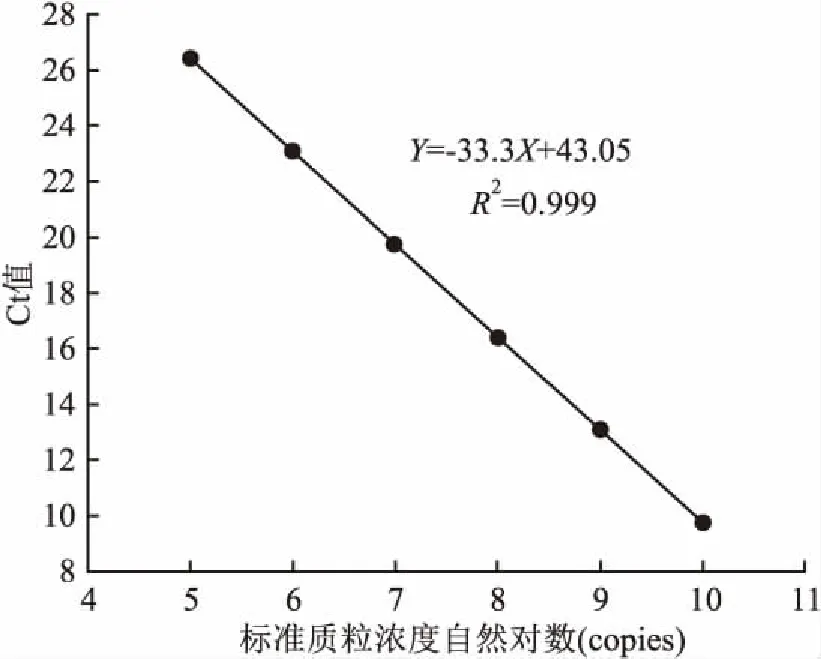
图4 标准曲线
2.3.2LMO2、Foxn1及IL-7基因表达 Real-time PCR检测发现与D-Gal组比较,PACAP组和PACAP-PTD组胸腺LMO2基因表达下调(F=82.962,P<0.01),IL-7和Foxn1基因表达均上调(F=348.86,P<0.01;F=219.11,P<0.01)。PACAP-PTD组较PACAP组IL-7和Foxn1基因表达上调差异大(P<0.01),LMO2基因的表达下调差异有统计学意义(P<0.05)。见图7。

图5 Real-time PCR测定胸腺和脾脏淋巴细胞中sjTREC水平
与D-Gal组比较:**P<0.01;与PACAP组比较:#P<0.05,##P<0.01
2.4 小鼠全血中CD3、CD4、CD8变化
2.4.1CD3+CD4+/CD3+CD8+检测 利用PercpTMCy5.5、FITC、PE 分别标记CD3+、CD4+、CD8+T细胞,流式分析结果表明PACAP组和PACAP-PTD组小鼠全血中CD3+CD4+T细胞比例均高于D-Gal组;PACAP组CD3+CD8+T细胞比例低于D-Gal组;PACAP-PTD组CD3+CD8+T细胞比例高于D-Gal组。见图8。

图6 Real-time PCR 扩增结果
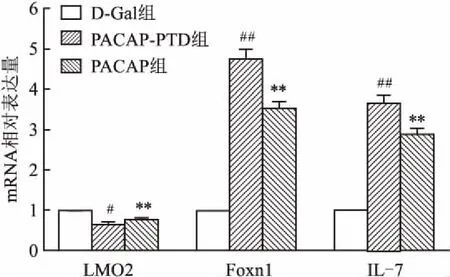
图7 Real-time PCR检测基因LMO2、Foxn1及IL-7的表达结果
与D-Gal组比较:**P<0.01;与PACAP组比较:#P<0.05,##P<0.01
2.4.2流式细胞仪检测全血中CD3+CD4+/CD3+CD8+比值结果 与D-Gal组比较,PACAP组和PACAP-PTD组CD3+CD4+/CD3+CD8+比值均上调(F=13.88,P<0.01)。而PACAP组和PACAP-PTD组比较,差异无统计学意义(P>0.05)。见图 9。
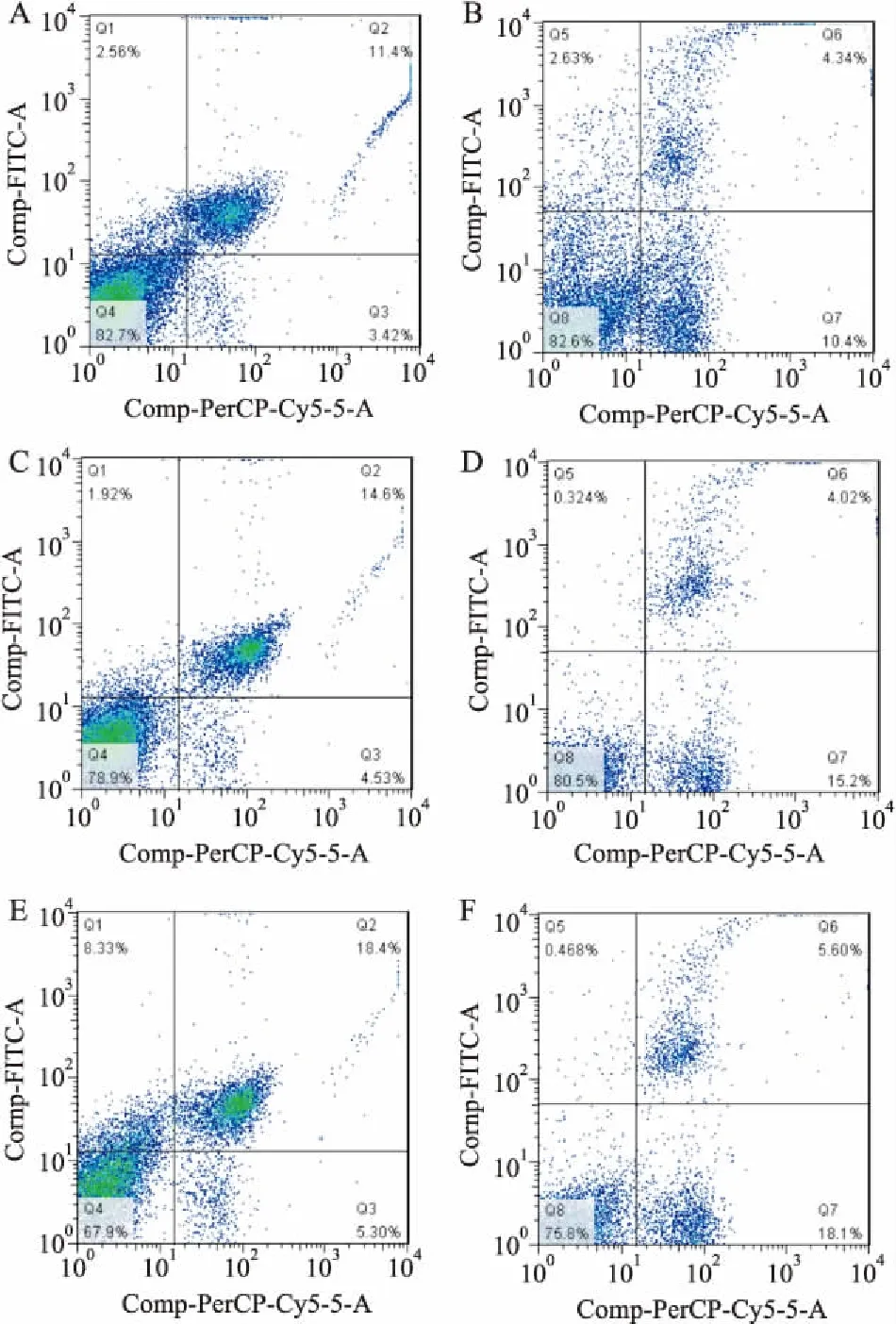
图8 CD3、CD4、CD8 T细胞表型变化
A:D-Gal组CD3+CD4+T细胞含量;B:D-Gal组CD3+CD8+T细胞含量;C:PACAP组CD3+CD4+T细胞含量;D:PACAP组CD3+CD8+T细胞含量;E:PACAP-PTD组CD3+CD4+T细胞含量;F:PACAP-PTD组CD3+CD8+T细胞含量

图9 流式细胞仪检测全血中CD3+CD4+/CD3+CD8+比值
3 讨论
胸腺作为机体重要的中枢免疫器官,是T淋巴细胞分化、发育、成熟和输出至外周T淋巴细胞库的场所,因此初始T细胞的数目可以评价胸腺T淋巴细胞生成和输出功能。而sjTREC是在TCRα基因重组过程中,在TCRδ基因两侧的删除片段δRec和ψJα之间重组形成一个环状DNA分子而被删除,其含量在胸腺组织近期产生的T淋巴细胞群体中最高,在细胞中稳定存在且不随细胞分裂而复制,能够代表形成功能性TCR时初始T细胞的数量。因此,检测sjTRECs的含量能真实的评价胸腺的输出功能状态,现已成为基础和临床研究中重要的胸腺功能免疫学指标[6]。D-Gal诱导的衰老模型是目前较经典的衰老动物模型,接近于自然衰老规律[7]。本研究成功建立D-Gal致免疫衰老小鼠模型,胸腺功能发生破坏性降低。本研究中,PACAP组和PACAP-PTD组小鼠胸腺和脾脏的初始T细胞的数量较D-Gal组均增加,表明胸腺的生成和输出功能均提高,向外周T淋巴细胞输出增多,维持外周T细胞受体库多样性。证实PACAP和PACAP-PTD可以保护胸腺器官的功能性,恢复退化的胸腺功能,延缓胸腺相关的免疫衰老。同时,PACAP-PTD较PACAP对胸腺初始T细胞生成和输出能力更有效。
胸腺退化是机体衰老的重要生物学标志,过程涉及复杂的基因表达变化。胸腺的各种功能主要是由胸腺微环境调节和显现的。胸腺微环境主要由胸腺细胞和胸腺上皮细胞组成,并为细胞发育提供关键的细胞因子同时还可能对胸腺选择有着调控与支持的作用。LMO2是一种T细胞原癌基因,蛋白质的过度高水平表达会导致T淋巴细胞过度增殖[8]。IL-7是胸腺早期维持T细胞的生长因子,确保胸腺T细胞增加输出到外周库,延缓胸腺萎缩和增强免疫反应[9]。Foxn1转录因子是调节胸腺上皮细胞发育的主要因子,其低表达会促进胸腺萎缩和免疫缺陷[10]。因此选择以上几个胸腺微环境相关的基因进行分析,进而有效的评价小鼠胸腺的状态和功能。本研究中,PACAP组和PACAP-PTD组小鼠Foxn1基因上调,表明小鼠胸腺微环境中的胸腺上皮细胞活性和功能增强,胸腺微环境受到保护;IL-7基因上调可维持胸腺功能性和稳定状态,保护胸腺微环境,增加外周T细胞的输出;而其负调控因子基因LMO2表达下调,表示胸腺细胞在发育过程当中受负调控影响下降,胸腺细胞可正常发育。证实PACAP和PACAP-PTD可以使退化的胸腺功能得以回复,扭转胸腺萎缩,延长细胞免疫功能。
胸腺经过对T细胞的驯化、选择建立机体自身免疫耐受和维持免疫自稳。而T细胞亚群首要有CD3+CD4+的辅助性T细胞和CD3+CD8+的细胞毒性T细胞等,CD4+T细胞是协调B细胞产生抗体;CD8+T细胞则是抑制抗体合成、分泌及T淋巴细胞的增殖,它们的稳态维持机体日常的免疫应答。T细胞亚群可反映机体细胞免疫的水平,是目前临床上较常用的反映免疫功能状态的指标[11]。本研究中PACAP组和PACAP-PTD组小鼠全血中CD3+CD4+T细胞比例升高,表明调控免疫反应最重要的枢纽细胞增多;CD3+CD8+T细胞比例降低,表明免疫反应中直接杀伤性细胞减少;CD3+CD4+/CD3+CD8+比值反映机体T细胞亚群的状态,比值升高表明机体T淋巴细胞免疫功能增加。证实PACAP和PACAP-PTD具有调节机体免疫功能,维持免疫平衡的作用。
总之,本研究以D-Gal致免疫衰老小鼠为模型,探讨PACAP和PACAP-PTD通过延缓模型小鼠胸腺的萎缩,调节机体细胞免疫功能而发挥延缓衰老和免疫保护的作用。其中,PACAP和PACAP-PTD改变了退化的胸腺功能状态与微环境,从多个指标的检测中体现了其延缓衰老和调节细胞免疫功能作用。因此,阐明PACAP和PACAP-PTD延缓衰老小鼠胸腺萎缩的作用机制可望成为相关免疫衰老疾病的治疗或辅助治疗药物。

