AKT1S1-pBABE重组逆转录病毒载体的构建及其稳定过表达细胞系的筛选
廖生洁,万象殊,李林强,何文熙,陈雨露,王晓珂,吕先凤
(湖北理工学院 肾脏疾病发生与干预湖北省重点实验室,湖北 黄石 435003)
富含脯氨酸AKT1底物蛋白(proline-rich AKT1 substrate of 40 kDa,PRAS40)是AKT1激酶的底物,故命名为AKT1S1(AKT1 Substrate1)[1]。经蛋白序列测序鉴定其富含脯氨酸分子质量约为40 kD。AKT1S1基因编码序列在人、黑猩猩和大鼠等高等生物中非常保守,因而提示其基因功能非常重要[2]。
AKT/mTOR复合物(mTOR Complex 1,mTORC1)通过促进mRNA翻译的启动效率来提高蛋白质合成速率,同时还能刺激一些特异性基因转录,从而促进细胞生长过程[3-4]。mTORC1的表达失调在肿瘤发生和发展过程中扮演着重要角色。研究表明,超过80%的人类癌症都伴随着 mTORC1信号通路的失调和紊乱[5]。所以,关于 mTORC1信号通路调控方面的科学研究将对肿瘤的发生和治疗具有极大的帮助。
磷酸化修饰是生物体内常用的蛋白功能激活方式,通常由具备磷酸化激酶的蛋白通过识别特异性底物,并实施磷酸化,激活或抑制靶标蛋白质的活性[6]。AKT激酶是一类具有磷酸激酶活性的蛋白质家族,AKT1能够使得 AKT1S1发生磷酸化,使其从mTORC1复合体中解离出来。AKT1S1的解离能够抑制mTORC1活性,并达到抑制mTORC1信号通路的目的[7-8],在肿瘤的发生与治疗中意义重大。但是,到目前为止,对于AKT1S1的功能认识还比较局限,特别是AKT1S1的相互作用蛋白鉴定以及其蛋白稳态的调控机制都是未知的。
本文通过构建AKT1S1稳定表达细胞系,使用免疫沉淀联合蛋白质质谱联用技术,揭示AKT1S1的相互作用蛋白质谱,鉴定能够调控AKT1S1稳态的关键蛋白,从而挖掘可用的mTORC1信号通路调控靶点。此外,在人胚肾细胞系293T细胞中成功构建Flag-AKT1S1过表达细胞系,为研究AKT1S1下游功能,揭示AKT1S1蛋白质互作网络,研发可用于调控mTORC1信号通路的分子靶点打下坚实基础。
1 试验方法
1.1 质粒构建
通过TRIZOL法进行293T细胞总RNA的抽提,采用琼脂糖凝胶电泳检测RNA的抽提质量,使用RNA反转录试剂盒(货号:D7166,上海碧云天生物技术有限公司)将RNA反转录为cDNA,用设计好的AKT1S1引物(F:AATGGATCC ATGTCTTTTGAGGGCGGTGA;R:AATGTCGAC TCAATATTTCCGCTTCAGCTT)进行PCR,扩增AKT1S1基因的CDS序列,使用BamH1和Sal1对胶回收过的PCR产物和pBABE-Flag质粒进行双酶切,使用T4-连接酶进行酶连,转化大肠杆菌感受态(TOP10),涂平板后挑取单克隆菌体,使用双酶切方法进行验证。验证通过后,将质粒送公司测序。
1.2 细胞培养
将293T细胞和p293T细胞置于含10%胎牛血清的DMEM培养基中,将培养瓶放置于温度为37 ℃、CO2浓度为5%的细胞培养箱中培养。
1.3 AKT1S1稳定过表达细胞系的构建
将构建好的Flag-AKT1S1-pBABE质粒与辅助质粒VSVG和GAGPOL转染p293T细胞,包装慢病毒载体,收取48 h的细胞培养基上清液,将上清液与加入胎牛血清的高糖培养基1∶1混合,加入1 μg/mL的凝聚胺(Polybrene)侵染293T细胞,24 h后,更换加入胎牛血清的高糖培养基2 mL,同时加入1.5 μg/mL嘌呤霉素(Puromycin)筛选,收取细胞样品进行Western Blot检测。
1.4 蛋白质免疫印迹试验(Western Blot)检测目标蛋白的表达
收取细胞样品,PBS清洗2次后,使用细胞裂解液进行裂解,将裂解液置于沸水浴中煮样10 min。 使用SDS-PAGE电泳分离蛋白样品,其中分离胶丙烯酰胺浓度为12%,100 V电泳。待蛋白进入浓缩胶后,更改为150 V电泳40 min。将蛋白样品转膜至NC膜,加入5%脱脂奶粉进行封闭1 h,加入一抗四度孵育过夜(一抗Flag,Sigma-Aldrich LLC.,货号F1804;ACTB,武汉三鹰生物有限公司,货号60008-1-Ig),使用PBST洗涤4次,每次5 min,常温孵育二抗(碧云天生物技术有限公司,货号A0192)1 h,在化学发光仪上检测目标蛋白的表达。
2 试验结果
2.1 cDNA的获得和AKT1S1基因的克隆
根据NCBI数据库中不同组织的转录组数据比较可以得知,AKT1S1在肾组织中高度表达。选取人胚肾细胞系293T细胞进行了总RNA的抽提,同时,分别使用RNA抽提试剂盒和传统的TRIZOL法抽提RNA。2种不同的RNA抽提方法的提取结果如图1所示。由图1可知,使用TRIZOL法抽提得到的RNA背景干净,无基因组污染和降解。因此,使用TRIZOL法获得的总RNA通过逆转录可得到cDNA,使用设计好的引物从cDNA里扩增AKT1S1基因的编码(CDS)序列,可成功从人胚肾细胞系中克隆到AKT1S1基因的CDS序列。
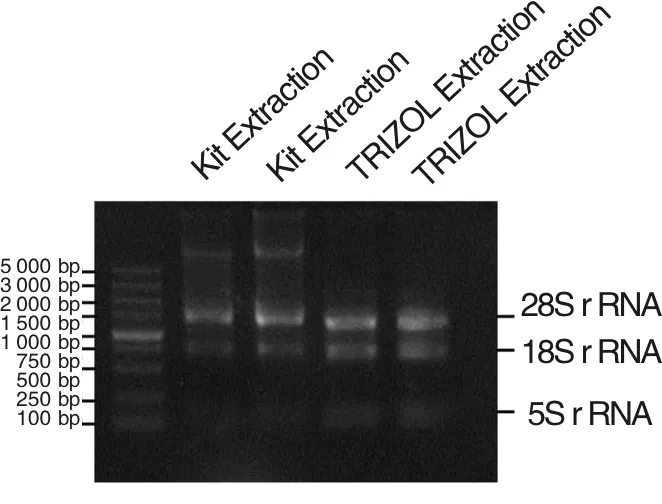
图1 2种不同的RNA抽提方法的提取结果
2.2 载体构建
pBABE-Flag载体是一种高效的重组逆转录病毒载体,经过基因工程改造后具备很高的转染效率,且毒性低。其载体中的LTR序列能够帮助DNA片段发挥转座效应,插入细胞基因组。基于载体上带有抗嘌呤霉素的表达元件,若表达载体顺利插入细胞基因组,该细胞将能够在含嘌呤霉素的培养基中正常生长。
使用胶回收试剂盒对扩增出来的AKT1S1-CDS核酸片段进行凝胶电泳和目标基因片段的胶回收之后,采用BamH1和Sal1分别对AKT1S1-CDS核酸片段以及pBABE-Flag载体进行双酶切,使得片段与载体暴露出相同的2个粘性末端,通过T4-DNA连接酶,将AKT1S1-CDS核酸片段插入至pBABE-Flag载体的多克隆位点中,使酶连产物转化至E. coli TOP10大肠杆菌中,再从大肠杆菌中抽提质粒,进行BamH1和Sal1双酶切验证。Flag-AKT1S1-pBABE质粒的构建如图2所示。图2(a)表示从cDNA库中对AKT1S1进行基因克隆;图2(b)表示构建的Flag-AKT1S1-pBABE质粒使用BamH1和Sal1进行双酶切验证;图2(c)表示Flag-AKT1S1-pBABE质粒使用pBABE-5通用引物测序的部分测序结果,其中下划线标红色为BamH1酶切位点,下划线标绿色为AKT1S1的起始密码子。
由图2(b)可知,凝胶电泳方法检测到AKT1S1-CDS核酸片段从pBABE-Flag载体中切割出来,提示AKT1S1-CDS核酸片段成功插入至pBABE-Flag载体。最后,使用pBABE-Flag载体通用引物pBABE-5进行DNA碱基一代测序,发现AKT1S1-CDS核酸片段确实插入至pBABE-Flag载体,将测序所得到的AKT1S1-CDS核酸片段与NCBI数据库中的核酸序列进行碱基比对结果显示,AKT1S1-CDS核酸片段无碱基突变,说明Flag-AKT1S1-pBABE质粒构建成功。

(a) 基因克隆
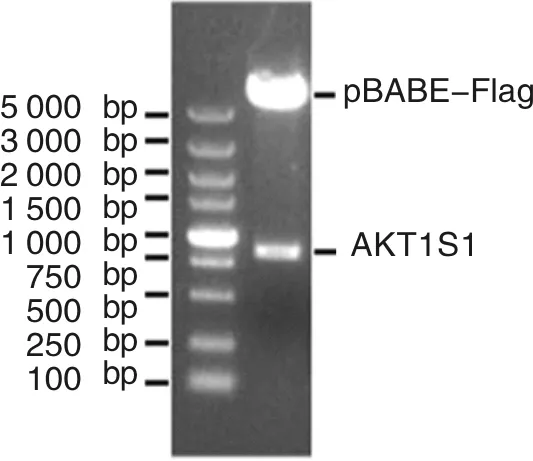
(b) 双酶切验证
2.3 稳定过表达细胞系的筛选
p293T细胞具有较高的病毒包装能力,将构建好的Flag-AKT1S1-pBABE质粒与辅助质粒VSVG和GAGPOL转染p293T细胞,包装慢病毒载体。收取包装好的细胞培养基上清液侵染293T细胞,同时加入1.5 μg/mL Puromycin筛选,5 d后,没有加入侵染液的293T细胞全部死亡,而侵染病毒包装质粒的试验组中的部分细胞生长状态良好,提示带 Puromycin抗性基因的DNA片段成功整合至基因组。Flag-AKT1S1稳定表达细胞系的鉴定如图3所示。在Flag-AKT1S1-pBABE质粒中,3xFlag肽段的编码序列与AKT1S1编码序列共享同一个启动子,表达的这2个蛋白质为融合蛋白,所以收取细胞样品。裂解后使用蛋白质免疫印迹方法检测Flag肽段,可以看到在40 kD大小位置附近有明显的蛋白质表达条带,且大小与预期相符,提示Flag-AKT1S1融合蛋白成功表达,即稳定过表达细胞系筛选成功。

图3 Flag-AKT1S1稳定表达细胞系的鉴定
3 分析与讨论
AKT1S1能够调控 mTORC1信号通路,从而在肿瘤的发生和发展过程中扮演重要角色。经典的基因功能研究通常是围绕基因过表达展开,观察目的基因在某一细胞系或者模式生物中高度表达后产生何种生物学性状。但是该方法受制于脂质体的细胞毒性,蛋白表达丰度低,以及瞬时转染效率低,存在一定的局限性。基因稳定过表达细胞系筛选逐渐成为了科研工作者的首选。为了获得AKT1S1过表达细胞系,选择将AKT1S1编码序列构建至pBABE-Flag质粒中。pBABE-Flag质粒属于重组逆转录病毒载体,具备LTR转座元件。该元件能够帮助DNA片段发挥转座效应,进而插入细胞的基因组中,达到稳定过表达的目的。同时,质粒还带有嘌呤霉素抗性基因,将包装好的病毒进行细胞侵染后,在培养基中添加嘌呤霉素进行定向筛选,能够显著提高阳性细胞的筛选效率。
4 结论
在293T细胞中成功地克隆到AKT1S1基因,并且将该基因克隆至pBABE-Flag质粒中,通过细胞转染和嘌呤霉素筛选,获得了Flag-AKT1S1融合蛋白的稳定过表达细胞系,为下一步鉴定AKT1S1相互作用蛋白质谱、筛选能够调控AKT1S1稳态的关键蛋白、挖掘可用于调控mTORC1信号通路的分子靶点打下了坚实基础。
——一道江苏高考题的奥秘解读和拓展

