过渡金属氧化物去除水中砷的研究进展
袁露成,龚 傲,吴选高,黄林青,田 磊,徐志锋
(江西理工大学 冶金与化学工程学院,江西 赣州 341000)
自然界中,砷主要伴生于铜、铅、镍、钴等金属硫化矿物中[1]。自然环境下砷较为稳定,只随含砷岩石风化和火山活动,从自然砷源中缓慢释放;但随着人类活动和冶金工业的快速发展,自然矿物中稳定砷的释放量日益增加,每年排入环境中的砷约有120万t[2-3]。水中大多数的砷主要以2种无机物形式存在:在中性pH和厌氧条件下,As(Ⅲ)(亚砷酸盐)占主导;氧化条件下,As(Ⅴ)(砷酸盐)占优势。
砷化合物有剧毒,对所有的生命形式均有危害,世界卫生组织将此元素列为第Ⅰ类人类致癌物质。对砷的摄入一般是通过食用被砷污染的水或食物,或者接触被砷污染的空气。目前已有许多有关砷污染方面的研究,已证实人体长期摄入质量浓度超过50 μg/L的无机砷会导致慢性中毒,造成各种皮肤损伤(色素沉着过度,角化过度等)和癌症,严重危害人体健康[4]。所以,水溶液中砷的捕收和处理已成为国内外重点关注的问题之一。目前,从水溶液中去除砷的方法主要有氧化、膜分离、生物处理、沉淀、吸附等[5-6],但这些方法都存在一定局限性,有其特定的适用范围。目前,使用较多的是吸附法,其中,过渡族金属氧化物因对砷化合物有优良的吸附性能而被大量使用[7]。
过渡族金属氧化物除砷研究一直是国内外关注的热点。目前研究的过渡金属主要是第Ⅳ周期自身不呈现重金属污染的金属。本文总结了近年来过渡金属氧化物去除水中砷的研究进展及其反应机制。
1 钛族材料除砷
1.1 TiO2材料
TiO2毒性低,化学和物理稳定性好,易于获得,制备成本低,对环境友好,并且对2种形式的无机砷均具有高亲和力,在光照条件下具有特殊价电性质,对砷有催化氧化和结合除杂作用。文献[8-10]介绍,现有研究用于除砷的主要有TiO2(纳米)颗粒,含水TiO2及与其他材料混合、结合而制成的碳氮化钛、铁钛氧化物、钛酸盐纳米管,颗粒TiO2和水解TiO2浸渍的壳聚糖珠、活性炭与纤维布等材料。
Dutta等[11]研究了2种市售二氧化钛(TiO2)悬浮液Hombikat UV100(平均初级粒径<10 nm)和Degussa P25(平均初级粒径30 nm)对As(Ⅴ)和As(Ⅲ)的吸附行为。Hombikat UV100粒径小,比表面积大,对砷的吸附量更多:在pH=4条件下,对As(Ⅴ)(22.5 mg/g)的吸附量大于对As(Ⅲ)的吸附量;而在pH=9时,对As(Ⅲ)(43.1 mg/g)的吸附量大于对As(Ⅴ)的吸附量。这与不同pH条件下TiO2表面电荷和砷的价态变化有关。在酸性条件下,优先吸附As(Ⅴ)(砷酸盐);在光照条件下,TiO2将As(Ⅲ) 催化氧化为As(Ⅴ)进而吸附去除砷;在碱性条件下,优先吸附As(Ⅲ) (亚砷酸盐)。另外,在pH大于等电点pH时吸附量降低,可通过提高pH使TiO2再生重复利用。
新制备的纳米材料通常会具有更好的反应活性。Xu Z.等[12]借助TiCl4溶液水解法制备粒径3~8 nm的含水TiO2。所制备TiO2为多结构聚集体,可用作As(Ⅲ)吸附剂,无须在吸附前将As(Ⅲ)氧化成As(Ⅴ)或进行任何pH调节。在接近中性pH条件下,As(Ⅲ)最大吸附量可达83 mg/g;在pH=9 条件下,最大吸附量为96 mg/g。TiO2的高吸附能力与高比表面积、大孔体积、高亲和力表面羟基的存在有关。
王坤[13]研究了pH和UV光照条件对TiCl4混凝除砷的影响及对TiO2(试剂)吸附除砷的影响。在有、无UV光催化条件下,TiCl4/TiO2将As(Ⅲ) 氧化为As(Ⅴ)的速率都随pH升高而加快;UV光照下,TiO2的催化氧化速度比TiCl4的快,完全氧化只需5 min左右。砷去除率都随pH升高而降低。UV光照下,随pH从5升至9,TiCl4对As(Ⅲ)的去除率从99%降至35%。
高比表面积TiO2吸附除砷效果更好,但也造成颗粒低能垒而容易团聚。这个缺点可通过浸渍、表面涂覆或添加不同类型的表面活性剂、掺杂纳米粒子等方法来解决。
Miller等[14]合成了一种浸渍的壳聚糖微珠(TICB)(壳聚糖70.2%,Ti 29.8%),可有效除砷并简化后处理过程。批次试验中,TICB可以去除As(Ⅲ) 2.198 mg/g和As(Ⅴ) 2.050 mg/g。当系统在紫外线照射下,可以去除As(Ⅲ) 6.400 mg/g和As(Ⅴ) 4.925 mg/g。紫外线照射下,TICB对砷的吸附能力提高,这与其表面积增大及表面变化有关。Liu H.等[15]研究制备了涂覆有纳米TiO2薄膜的纳米碳管(CNT)网络过滤器,涂覆钛后,纳米碳管比表面积达196 m2/g。施加外加电势后,覆钛纳米碳管去除饮用水中砷的能力大大提高:外加0 V电压,As(Ⅴ)吸附量为0.8 mg/g,As(Ⅲ)吸附量为1.6 mg/g;外加2 V电压,As(Ⅴ)吸附量为1.3 mg/g,As(Ⅲ)吸附量为1.8 mg/g。吸附方式与TiO2晶体一致[16]且吸附行为符合Freundlich等温吸附模型。
1.2 ZrO2材料
锆与钛为同一副族元素,一些化学物理特性、化学行为类似,也具有化学稳定性、无毒和不溶等性质。锆基氧化物也是饮用水净化的一种选择吸附剂。
Zheng Y.M.等[17]通过试验证明了氧化锆纳米粒子可不进行预氧化就能有效去除As(Ⅲ)。溶液pH对吸附影响最大,pH=8时吸附效果最好。动力学研究结果表明,大部分砷在吸附开始的10 h内完成,在48 h内达到吸附平衡。吸附过程可用伪二阶吸附动力学模型很好地解释,颗粒内扩散控制吸附过程。热力学研究结果表明,吸附行为符合Langmuir模型,As(Ⅲ)最大吸附量为1.85 mmol/g。
Hang C.等[18]采用水热法合成了粒径6~10 nm 的水合氧化锆(ZrO2·xH2O)。所合成水合氧化锆表面积为161.8 m2/g,为多孔聚集体。试验结果表明:在砷平衡质量浓度为0.01 mg/L时,氧化锆纳米颗粒在pH=7时对As(Ⅲ)和As(Ⅴ)的吸附量分别为0.6、3.6 mg/g;砷的平衡质量浓度较高(>42 mg/L)时,As(Ⅲ)和As(Ⅴ)吸附量分别大于47、29 mg/g;吸附机制为内球配合,2种形式无机砷均在ZrO2表面形成内球表面复合物。
2 铁材料除砷
零价铁粉对大多数重金属有较高的吸附能力。零价铁来源丰富、价格低廉,对于从水溶液中快速去除污染物有较好的效果。零价铁对As(Ⅲ)有氧化、吸附和共沉淀等作用,砷去除率可达90%以上[19-22]。
2.1 零价铁材料
纳米铁可以有效去除污染水体中的砷。Klimkova等[21]研究表明,零价铁纳米颗粒(Nanofer 25S)可用以处理铀地浸后的酸性矿井水。Nanofer 25S颗粒加入后,矿井水氧化还原电位降低,污染物(As、Be、Cd、Cr、Cu、Ni、U、V和Zn)浓度都下降。
Kanel等[23]合成了纳米零价铁(nZVI),并通过SEM-EDX、AFM和XRD表征了处理前后nZVI的粒径、表面形态和腐蚀层。结果表明:合成的nZVI粒径为1~120 nm;nZVI在60 d内逐渐转变为与纤铁矿混合的磁铁矿/磁赤铁矿腐蚀产物;用nZVI吸附As(Ⅲ)时,吸附速率很快,几分钟内反应即达到平衡,反应遵循伪一级动力学方程。批次试验证实了用nZVI吸附地下水中的As(Ⅲ)是可行的,初始As(Ⅲ)浓度和地下水酸碱度(pH=3~12)对吸附过程影响较大;用Freundlich吸附等温模型计算批量数据,As(Ⅲ)最大吸附量为3.5 mg/g。激光散射(电泳迁移率测量)证实As(Ⅲ)在nZVI上的吸附为内球表面配合。
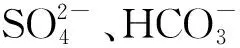
Ramos等[26]用高分辨率X射线光电子能谱研究发现:零价铁在溶液中会自发氧化,形成铁核与FeOOH外壳组成纳米颗粒;nZVI与As(Ⅲ)在纳米颗粒表面生成As(0)、As(Ⅲ)和As(Ⅴ),这说明,nZVI将As(Ⅲ)还原为As(0),而FeOOH外壳将As(Ⅲ)氧化为As(Ⅴ),FeOOH对As(Ⅲ)和As(Ⅴ)都具有很强的吸附能力。这种中心核为ZVI具有氧化物外层赋予了纳米零价铁颗粒独特的除砷性能[26]。
2.2 氧化铁材料
磁性材料吸附除杂是通过磁力把吸附有杂质的吸附剂从介质中分离出来。氧化铁在化学、物理和材料科学领域中有重要作用。除了具有合适的磁性能、低毒性和低价格等优点外,氧化铁纳米颗粒还具有较高的比表面积。纳米γ-Fe2O3比微米级氧化铁的除砷效果高5~10倍[27]。
Cheng W.等[28]研究采用蚀刻法制备初级粒径约4 nm、比表面积高达317 m2/g的纳米级氧化铁,并用于从水中去除As(Ⅲ)和As(Ⅴ)。纳米氧化铁在pH=6~8和pH=2~4范围内可分别有效去除As(Ⅲ)和As(Ⅴ)。对As(Ⅲ)和As(Ⅴ)的最大吸附量分别为42和83 mg/g,吸附过程符合Langmuir等温吸附模型。杂质离子磷酸根和硅酸根的存在会降低砷去除率,而其他共存阴离子对砷的去除影响不大。H2O2催化氧化可促进As(Ⅲ)的去除。Prasad等[29]用从冷轧机中获得的主要成分为菱面体相的α-Fe2O3细粉作吸附剂,研究从水中去除As(Ⅲ)。反应120 min达到吸附平衡;反应60 min时,As(Ⅲ)吸附量是平衡时的60%~80%;平均粒径为90 nm的α-Fe2O3粉末对As(Ⅲ)的吸附性能最好,吸附率随初始pH降低而提高;吸附过程符合Langmuir等温吸附模型,单层吸附能力为1.94 mg/g。
Bangari等[30]研究合成了氮化硼纳米片(BNNS)和Fe3O4官能化纳米复合材料(BNNS-Fe3O4)并用于从水中除As(Ⅴ)。结果表明:BNNS-Fe3O4的比表面积为119 m2/g,饱和磁化强度为49.19 emu/g,室温下有很强的磁性,通过施加外部磁场极易将BNNS-Fe3O4与溶液分离;BNNS-Fe3O4可以将As(Ⅴ)从溶液中吸附去除,去除率达98.83%;As(Ⅴ)在BNNS和BNNS-Fe3O4上的吸附分别是物理吸附和化学吸附;BNNS-Fe3O4对As(Ⅴ)的最大吸附量为26.3 mg/g,是未修饰BNNSs对As(Ⅴ)最大吸附量(5.3 mg/g)的5倍。
Liu C.H.等[31]通过宏观吸附试验,结合热力学计算和基于同步辐射的X射线吸收光谱的显微光谱表征,研究了As(Ⅴ)和As(Ⅲ)在磁铁矿纳米颗粒上的吸附机制。结果表明:As(Ⅴ)和As(Ⅲ)均仅在磁铁矿纳米颗粒表面形成一种单层复合物理吸附,反应过程中吸热且符合Langmuir等温吸附模型;在磁铁矿纳米颗粒表面,As(Ⅴ)形成双齿双核角共享配合物,As(Ⅲ)形成三齿六核角共享配合物;As与磁铁矿纳米颗粒表面之间形成内球复合物。
3 MnO2材料除砷
自然条件下的废水中的砷以As(Ⅲ)与As(Ⅴ)2种价态存在。非离子型As(Ⅲ)的去除较为困难,须将其氧化为As(Ⅴ)[32],但使用氧化剂会增加成本,并造成二次污染。
Panda等[33]研究制备了被锰氧化物(Mn3O4-MnO2)层包裹的零价锰(ZVM)芯材料。这种材料在较宽pH范围下可以有效去除As(Ⅲ)和As(Ⅴ), 最大吸附量分别为30.9 和72.5 mg/g,吸附动力学和吸附等温线分别遵循伪二级动力学模型和D-R等温线模型。竞争环境中共阴离子的存在对材料的除砷性能影响很小。
Hou J.等[34]研究了氧化锰对废水中砷的吸附性能。结果表明:n(As(Ⅲ))/n(As(Ⅴ))对氧化锰除砷有明显影响;n(As(Ⅲ))/n(As(Ⅴ))从10/90提高到50/50和90/10,砷去除率分别从39.5%提高到55.6%和71.2%。对As(Ⅲ)的氧化造成Mn2+释放,使氧化锰晶格形成更多Mn空位缺陷,吸附位点更加活跃,对砷的吸附性能显著提高。添加Na2SO3同样也可以提高空位缺陷提高吸附活性。
4 CuO材料除砷
CuO有较高零电荷点(ZPC)(pH=9.4±0.4), 无须调节pH和氧化还原电位就可以将亚砷酸盐氧化成砷酸盐;在溶液中存在竞争性阴离子条件下,吸附效果也很好:所以,CuO纳米颗粒可在多种水化学条件下有效吸附含砷物质[35]。
Goswami等[36]研究制备了比表面积52.11 m2/g的CuO纳米颗粒并用于吸附去除水中As(Ⅲ)。结果表明:在pH>8的碱性条件下,As(Ⅲ)去除率接近100%;而在酸性条件下,As(Ⅲ)去除率仅75%;反应温度从25 ℃升至50 ℃,As(Ⅲ)吸附去除率从92%提高到99%;吸附过程遵循伪二级动力学模型和Langmuir等温吸附模型;适宜条件下,As(Ⅲ)最大吸附量为1.086.2 mg/g。Martinson等[37]也研究合成了比表面积85 m2/g、粒径12~18 nm 的CuO纳米颗粒,并用于从地下水中去除As(Ⅲ)和As(Ⅴ)。结果表明:pH在6~10范围内,短时间内As(Ⅲ)和As(Ⅴ)得到有效去除,最大吸附量分别为26.9、22.6 mg/g;吸附之后,As(Ⅲ)被氧化成As(Ⅴ)并吸附在CuO表面;水中其他离子,如硫酸盐和硅酸盐的存在不会影响As(Ⅴ)的吸附但会抑制As(Ⅲ)的吸附;高浓度磷酸盐(>0.2 mmol/L)会降低As(Ⅲ)在CuO纳米颗粒上的吸附;经CuO纳米颗粒吸附后,水中砷质量浓度小于3 μg/L。
5 多种金属氧化物除砷
5.1 二元金属混合氧化物
单一金属材料除砷各有优势,但也有不足,都需要将As(Ⅲ)预氧化为As(Ⅴ)才能有效去除。为了解决这个问题,有研究合成了非均质结构的除砷材料以增强对砷的吸附性能。
Thi等[38]研究合成了分别用Mn、Cu掺杂的磁性Fe3O4纳米材料并用于吸附去除溶液中的As(Ⅲ)。用Cu掺杂Fe3O4的纳米材料对As(Ⅲ)的吸附能力优于单一Fe3O4的吸附能力,也优于用Mn掺杂Fe3O4纳米材料的吸附能力。Cu掺杂的Fe3O4纳米材料中,较小半径的Cu(Ⅱ)取代了原有的Fe(Ⅱ),提高了材料的孔隙率和比表面积。中性条件下,环境溶液中As(Ⅲ)质量浓度为120 ng/L时,用0.6 g/L Fe0.9Cu0.1Fe2O4可以将As(Ⅲ)吸附去除至10 ng/L以下;溶液pH>14时,吸附了As(Ⅲ)的Fe0.9Cu0.1Fe2O4可以解吸重复使用。
Peng B.等[39]研究了用可控双射流沉淀法(CDJP)对Fe3O4颗粒直接覆盖Cu(OH)2,所制得的Fe3O4-Cu(OH)2复合材料中含有大量活性—OH官能团,其与As(Ⅴ)发生静电吸引进而吸附结合。试验结果表明:pH=5条件下,随Cu负载比例增大,复合材料对As(Ⅴ)的吸附量从11.11 mg/g提高至35.71 mg/g,远远超过传统磁性吸附剂的吸附量;通过磁选可快速分离吸附了As(Ⅴ)的复合材料。
Chaudhry等[40]研究了用二元Fe(Ⅲ)-Sn(Ⅳ)混合氧化物涂层砂(ITOCS)吸附去除As(Ⅲ)和As(Ⅴ)。在砷质量浓度为500 μg/L的溶液中,除砷率分别为89.33%和93.59%。在溶液pH=7、吸附剂用量 8.0 g/L、接触时间60 min条件下,As(Ⅲ)和As(Ⅴ)吸附量分别为82.64和227 μg/g;吸附过程符合Langmuir等温吸附模型和伪二级动力学模型,反应速率受膜扩散控制;在温度313 K条件下,As(Ⅲ)和As(Ⅴ)的吉布斯吸附自由能分别为-12.5和-13.42 kJ/mol,吸附过程可自发进行,吸附反应均吸热。
Zhou W.等[41]研究用湿浸渍法制备双功能介孔TiO2/α-Fe2O3复合材料并在300 ℃下进行煅烧。该复合材料中大多数中孔TiO2的孔中填充了α-Fe2O3,TiO2的光催化活性和Fe2O3的吸附特性都被保留,复合形式下可以协同除砷。试验结果表明,在紫外线照射下,所得复合材料在任何pH条件下都能完全氧化As(Ⅲ),α-Fe2O3占比50%时效果最佳,对As(Ⅴ)吸附率(99.9%,pH=3)比对As(Ⅲ)吸附率(80%,pH=3)更高。因此,不同酸碱度条件下,砷都可以得到有效去除。复合材料可用热碱液解吸,解吸后结构保持不变,94%的砷酸盐能被解吸下来。
Zhang G.A.等[42]通过同时氧化和共沉淀法研究制备纳米结构的锆-锰二元无定形水合氧化物,其具有213 m2/g的高比表面积,为纳米颗粒聚集体。该材料可将As(Ⅲ)有效氧化为As(Ⅴ)并高效去除。在pH=5.0时,As(Ⅴ)、As(Ⅲ)最大吸附量分别为80、104 mg/g。对As(Ⅴ)的吸附主要是通过取代氧化物表面的羟基、硫酸根阴离子及形成内部配合物来实现。As(Ⅲ)的去除基本上是吸附与氧化过程的耦合,其中MnO2的作用主要是将As(Ⅲ)氧化为As(Ⅴ),而ZrO2的作用是吸附As(Ⅴ)。
5.2 三元金属混合氧化物
Thanh等[43]结合二氧化锰的氧化特性及铝水合氧化物和钛水合氧化物的高容量可以吸附As(Ⅴ)的特点,借助同时氧化和沉淀法研究合成纳米级Al-Ti-Mn三金属水合氧化物(ATM)材料。该材料由许多纳米级颗粒聚集而成,无定形,具有相对较高的比表面积(71 m2/g)。结果表明,该材料对砷的吸附量、溶液pH对总砷去除率都有影响:pH=7.0时,As(Ⅲ)和As(Ⅴ)的最大吸附量分别为202.7和146.7 mg/g;pH=5.0时,二者最大吸附量分别为193.3和158.6 mg/g,大大超过其他已报道纳米吸附剂的吸附能力。分析结果证实了As(Ⅲ)被氧化再吸附反应机制。吸附前后,ATM中—OH基团数量是影响其吸附能力的关键因素。
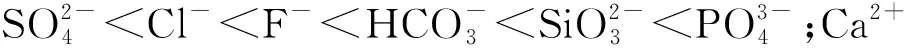
6 结束语
尽管水体中砷含量不高,但对人畜生命安全具有巨大威胁。迄今为止已开发多种过渡金属氧化物除砷材料,对水体除砷都有一定效果。未来过渡金属氧化物去除水中砷研究可从以下2个方面开展:
1)研究吸附除砷机制,并针对含砷废水特点,研发具有高选择性的吸附材料,实现对工业高浓度含砷废水的无害化处理。
2)研发新型复合纳米材料,结合纳米纤维、网状结构等解决纳米氧化材料的聚集问题。

