干巴菌多糖提取工艺优化及抗氧化活性的研究
赵红艳,张鸭关,史俊友
(曲靖师范学院化学与环境科学学院,云南 曲靖 655011)
干巴菌(ThelephoraganbajunZang)主要分布于我国西南地区,在云南省主要分布在昆明、呈贡、嵩明、安宁、曲靖、马龙等地,其分布集中在海拔1 000~1 200 m的松林中[1-2]。该菌隶属于担子菌门、革菌目、革菌科、革菌属[3]。干巴菌外貌不突出,但营养丰富,含有粗蛋白、粗脂肪、总糖、灰分等营养元素,同时还含有16种氨基酸、多种微量元素、维生素及其特有的具有高营养保健价值的革菌酸[4-6]。干巴菌还有一定的药用价值,因其含有的多糖体是医药方面最强的调节剂和免疫剂,同时又因该多糖成分能够提高相应淋巴细胞活性,从而能够在癌症的增殖及转移方面发挥抑癌作用[7]。干巴菌还含有极丰富的抗氧化物质,能够清除人体内的各种加速细胞凋亡甚至让细胞坏死的氧化自由基,进而达到延缓衰老的作用[8]。作者以干巴菌多糖提取率为评价指标,采用单因素实验及正交实验优化干巴菌多糖的提取工艺,通过测定干巴菌多糖对1,1-二苯基-2-三硝基苯肼(DPPH)自由基及羟基自由基的清除率来评价其抗氧化活性,为干巴菌的进一步研究提供理论依据。
1 实验
1.1 材料、试剂与仪器
野生干巴菌,采自云南省曲靖市,清洗干净后,于60 ℃烘箱中烘干,粉碎,备用。
苯酚、无水乙醇、七水合硫酸亚铁、过氧化氢、铁氰化钾、葡萄糖、磷酸氢二钠、三氯乙酸、水杨酸、浓硫酸、三氯化铁、1,1-二苯基-2-三硝基苯肼(DPPH)、芦丁标准液等均为分析纯。
JK-G-350A3型植物粉碎机,上海精学科学仪器有限公司;TU-1810型紫外可见分光光度计,北京普析通用仪器有限责任公司;KM-1000型电热鼓风干燥箱,上海一恒科学仪器厂;AL204-IC型电子天平,梅特勒-托利多仪器(上海)有限公司;离心机,湖南湘仪实验室仪器开发有限公司。
1.2 干巴菌多糖的提取
精确称取干巴菌粉末2.0 g于烧杯中,按照一定料液比加入蒸馏水,于一定温度下在恒温水浴中提取一定时间,过滤;将滤液浓缩至20 mL,加入乙醇使乙醇浓度达到80%,静置过夜;5 000 r·min-1离心10 min,过滤,干燥,得干巴菌多糖。采用苯酚硫酸法测定干巴菌多糖含量。
1.3 干巴菌多糖提取工艺优化
1.3.1 单因素实验
采用单因素实验,分别考察料液比(1∶5、1∶10、1∶15、1∶20、1∶25,g∶mL,下同)、提取温度(50 ℃、60 ℃、70 ℃、80 ℃、90 ℃)、提取时间(1.0 h、1.5 h、2.0 h、2.5 h、3.0 h)对干巴菌多糖提取率的影响。
1.3.2 正交实验
在单因素实验的基础上,以提取温度、提取时间及料液比为考察因素进行正交实验,因素与水平见表1。
1.4 干巴菌多糖的抗氧化活性评价
参照文献[9]方法测定干巴菌多糖对DPPH自由基的清除率,参照文献[10]方法测定干巴菌多糖对羟基自由基的清除率。
表1正交实验的因素与水平

Tab.1 Factors and levels of orthogonal experiments
2 结果与讨论
2.1 单因素实验结果
2.1.1 料液比对干巴菌多糖提取率的影响(图1)

图1 料液比对干巴菌多糖提取率的影响
从图1可以看出,随着料液比的减小,即提取溶剂用量的增加,干巴菌多糖提取率呈先升高后降低的趋势;当料液比为1∶15时,干巴菌多糖提取率最高。因此,确定最佳料液比为1∶15。
2.1.2 提取温度对干巴菌多糖提取率的影响(图2)

图2 提取温度对干巴菌多糖提取率的影响Fig.2 Effect of extraction temperature on extraction rate of polysaccharides from Thelephora ganbajun Zang
从图2可以看出,随着提取温度的升高,干巴菌多糖提取率呈先升高后降低的趋势;当提取温度为60 ℃时,干巴菌多糖提取率最高;继续升高提取温度,多糖提取率反而下降。因此,确定最佳提取温度为60 ℃。
2.1.3 提取时间对干巴菌多糖提取率的影响(图3)
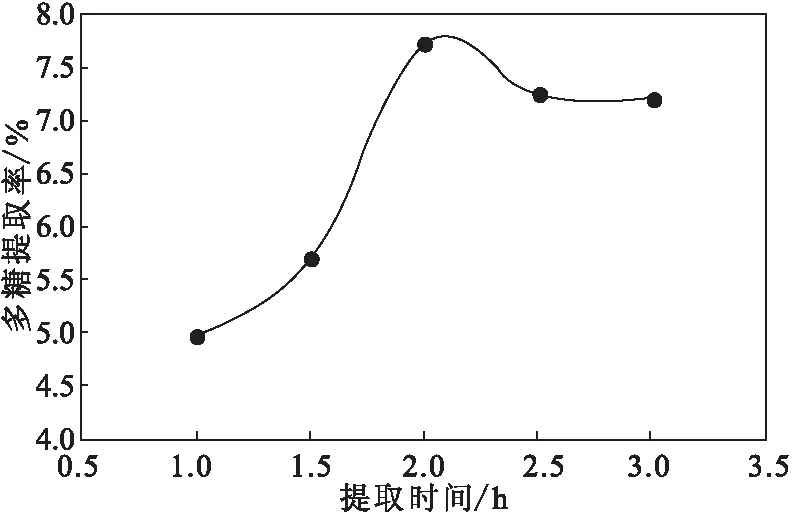
图3 提取时间对干巴菌多糖提取率的影响Fig.3 Effect of extraction time on extraction rate of polysaccharides from Thelephora ganbajun Zang
从图3可以看出,随着提取时间的延长,干巴菌多糖提取率呈先升高后降低的趋势;当提取时间为2.0 h时,干巴菌多糖提取率达到最高;继续延长提取时间,多糖提取率反而下降。因此,确定最佳提取时间为2.0 h。
2.2 正交实验结果(表2)
表2正交实验结果

Tab.2 Results of orthogonal experiments
由表2可知,各因素对干巴菌多糖提取率的影响不同,提取温度对多糖提取率的影响最大,其次是提取时间,料液比对多糖提取率的影响相对较小。综合考虑,确定最佳提取工艺条件为A3B3C2(实验9#),即提取温度70 ℃、提取时间2.5 h、料液比1∶15,在此条件下,多糖提取率为10.08%。
2.3 干巴菌多糖的抗氧化活性
2.3.1 对DPPH自由基的清除率(图4)
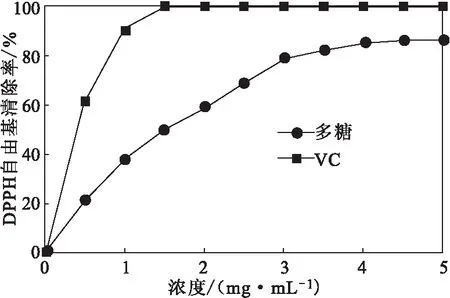
图4 干巴菌多糖对DPPH自由基的清除率Fig.4 Scavenging rate of DPPH free radicals by polysaccharides from Thelephora ganbajun Zang
从图4可以看出,干巴菌多糖对DPPH自由基的清除率随多糖浓度增加而升高;当浓度为5 mg·mL-1时,干巴菌多糖对DPPH自由基的清除率达到86.99%,略低于VC。干巴菌多糖对DPPH自由基的半数清除率有效质量浓度(IC50)为1.91 mg·mL-1。
2.3.2 对羟基自由基的清除率(图5)

图5 干巴菌多糖对羟基自由基的清除率Fig.5 Scavenging rate of hydroxyl free radicals by polysaccharides from Thelephora ganbajun Zang
从图5可以看出,干巴菌多糖对羟基自由基的清除率随多糖浓度增加而升高;当浓度为5 mg·mL-1时,干巴菌多糖对羟基自由基的清除率达到87.46%,略低于VC。干巴菌多糖对羟基自由基的IC50为2.25 mg·mL-1。
2.4 讨论
多糖是由超过10个、几百甚至几千个单糖分子聚合而成的一类化合物,广泛分布于自然界中,是一类重要的活性物质。多糖由于其分子中含有大量极性基团,对水分子具有较大的亲和力[11]。一些分子量较小、分支程度较低的多糖在水中有一定溶解度,因此,水提取法是提取植物多糖最常用的方法。缪园欣等[12]从铁皮石斛花中提取多糖,在超声时间为55 min、料液比为1∶50、微波时间为 3 min的条件下,多糖提取率为7.22%。钟丽霞等[13]从山楂中提取多糖,在提取温度为63 ℃、微波功率为500 W、提取时间为7 min的条件下,多糖提取率为14.71%。本研究采用热水法提取干巴菌多糖,多糖提取率为10.08%,介于两者之间。
人体因为各种因素,体内不断地产生自由基,研究表明,癌症、衰老或其它疾病大都与过量自由基的产生有关。测定对自由基的清除能力是评价抗氧化活性的主要方法。王白娟等[14]研究了大红菇多糖的抗氧化活性,在大红菇多糖浓度为0.4 mg·mL-1时,对羟基自由基的清除率达68.74%、对DPPH自由基的清除率达61.80%,与同浓度的VC的清除率相当。本研究中干巴菌多糖浓度较低时,抗氧化活性比VC低,当多糖浓度达到5 mg·mL-1时,干巴菌多糖的抗氧化活性略低于VC。
3 结论
在单因素实验的基础上,采用正交实验优化了干巴菌多糖的提取工艺,并通过测定干巴菌多糖对DPPH自由基及羟基自由基的清除率来评价其抗氧化活性。确定干巴菌多糖的最佳提取工艺条件为:提取温度70 ℃、提取时间2.5 h、料液比1∶15(g∶mL),在此条件下,多糖提取率达到10.08%。该方法对干巴菌多糖的提取具有一定的参考价值。干巴菌多糖对DPPH自由基及羟基自由基均具有较好的清除效果,当干巴菌多糖浓度为5 mg·mL-1时,其对DPPH自由基和羟基自由基的清除率分别达到86.99%、87.46%。

