医用生物蛋白胶对电灼伤致创伤性局灶性胰腺炎的保护作用
黄建明,钱雷敏,仲卫冬,钱建忠, 花 晨, 张 婷, 陈海姣
创伤性局灶性胰腺炎(post-traumatic focal pancreatitis, PTFP)为一种特殊类型的胰腺炎,临床表现为血淀粉酶较低,腹水淀粉酶显著升高,胰腺本身炎症较轻,胰周组织炎症水肿,常有包裹性积液及粘连,可有局限性皂性坏死,如不加干预,大部分患者可自愈,但少数患者可并发粘连性肠梗阻、腹腔出血、消化道瘘等重症急性胰腺炎(severe acute pancreatitis,SAP)。 目前临床针对PTFP 尚无确切有效的治疗方法。 因此,寻找有效的治疗方法对提高PTFP 患者治愈率、减少严重并发症甚至死亡发生率至关重要。
医用生物蛋白胶在国内外被广泛应用于外科手术中。 除发挥封闭组织缺损的物理作用,其还可通过新生血管形成或作为多种生长因子、前体细胞媒介促进创伤愈合。 本研究在建立大鼠PTFP 模型基础上,观察医用生物蛋白胶对大鼠PTFP 不同时间点胰腺细胞及胰周组织的影响,为临床PTFP 的治疗提供理论依据。
1 材料与方法
1.1 实验分组及处理 清洁级SD 大鼠(由南通大学动物实验中心提供)30 只,体质量范围200 ~250 g,雄雌不限。 将大鼠随机分为对照组和治疗组,各15 只。
1.2 手术步骤 手术前12 h 禁食水,备皮,麻醉采用10%水合氯醛(0.3 ml/100 g)经腹腔注射。 麻醉成功后,消毒,剖腹并解剖出胰腺组织,使用高频电刀(CONMED SYSTEM 5000,模式:bipolar,功率:5 Ω)电凝胰腺被膜,选取胰腺组织较为集中区域(胃后方近脾门),灼伤面积约1 cm×1 cm。 电灼伤后治疗组胰腺创面涂布生物蛋白胶(产品名称:猪源纤维蛋白粘合剂;规格:2.5 ml;生产厂家:杭州普济医药技术开发有限公司),胰腺复位后关腹;对照组则用生理盐水涂布胰腺创面。 术中注意补液,采用生理盐水2 ml/100 g 皮下注射。 术后注意保暖,使用棉布包裹大鼠。 取材:在术后24、72 h 和7 d 3 个时间点进行解剖,每组每个时间点5 只大鼠,提取血清、腹水及胰腺组织并合理保存标本。
1.3 观察指标 (1)手术过程中观察试验动物的一般状况,监测术后精神状态、活动、进食、排便的变化。(2)剖腹大体观察腹腔情况,包括腹水量。 (3)Elisa法检测血清、腹水磷脂酶A2(PLA2)以及腹水中肿瘤坏死因子(TNF-α)水平。 (4)免疫组织化学染色及Western Blot 检测胰腺组织PLA2 蛋白、自噬相关蛋白LC3、Beclin1 和调控分子空泡膜蛋白1(VMP1)、磷脂酰肌醇三磷酸激酶(PI3K)、NF-κB 等表达情况。
1.4 统计学处理 用SPSS 21.0 软件进行统计分析,数据以均数±标准差表示,计量资料使用t 检验;计数资料使用卡方检验。 P <0.05 表示差异有统计学意义。
2 结果
2.1 一般状况 2 组大鼠术后2 h 均精神萎靡,被动体位,仅头部有间断探索样运动,对饮食刺激无反应。 治疗组大鼠术后24 h 后均开始自由活动,主动进食,摄食量逐渐增加,在观察点72 h 少数大鼠腹胀,均有排便行为,在3 个时相点均无大鼠死亡;对照组大鼠术后24 h 仅5 只开始活动及进食,活动迟缓,摄食少,在观察点72 h 均主动进食,大部分大鼠腹胀,有排便行为仅2 只,在观察点7 d,5 只大鼠摄食量增加,腹胀减轻,均有排便行为,但量少,同样在3 个时相点均无大鼠死亡。
2.2 大体变化结果 术后24 h,2 组均有血性腹水形成,对照组明显多于治疗组;大鼠胃均有扩张,对照组胃壁及十二指肠系膜水肿明显;对照组胰腺周围的脂肪组织出现灰白色的脂肪坏死斑点,治疗组则较少;胰腺肿胀,呈粉红色,均散布细小出血坏死灶,治疗组较明显。 术后72 h,治疗组大鼠胰腺呈淡红色,轻度肿胀,创面面积缩小,与周围脂肪组织界限清晰,腹腔内液体为淡黄色,且明显减少;对照组大鼠胰腺呈暗红色,明显肿胀,创面无明显缩小,腹腔内有较多暗红色半透明渗出液。 术后7 d,2 组腹水量均较少;对照组胰腺与周围组织界限不清,肠粘连致密,肠壁水肿;治疗组胰腺与周围组织界限清楚,易分离,肠粘连不明显,胰腺呈粉红色,创面几乎消失。 结果见表1 和图1。
表1 对照组和治疗组大鼠术后不同时间腹水量比较(ml
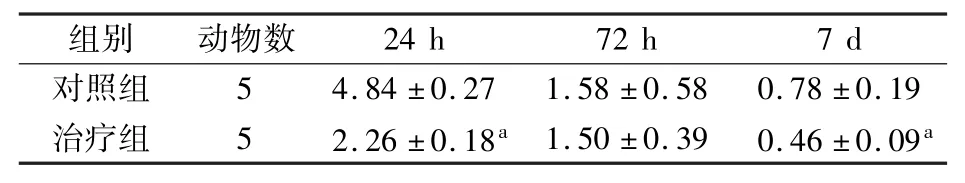
表1 对照组和治疗组大鼠术后不同时间腹水量比较(ml
注:与对照组比较aP <0.05
组别 动物数 24 h 72 h 7 d对照组 5 4.84 ±0.27 1.58 ±0.58 0.78 ±0.19治疗组 5 2.26 ±0.18a 1.50 ±0.39 0.46 ±0.09a
2.3 胰腺组织镜下病理变化 光镜下,术后24 h,胰腺腺泡结构改变:浅层胰腺腺泡、间质均有充血水肿、凝固性坏死,核碎裂,核溶解等,可观察到电灼伤所致的物理性损伤改变,可见较多充血坏死灶,以中性粒细胞为主的炎性细胞向坏死灶浸润,治疗组较对照组明显;术后72 h,胰腺肿胀减轻,充血坏死灶少,坏死区炎性细胞浸润减少,治疗组较对照组明显;术后7 d,呈慢性炎症改变,充血坏死灶少见,以淋巴细胞浸润为主,见较多组织细胞,间质内纤维细胞增多,治疗组较对照组明显。 见图2。
2.4 血清和腹水PLA2 水平、腹水炎症因子TNF-α水平 在3 个时相点治疗组腹水PLA2 及TNF-α 水平均低于对照组(P <0.05)。 见图3。
2.5 免疫组织化学染色检测不同时相点胰腺组织PLA2 和自噬相关蛋白及调控蛋白 免疫组织化学染色结果显示: PLA2 和自噬相关蛋白(LC3、Beclin1)及调控蛋白(VMP1、PI3K 和NF-кB)在胰腺组织中的表达部位相似,主要位于胰腺腺泡细胞胞浆内。 此外,由于创伤后胰腺腺泡细胞的大量破坏,胞浆中的酶释放到细胞外,腺泡细胞外的导管、纤维组织均可见PLA2 的高表达,而2 组腺泡细胞内表达强度均较低。 除VMP1 在3 个时相点的表达对照组均高于治疗组外,其他蛋白在术后24 h 和72 h 的表达强度2 组之间有特征性差异,表现为术后24 h 治疗组胰腺细胞内蛋白表达强度高于对照组;但术后72 h 则对照组高于治疗组,且治疗组术后72 h 表达强度下降,对照组则增强,随之,表达强度均下降;术后7 d 2 组表达均呈弱阳性,但对照组的表达强度略高。 见图4 ~9。
2.6 Western Blot 分析不同时间点胰腺组织中PLA2 和自噬相关蛋白及调控蛋白的表达变化 Western Blot 结果与免疫组织化学染色结果趋势基本一致。 术后24 h,治疗组PLA2 和自噬相关蛋白(LC3 和Beclin1)及调控蛋白(VMP1、PI3K 和NFкB)的表达高于对照组;但术后72 h,对照组上述蛋白的表达量高于治疗组,治疗组蛋白的表达呈下降趋势,随后2 组蛋白的表达量均下降;至术后7 d,对照组的蛋白表达量仍高于治疗组。 见图10。
3 讨论
胰腺炎发生时,大量病理性激活的胰酶(包括胰蛋白酶、弹力蛋白酶、脂肪酶及PLA2 等)进入血循环中,产生破坏作用。 其中,PLA2 被激活后,作用于细胞膜和线粒体膜的甘油磷脂,分解其卵磷脂和脑磷脂中的脂肪酸分子为溶血卵磷脂,后者具有高度的细胞毒性,可以溶解破坏胰腺及体内各组织细胞膜和线粒体膜的脂蛋白结构,使细胞坏死,引起胰腺和胰周组织进一步广泛坏死。 此外,PLA2 还可触发体内的单核巨噬细胞、中性粒细胞和淋巴细胞等释放大量内源性炎性介质,导致机体发生全身的炎症反应(SIRS)[1]。 这些都是胰腺炎患者发生并发症和导致死亡的主要原因[2-3]。
自噬是细胞利用溶酶体降解自身受损的细胞器和大分子物质的过程,是真核细胞特有的生命现象,主要通过对长寿命蛋白以及细胞器的降解和再利用对细胞进行调节。 研究表明,自噬是细胞生长发育、成熟分化及死亡的重要调控机制,又是细胞对不良环境的一种防御机制[4-5]。 除此之外,自噬参与多种疾病的病理过程,如肿瘤、神经退行性病变、心脏疾病、病原体感染等[6]。 随着对细胞自噬的分子机制的深入研究,其在疾病中的作用引起了学者广泛的重视。 最近的研究表明自噬活性的异常改变与急性胰腺炎关系密切[7-9],已成为目前探讨急性胰腺炎发生发展研究的新靶点。
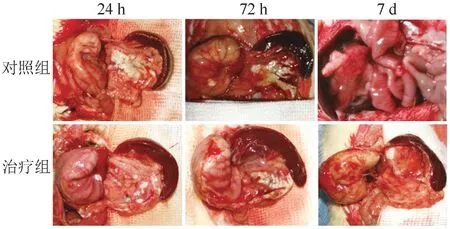
图1 手术后大鼠胰腺及胰周组织大体改变
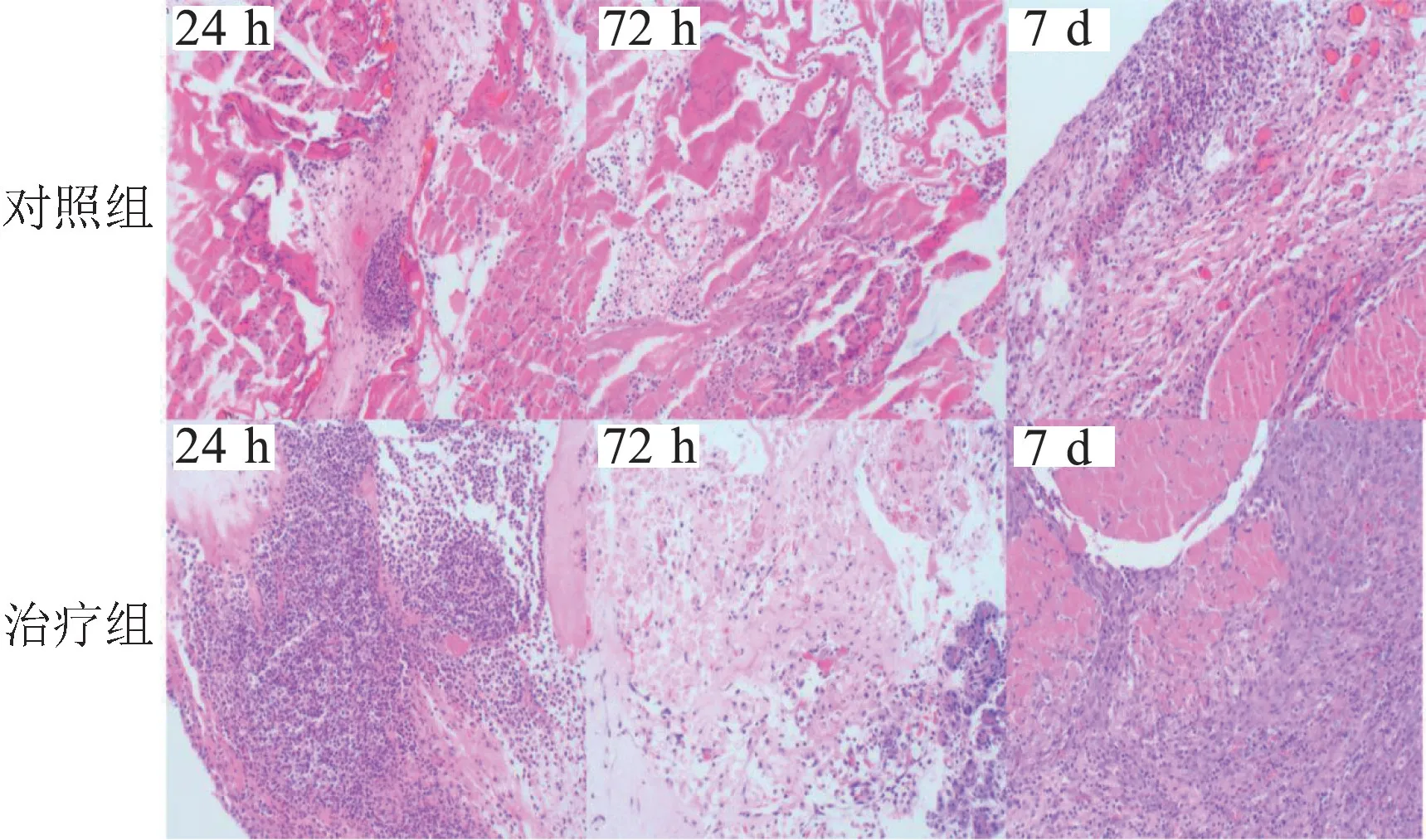
图2 光镜下大鼠胰腺组织病理变化(HE 染色 ×40)
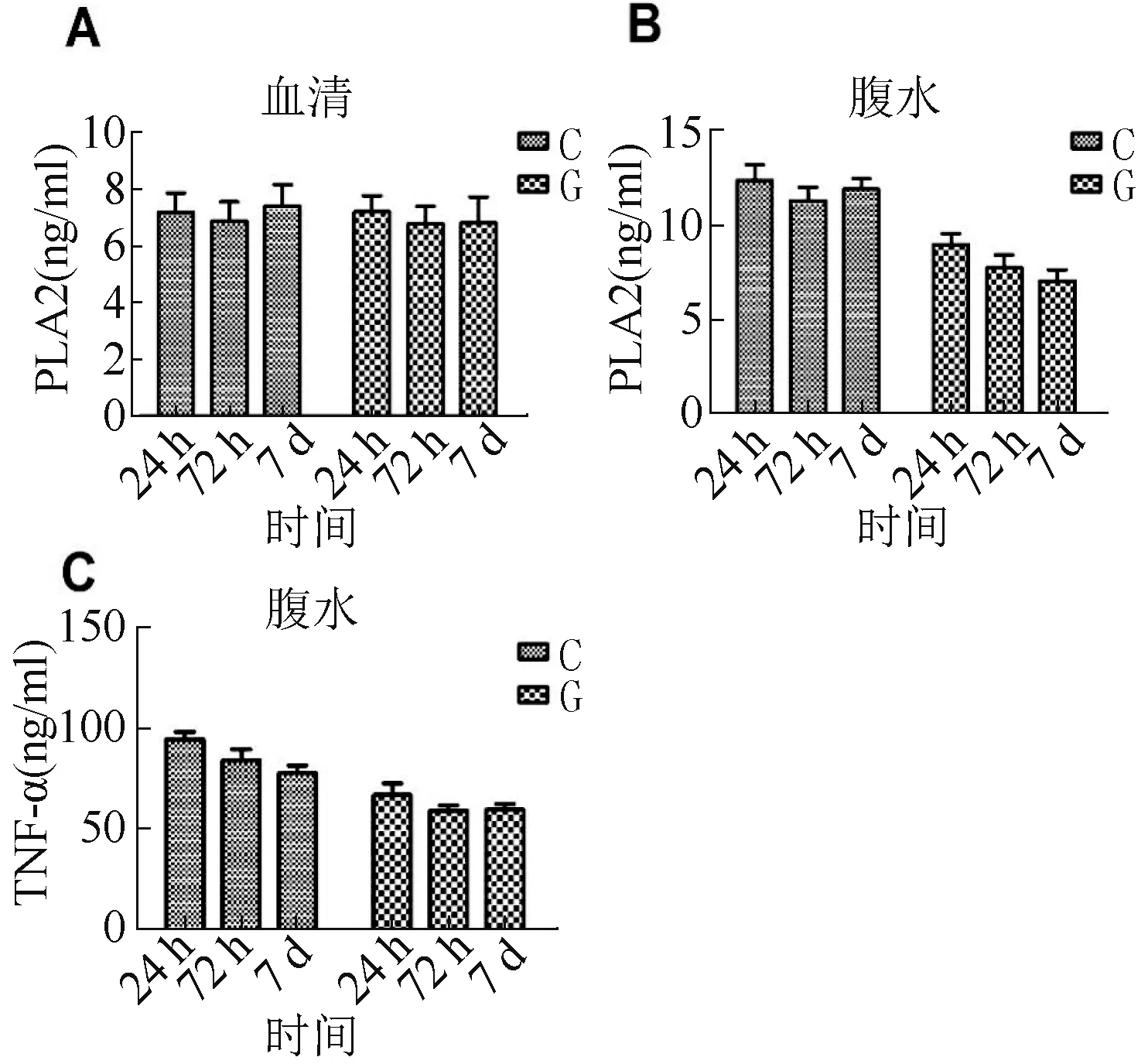
图3 大鼠血清(A)、腹水PLA2(B)和腹水TNF-α(C)的检测情况(C:对照组;G:治疗组)

注:PLA2 为磷酯酶A2
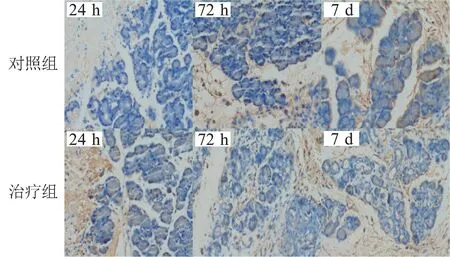
图5 大鼠胰腺组织自噬相关蛋白表达情况(DAB 染色 ×100)
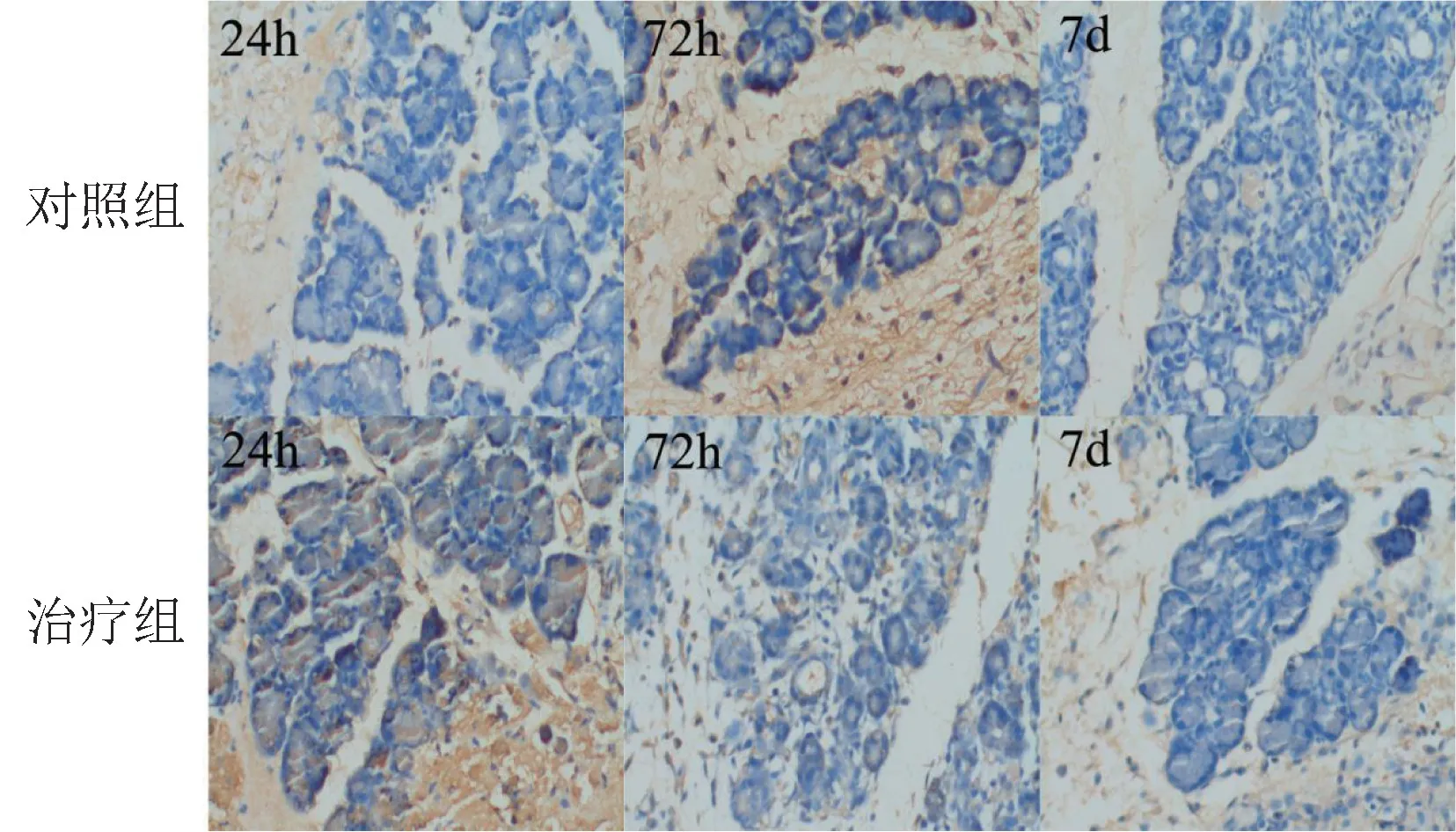
图6 大鼠胰腺组织Beclin1 表达情况(DAB 染色 ×100)

图7 大鼠胰腺组织空泡膜蛋白1表达情况(DAB 染色 ×100)

图8 大鼠胰腺组织磷酯酰肌醇三磷酸激酶表达情况(DAB 染色 ×100)

图9 大鼠胰腺组织核因子-кB 表达情况(DAB 染色 ×100)
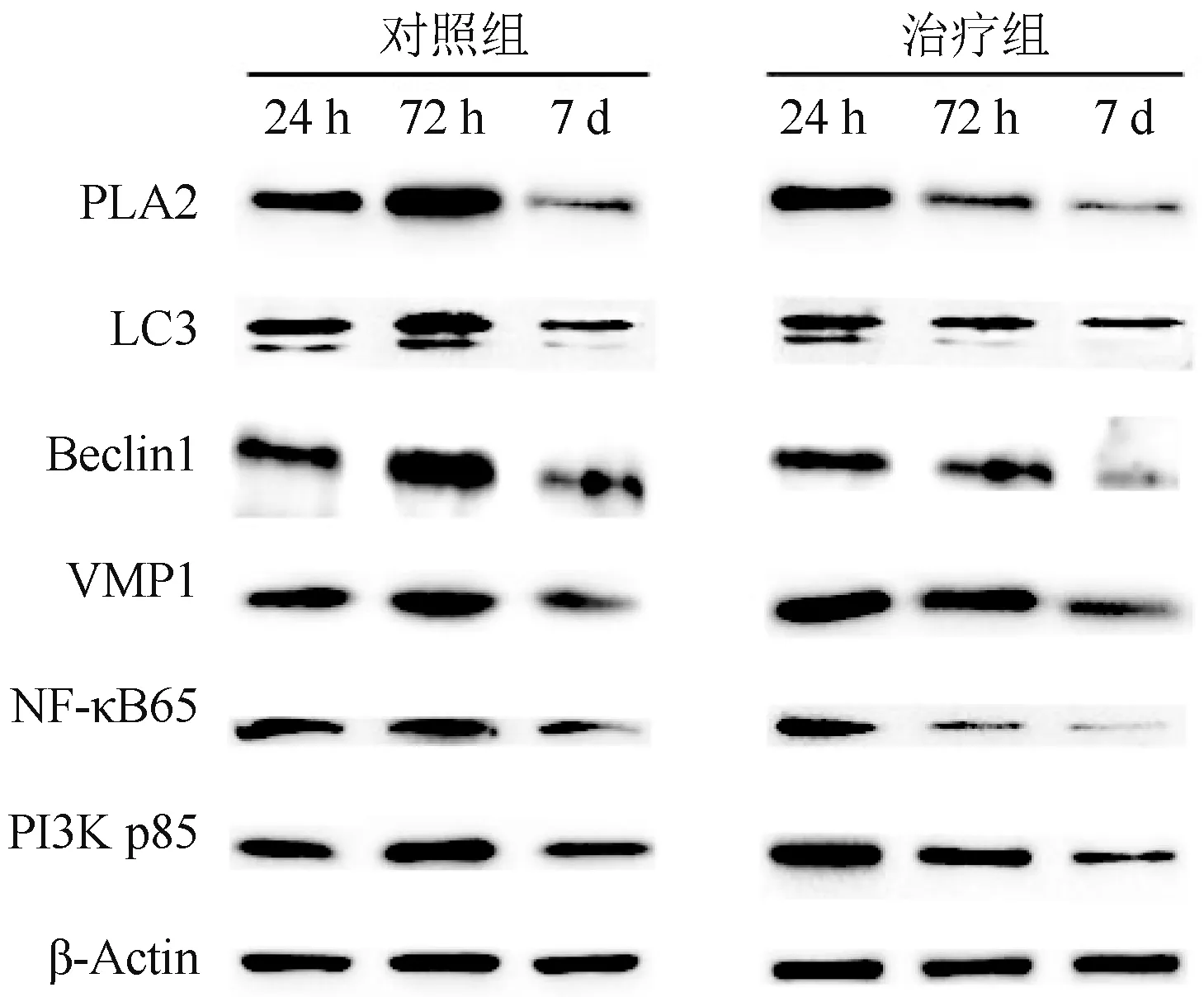
图10 大鼠胰腺组织PLA2 及LC3 的表达情况(Western Blot)
本研究提示,电灼伤致创伤性局灶性胰腺炎大鼠模型的血清PLA2 表达早期开始增高,随着术后时间的延长而继续增加,术后24 h 血清PLA2 表达维持于较高值。 创伤后7 d,血清PLA2 表达较前期下降,但仍显著高于对照组。 这些结果证实,胰腺创伤后早期主要受到电热伤的物理性损伤,浅层的胰腺腺泡被破坏,胞浆中的酶大量释放到细胞外,随后化学性损伤加重胰腺炎,但深部胰腺组织结构正常,故创伤性局灶性胰腺炎不至于导致血清PLA2 明显升高,血清中PLA2 与正常大鼠无明显差异,这与临床上出现创伤性局灶性胰腺炎后血清淀粉酶升高不明显一致,此不同于胆源性重症胰腺炎表现,但导致胰周腹水中PLA2 水平早期明显增加,且峰值时间在伤后72 h 出现并可以维持较长时间。 随着胰腺组织的自我修复,伤后7 d 腹水中PLA2 水平有所下降,但仍较高。 本研究通过自噬相关基因及蛋白的检测同样发现在创伤性局灶性胰腺炎术后24 h 自噬现象即明显存在,在术后72 h 达高峰,仍持续增多,随着胰腺组织的自我修复及慢性炎症的形成逐渐减弱,但胰腺周围组织的病理性损伤仍明显,早期渗出、出血、坏死明显,后期粘连显著。 因此在创伤性局灶性胰腺炎发生后如何保护胰腺及胰周组织是值得研究的课题。
临床已发现胃癌根治术中应用医用生物蛋白胶涂布胰腺表面可减少腹水、腹腔出血及粘连,但对胰腺本身有无影响,无法判断。 因此本研究在创伤性局灶性胰腺炎大鼠模型构建成功的基础上,进一步研究了使用生物蛋白胶后胰腺及胰周组织变化情况。
研究发现,生物蛋白胶在24 h 内并没有对胰腺组织本身发挥有利作用,仅作为隔绝炎性渗出的物理屏障。 由于胰腺腺泡细胞被大量破坏,细胞浆内的大量酶因蛋白胶的阻挡而无法弥散稀释,大量消化酶发生自我消化,可导致接近坏死区深部的胰腺腺泡被破坏,但由于局灶性坏死缘故,不至于并发重症胰腺炎。因此在镜下观察胰腺局灶坏死区早期有大量炎性细胞浸润,但炎性渗出带较轻,自噬相关的调控蛋白VMP1、PI3K 及NF-κB 上调活化参与早期自噬激活的过程。 72 h 后,治疗组电灼创面缩小,胰腺组织病理改变好转,PLA2、自噬相关蛋白表达下调,生物蛋白胶后期又发挥促进胰腺组织修复的功能,其中的机制尚不明确,可能与生物蛋白胶可促进新生血管形成或作为多种生长因子、前体细胞媒介促进创伤愈合有关[10-12]。
综上,医用生物蛋白胶全程对胰腺周围组织具有保护作用,早期对胰腺起到隔绝创伤性局灶性胰腺炎的物理作用,后期发挥生物活性对胰腺创面进行修复。

