枸骨叶水提物对小鼠肥胖的预防作用及对脂肪分化的影响*
刘梅芳, 孙 悦, 李 丽
(济宁医学院药学院,山东日照276826)
肥胖是一种以体内脂肪含量过多为重要特征的慢性疾病,是脂肪肝、糖尿病、高血压和心脏病的高危因素[1]。预防和治疗肥胖对于维护机体健康具有重要意义。枸骨叶是冬青科冬青属植物枸骨的干燥叶片,又称“角刺茶”和“功劳叶”。枸骨叶与同科属的大叶冬青和苦丁茶冬青一起作为苦丁茶的主要来源[2]。基于中国传统药食同源的理论,苦丁茶的药用价值已经受到广泛关注,很多学者对苦丁茶冬青及大叶冬青的化学成分与药理作用做了深入研究,而对枸骨叶的研究相对较少。现代药理学研究表明,枸骨叶提取物具有抑菌、抗氧化、免疫抑制、降血压、抑制心肌收缩力和降血脂等多种作用[3-7]。枸骨叶水提物(Ilex cornuta aqueous extract,ICAE)可以剂量依赖性降低高脂饮食诱导的高脂血症[6],能够抑制胆固醇合成酶,具有降血脂和抗脂肪肝的作用[7]。但是枸骨叶水提物是否具有减肥作用,是否影响脂肪分化过程尚未见报道。本研究采用高脂饮食(high-fat diet,HFD)诱导小鼠肥胖模型,以目前常用的减肥药奥利司他(orlistat)作为阳性对照药,观察ICAE对肥胖的预防作用,并进一步采用大鼠附睾来源的分化脂肪细胞进行细胞实验,研究ICAE对脂肪分化的影响。
材料和方法
1 实验动物和分组
实验动物购自济南朋悦实验动物繁育有限公司,许可证号为SCXK(鲁)2014-0007。6周龄清洁级雄性SD大鼠6只,体重150~160 g,用于前脂肪细胞的原代培养。7~8周龄清洁级雄性昆明小鼠50只,体重25~30 g,普通饲料适应性喂养1周,分选出体质量相似的小鼠39只,分成4组,采用HFD诱导小鼠肥胖,orlistat作为阳性对照药[8],观察ICAE对肥胖的预防作用。动物分为对照(control)组、肥胖模型(obesity model)组、orlistat治疗组和ICAE治疗组,除对照组外,其余3组小鼠均给予HFD。ICAE治疗组给予ICAE 100 mg·kg-1·d-1(相 当 于 生 药 浓 度 3 g·kg-1·d-1)[6-7],orlistat治疗组给予 orlistat混悬液 60 mg·kg-1·d-1[9]于每天上午 9:00~10:00 灌胃给药,连续 5周,对照组则灌胃等体积生理盐水;在实验的第5周,连续5 d监测各组小鼠24 h平均摄食量;末次给药当晚禁食,次日对动物进行称重和取材。每组随机选取3只小鼠,麻醉后经心脏灌流4%多聚甲醛进行组织固定,然后取材,用于后续切片染色。其余小鼠摘眼球取血,分离血清,-80℃冰箱冻存,用于血糖、血清总胆固醇(total cholesterol,TC)和甘油三酯(triglyceride,TG)的测定;取血后的小鼠脱颈椎处死后打开腹腔,取出附睾周围脂肪、肾周脂肪、腹股沟皮下脂肪及肝脏,准确称量其湿重。
2 主要试剂和仪器
ICAE干粉和高脂饲料由本实验室自制;orlistat胶囊(舒尔佳)购自山东新时代药业有限公司;细胞培养所需低糖DMEM培养液和DMEM/F12培养液,前脂肪细胞分离和分化所需Ⅰ型胶原酶、三碘甲状腺原氨酸(T3)、胰岛素和生物素均购自Sigma;四季青胎牛血清购自浙江天杭科技有限公司;胆固醇、HE染色试剂盒、血糖、血清TG和TC测定试剂盒均购自北京索莱宝科技有限公司;兔抗脂滴包被蛋白1(perilipin 1,Plin1)抗体和兔抗激素敏感性脂肪酶(hormone-sensitive lipase,HSL)抗体由美国国立卫生研究院Constantine Londos教授惠赠;兔抗过氧化物酶体增殖物激活受体γ(peroxisome proliferator activated receptor 8,PPARγ)抗体购自Abcam;辣根过氧化物酶标记山羊抗兔II抗购自Sigma;尼罗红染液购自北京普利莱基因技术有限公司。
3 主要方法
3.1 ICAE的制备 枸骨叶采于济宁医学院日照校区本草园,洗净晾干后放入烘箱烘干备用。采用煎煮法制备ICAE[5]。将干燥枸骨叶粉碎,过筛,得到细粉;称取粉末30 g,加500 mL蒸馏水浸泡30 min后煎煮1 h,然后用纱布分离药渣,再加500 mL蒸馏水,重复煮2次,每次1 h;合并3次煎液进行抽滤,得到澄清水煎液,此澄清水煎液经初步浓缩后放入旋转蒸发仪内,最终形成棕黄色浸膏;将浸膏转入坩埚内,放入干燥箱干燥成ICAE干粉。制备2次ICAE,共得到干粉1.984g,-20℃冻存,临前用配制。
3.2 高脂饲料的制备 诱导小鼠肥胖所用高脂饲料系本实验室手工制作而成。参考常用的高脂饲料配方[8-9],为提高肥胖诱导效果并缩短造模周期我们对配方进行了改良,提高了饲料中猪油的含量。配方如下:基础饲料66%、胆固醇1%、猪油20%、蛋黄粉10%、淀粉3%。材料准备:基础饲料粉碎后过筛,得到细粉;鸡蛋煮熟,取蛋黄,烘干后,碾碎过筛,得到蛋黄粉;用新鲜肥肉炼制猪油;用木薯淀粉做淀粉糊。制作过程:首先在容器内将基础饲料细粉和蛋黄粉混匀,将胆固醇加入猪油中溶解;然后将猪油分次加入到粉末中抓匀,最后加入淀粉糊,和成面团,用去掉前端的5 mL注射器将面团拓成短圆柱形,再放入烘箱50℃烘干。为防止饲料变质,待烘干和烘干后的饲料均放在-20℃冰箱保存。
3.3 HE染色 经灌注取材后的附睾周围脂肪组织,放入4%多聚甲醛中继续固定12 h,然后浸入20%蔗糖溶液中过夜,经过脱水,透明,浸蜡,包埋成蜡块。切片厚度设定为8μm,染色步骤遵循试剂盒说明书进行,染色结束后进行梯度乙醇脱水,二甲苯透明以及中性树胶封片,晾干后拍照。
3.4 大鼠附睾周围脂肪组织来源前脂肪细胞的分离和培养 采用酶消化法分离大鼠附睾周围脂肪来源的前脂肪细胞[10]。首先将SD大鼠断头处死,取附睾周围脂肪垫,快速剪碎后加入胶原酶Ⅰ工作液(含0.8 g/L胶原酶Ⅰ和1%牛血清白蛋白的KRB溶液),37℃水浴摇床内消化40~50 min使脂肪细胞完全离散。消化结束后加入DMEM培养液20 mL进行稀释,然后用100目滤网过滤,静置10 min,使脂肪细胞自然上浮,吸取下层液体,此液体内含有前脂肪细胞。用含10%血清的DMEM/F12培养液将前脂肪细胞接种于24孔板内。培养24 h后,换入无血清分化液(含有胰岛素5 mg/L、T3 200 pmol/L和生物素33 μmol/L的DMEM/F12培养液)启动分化3 d,然后更换为无血清DMEM/F12培养液,ICAE组加入过滤除菌后的ICAE贮备液,使终浓度为100 mg/L[5];对照组给予同等体积的生理盐水。给药处理3 d后,用倒置相差显微镜进行活细胞摄相。
3.5 Western blot 给药处理3 d后的分化脂肪细胞,加入细胞裂解液提取蛋白,用于Western blot检测[10]。蛋白分离采用10%SDS-PAGE,用湿转法将蛋白转移至PVDF膜,室温封闭后加入I抗,4℃孵育过夜,漂洗3次,孵育辣根过氧化酶标记的II抗,洗涤同前。用ECL化学发光检测试剂盒发光、显影和定影。发光后的膜用膜再生液洗去结合的抗体,重新孵育抗体检测其它蛋白。
3.6 脂滴的尼罗红染色 尼罗红染色观察分化脂肪细胞内脂滴的变化[10]。前脂肪细胞接种于细胞爬片,在加入分化液诱导后的第1~6天,每日取出部分细胞爬片,经PBS洗涤后,加入4%多聚甲醛PBS溶液室温固定20 min,然后加入尼罗红染液避光染色10 min分钟,PBS洗涤2次后用75%甘油封片,荧光显微镜下观察和拍照。
4 统计学处理
实验数据以均数±标准误(mean±SEM)表示,采用Prism 8.02软件进行统计学分析,多组之间比较采用单因素方差分析(one-way ANOVA),组间两两比较采用最小显著性差异法(LSD)法,以P<0.05为差异有统计学意义。
结 果
1 ICAE对HFD小鼠体重、脂肪重量、肝重和摄食量的影响
与对照组相比,肥胖模型组小鼠体重,附睾、肾脏和腹股沟周围脂肪及肝脏重量均显著增加(P<0.01);ICAE治疗组和orlistat治疗组与肥胖模型组相比,此5项指标均显著下降(P<0.01)。从摄食量看,ICAE治疗组和肥胖模型组小鼠的摄食量显著低于对照组(P<0.01);ICAE治疗组小鼠摄食量与肥胖模型组相比略有降低,但是无显著性差异,而orlistat治疗组小鼠摄食量显著高于肥胖模型组和ICAE治疗组(P<0.01),与对照组相比无显著差异,见图1。
2 ICAE对HFD小鼠血脂的影响
肥胖模型组小鼠血清TG和TC水平显著高于对照组(P<0.01),但是血糖无显著变化;与肥胖模型组相比,orlistat治疗组血清TG和TC水平显著下降(P<0.01),ICAE治疗组血清TC和TG也降低(P<0.05),但降低幅度较小,与orlistat治疗组相比有显著差异(P<0.05),见图2。
3 ICAE对HFD小鼠脂肪组织形态的影响
附睾周围脂肪组织HE染色结果显示,对照组脂肪细胞直径小,有较多胞浆;肥胖模型组脂肪细胞显著增大,与对照组相比直径增加约1倍;ICAE治疗组和orlistat治疗组与肥胖模型组相比,脂肪细胞直径均显著减小,见图3。
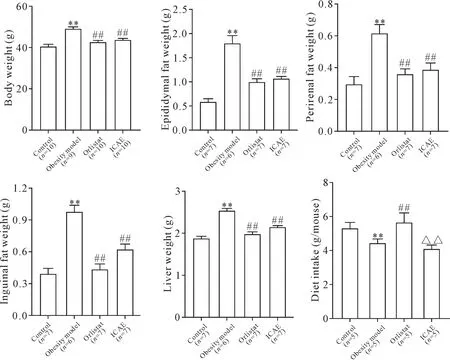
Figure 1.Effects of ICAEon body weight,epididymal fat weight,perirenal fat weight,inguinal fat weight,liver weight,and food intake of HFD-induced mice.Mean±SEM.**P<0.01 vs control group;##P<0.01 vs obesity model group;△△P<0.01 vs orlistat group.图1 ICAE对HFD小鼠体重、附睾周围脂肪、肾周脂肪、腹股沟脂肪、肝脏重量及摄食量的影响

Figure 2.Effects of ICAE on serum triglyceride(TG),total cholesterol(TC)and glucose levels in HDF-induced mice.Mean±SEM.**P<0.01 vs control group;#P<0.05,##P<0.01 vs obesity model group;△P<0.05,△△P<0.01 vs orlistat group.图2 ICAE对HFD小鼠血清甘油三酯、总胆固醇和葡萄糖水平的影响
4 ICAE对分化脂肪细胞内脂滴的影响

Figure 3.Influences of ICAE on epididymal adipose tissue of HFD-induced mice.Photomicrographs of epididymal adipose tissue of different groups with HEstaining.图3 ICAE对HFD小鼠附睾周围白色脂肪组织形态的影响
正常情况下,在分化液的诱导下大鼠前脂肪细胞可以分化成为多房脂肪细胞,分化各天细胞内脂滴的特点如图4A所示。加入分化液诱导1 d,细胞由原来的梭形变成多角形,胞浆内有非常微小的脂滴;诱导分化2 d,细胞内出现簇状分布的小脂滴;诱导分化3 d,脂滴直径显著增加,分布在胞浆内。诱导分化3 d后,将分化液更换为无血清DMEM/F12培养液,细胞内脂滴继续增大,较大的脂滴位于细胞中央。为观察ICAE对脂肪细胞分化的影响,本研究在为细胞更换为无血清DMEM/F12培养液后,给予ICAE(终浓度为100 mg/L)处理3 d。结果显示,对照组脂肪细胞分化程度较为一致,大部分细胞已经出现较大脂滴,符合第6天分化脂肪细胞的特点;而ICAE处理组大部分细胞内脂滴较小,符合第3~4天分化脂肪细胞的特点,见图4B。

Figure 4.Effects of ICAE on lipid droplet accumulation in rat differentiated adipocytes.A:the morphological changes of lipid droplets in rat differentiated adipocytes form day 1 to day 6 after induction.Preadipocytes were initiated with differentiation media for 72 h,and then the differentiated media were replaced by serum-free DMEM/F12 media.Cells were fixed and stained with Nile red and visualized with fluorescence microscopy on various days.B:effects of ICAE on the lipid accumulation of differentiated adipocytes.On day 3 of differentiation,rat differentiated adipocytes were treated with or without 100 mg/L ICAEafter medium replacement.On day 6 of differentiation,living cells were visualized by microscopy图4 枸骨叶水提物对大鼠分化脂肪细胞内脂滴积累的影响
5 ICAE对脂肪细胞分化关键蛋白表达的影响
利用Western blot观察ICAE对脂肪细胞分化关键蛋白表达的影响。结果显示,100 mg/L ICAE孵育3 d,可以显著抑制分化脂肪细胞PPARγ的蛋白表达(P<0.01),并且使脂肪细胞分化标志物Plin1和HSL的蛋白表达显著下降(P<0.01),见图5。

Figure 5.Effects of ICAEon the protein expression of PPARγ,Plin1 and HSL in rat differentiation adipocytes.On day 3 of differentiation,rat differentiated adipocytes were treated with or without ICAE(100 mg/L).On day 6 of differentiation,the protein levels of PPARγ,Plin1 and HSL were detected by Western blot.Mean±SEM.n=3.**P<0.01 vs control group.图5 ICAE对大鼠分化脂肪细胞PPARγ、Plin1和HSL蛋白表达的影响
讨 论
1 ICAE可抑制HFD诱导的小鼠肥胖
肥胖已被世界卫生组织认定为影响健康的五大危险因素之一。治疗肥胖的常用方法是药物治疗,但是很多减肥药具有严重副作用,目前orlistat是国家食品药品监督管理总局批准的唯一一种减肥药。近些年来,大量研究致力于从植物来源的天然产物中寻找新型安全有效的减肥药物[9,12]。枸骨叶是我国传统中药,有文献报道ICAE具有降血脂的功效[6-7],但其是否具有减肥作用,尚未见报道。HFD诱导小鼠肥胖是较为理想的肥胖动物模型,可以模拟人类肥胖的发病过程和机制[8]。本实验采用改良的高脂饲料,选用成年雄性昆明小鼠进行造模[8],成功建立小鼠肥胖模型。HFD喂养5周后,肥胖模型组小鼠的体重、腹内和皮下脂肪组织重量以及肝重均显著高于正常对照组,这说明本研究所用高脂饲料的配方、制作和保存方法合理可行。ICAE处理组小鼠体重、附睾、肾脏、腹股沟周围脂肪组织以及肝重,与肥胖模型组相比均显著降低,且ICAE对上述指标的降低作用与orlistat相比无显著性差异。这说明ICAE作用效果与orlistat相当。血脂测定结果显示,ICAE可以显著降低血清TG和TC水平,这与前人报道一致[6-7]。曾庆峰等[6]研究结果显示ICAE可以剂量依赖性降低HFD诱导的大鼠高脂血症,6 g/kg ICAE的降血脂效果与1.33 mg/kg辛伐他汀相当。本研究观察到ICAE降血脂的效果较弱,这可能与所用剂量较低有关。
2 ICAE对摄食量无显著影响
摄食量是影响体重变化的重要因素。研究结果显示,ICAE治疗组小鼠的摄食量与肥胖模型组相比略有降低,但无显著性差异,这说明ICAE对摄食量无显著影响。肥胖模型组和ICAE治疗组小鼠摄食量显著低于对照组,这可能是由于富含脂肪、胆固醇和蛋白的饲料容易使小鼠产生饱腹感,并延缓胃排空。出乎意料的是,orlistat治疗组小鼠摄食量显著高于肥胖模型组和ICAE治疗组。实验中还观察到,orlistat治疗组小鼠与其它组小鼠相比,排出的粪便量较多,质地较软且具有油性光泽。冯孔龙等[11]在HFD诱导的大鼠肥胖模型中也观察到orlistat治疗组摄食量高于肥胖模型组。这可能是由于orlistat抑制脂类食物的消化吸收,降低了食物的转化率,导致动物摄食量代偿性增加。从摄食量的变化分析,ICAE的减肥机制可能与orlistat有所不同。
3 ICAE抑制脂肪细胞肥大和脂肪细胞分化
脂肪组织是机体主要的能量贮库,长期能量摄入过多,会使脂肪细胞体积和数目持续增加,最终导致肥胖。附睾周围组织HE染色结果显示,ICAE可以显著减小附睾周围脂肪组织脂肪细胞的直径,其作用效果与orlistat相当。这提示ICAE可能具有抑制脂肪细胞肥大的作用。本研究采用了大鼠附睾周围脂肪组织来源的分化脂肪细胞进行了进一步研究。结果表明,ICAE可以显著抑制分化脂肪细胞内脂滴的积累,并且降低Plin1和HSL的蛋白表达。分化脂肪细胞内脂滴的大小在一定程度上可以反映脂肪细胞的成熟度[12-13];Plin1和HSL是成熟脂肪细胞表达的功能蛋白,在脂滴TG的贮存和分解中发挥重要作用,被认为是脂肪细胞分化成熟的标志物[12]。所以,此结果提示ICAE具有抑制脂肪细胞分化成熟的作用。PPARγ是脂肪细胞分化过程所必需的转录因子,能与视黄醛X受体α形成异源二聚体,促进大多数与脂肪发育相关基因的表达[13]。有文献报道PPARγ基因的表达水平与脂肪细胞的大小及脂肪细胞的分化程度呈正相关[14],PPARγ拮抗剂能阻止前脂肪细胞分化,并抵抗HFD引起的脂肪细胞过度肥大[15]。本研究显示,ICAE可以显著抑制分化脂肪细胞PPARγ的蛋白表达。因此ICAE抑制脂肪细胞肥大和分化的作用可能与下调PPARγ的蛋白表达有关。
综上所述,本研究证实了ICAE对HFD诱导的小鼠肥胖具有预防作用,但对其摄食量无明显影响;ICAE可以显著抑制脂肪细胞分化,此作用可能与抑制PPARγ的蛋白表达有关。本研究将为ICAE在预防和治疗肥胖方面的应用提供实验证据。

