4例新型冠状病毒感染病例咽拭子与痰标本病毒核酸检测的比较
陈 炜,张春阳,朱 颖,张炎华,游丽斌,吴冰珊,黄枝妙,郑奎城,翁育伟
2019年12月在中国湖北省武汉市发生新型冠状病毒感染的肺炎病例[1],2020年1月12日,该新型冠状病毒被命名为“2019-nCoV”[2],该病毒是一种新型β属冠状病毒,属正冠状病毒亚科,但形成了另外一簇的进化分枝,成为继α-冠状病毒的HCoV-229E和HCoV-NL63,β-冠状病毒的HCoV-OC43、HCoV-HKU1、SARS-CoV和MERS-CoV之后,可以感染人类的冠状病毒科中的第7个成员。
2020年1月20日我国将新型冠状病毒感染的肺炎纳入法定乙类传染病,并采取甲类传染病的预防、控制措施[3]。截至1月31日24时,中国大陆累计报告确诊病例11 791例,重症病例1 795例,死亡病例259例,港澳台地区通报确诊病例30例[4],泰国、日本、新加坡及美国等二十几个国家也相继报告确诊病例。2020年1月31日,世界卫生组织宣布新型冠状病毒感染的肺炎疫情构成“国际关注的突发公共卫生事件”[5]。福建省自2020年1月22日报告首例输入性新型冠状病毒感染的肺炎确诊病例[6]以来,截至1月31日24时,福建省累计报告新型冠状病毒感染的肺炎确诊病例144例[7]。为比较不同呼吸道标本的病毒核酸检测效果,我们对收集到的4例新型冠状病毒确诊病例的咽拭子与痰标本开展病毒核酸检测。
1 材料与方法
1.1标本 收集到2020年1月22日以来福建省各地市上送至省疾控中心的4例新型冠状病毒确诊病例的咽拭子与痰标本。
1.2RNA提取 提取病毒的RNA采用QIAamp viral RNA mini kit(Qiagen, Hilden, Germany)试剂盒,从280 μL的标本(咽拭子和痰标本)中获得50 μL的总RNA溶液,提取的RNA保存在-20 ℃待用。
1.3人体细胞管家基因GAPDH的检测 应用AgPath-IDTMOne-step RT-PCR Kit反应试剂盒(ABI Ambion, Life Technologies, USA)及引物探针(GAPDH-F: 5′-CACATGGCCTCCAAGGAGTAA-3′, GAPDH-R: 5′-TGAGGGTCTCTCTCTTCCTCTTGT-3′ GAPDH-Prob: 5′-(FAM)CTGGACCACCAGCCCCAGCAAG(BHQ1) -3′),进行人体细胞管家基因GAPDH的检测。按照试剂盒说明书配制体系,反应程序如下:45 ℃ 10 min, 95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 1 min, 40个循环。置ABI 7500仪器上检测,单点荧光检测在60 ℃,荧光检测通道选择FAM/none,passive reference选择ROX。判定标准:阳性(Ct值≤37,典型扩增曲线),灰区(37
1.4病毒基因ORF 1ab及基因N的检测 应用AgPath-IDTMOne-step RT-PCR Kit反应试剂盒(ABI Ambion, Life Technologies, USA)及实验室检测技术指南[8]推荐的引物探针,进行病毒基因ORF 1ab及基因N的检测。按照试剂盒说明书配制体系,反应程序如下:为45 ℃10 min, 95 ℃10 min; 95 ℃15 s, 55 ℃1 min, 40个循环。置ABI 7500荧光定量PCR仪检测,单点荧光检测在55 ℃,荧光检测通道选择FAM/none,passive reference选择ROX。判定标准:阳性(Ct值≤37,典型扩增曲线),灰区(37
1.5病毒基因S检测 应用市场上流通的某商品化试剂进行病毒基因S的检测,按照试剂说明书配制体系和设置反应条件,放置Bio-Rad CFX96荧光定量PCR仪检测。按照试剂说明书判定结果。
2 结 果
2.1人体细胞管家基因GAPDH的检测 4例2019-nCoV确诊病例的咽拭子和痰标本中,人体细胞管家基因GAPDH均呈现明显典型的扩增信号曲线(图1)。但痰标本中人细胞管家基因GAPDH扩增曲线信号强于咽拭子,CT值均低于咽拭子(表1)。
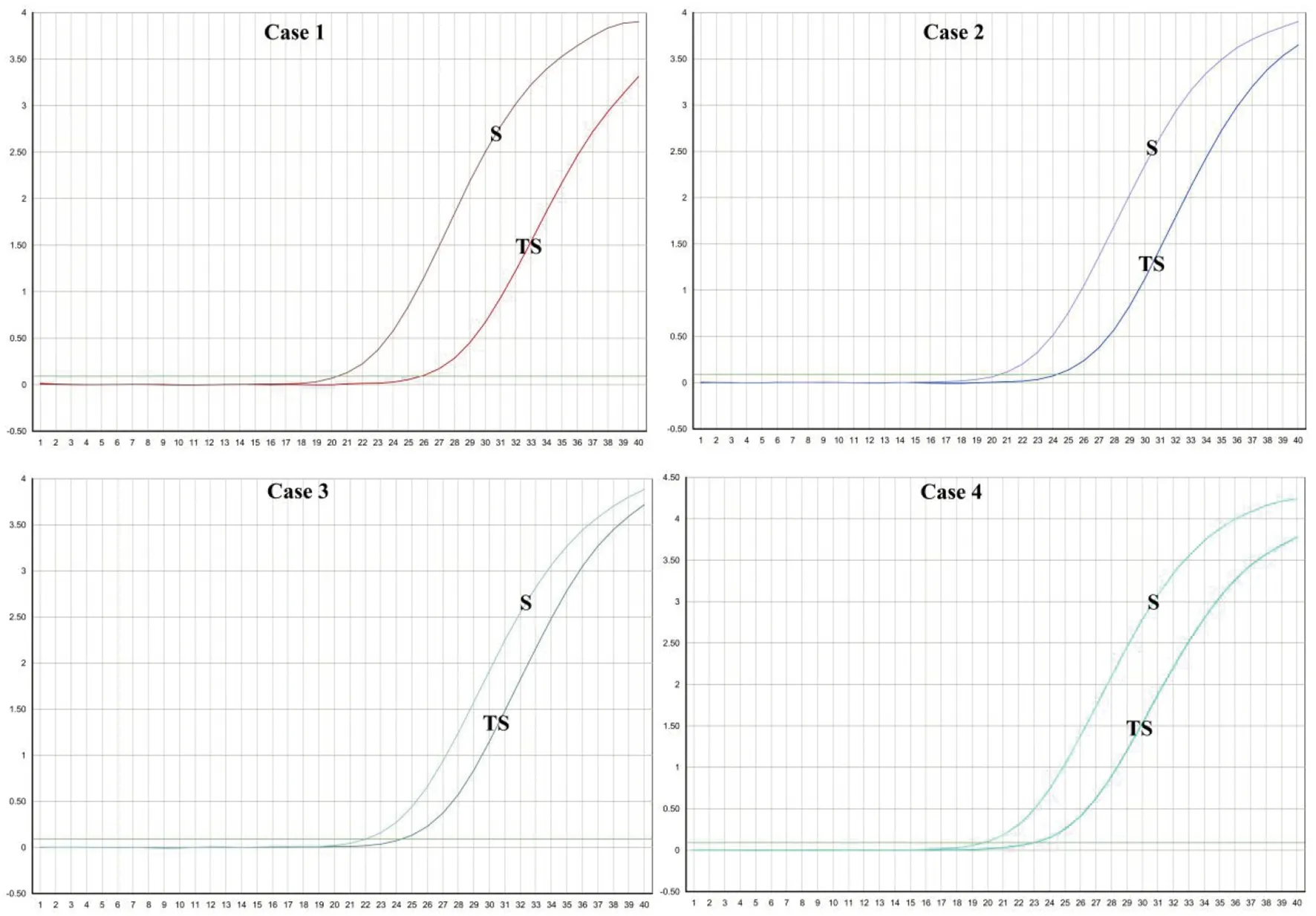
图1 4例2019-nCoV确诊病例咽拭子(TS)和痰(S)标本的人细胞管家基因GAPDH的扩增曲线Fig.1 Amplification curves of human cell housekeeping gene GAPDH in throat swab (TS) and sputum (S) specimens from 4 2019-nCoV confirmed
表1 4例2019-nCoV确诊病例咽拭子和痰标本相关基因核酸检测CT值
Tab.1 CT value of gene nucleic acid detection in throat swab and sputum samples of 4 2019-nCoV confirmed cases
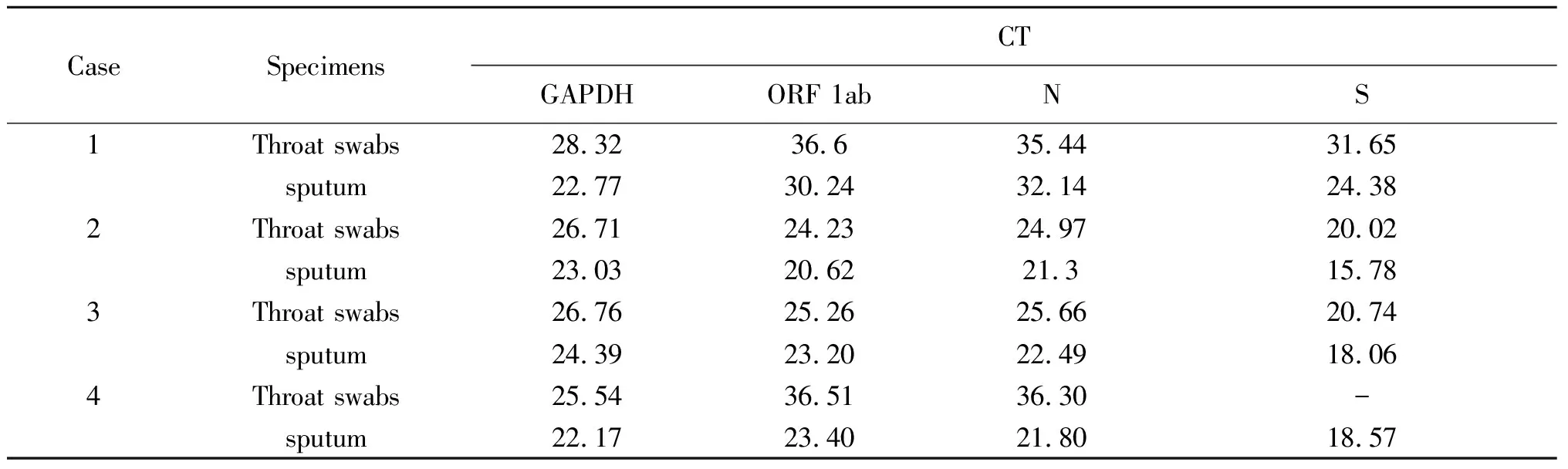
CaseSpecimensCTGAPDHORF 1abNS1Throat swabs28.3236.635.4431.65sputum22.7730.2432.1424.382Throat swabs26.7124.2324.9720.02sputum23.0320.6221.315.783Throat swabs26.7625.2625.6620.74sputum24.3923.2022.4918.064Throat swabs25.5436.5136.30-sputum22.1723.4021.8018.57
2.2病毒ORF 1ab基因及N基因的检测 采用实验室检测技术指南发布的2019-nCoV荧光PCR检测引物和探针对4例2019-nCoV确诊病例的咽拭子和痰标本分别进行病毒基因ORF 1ab(图2)及基因N(图3)核酸检测。结果显示,4例2019-nCoV确诊病例的咽拭子和痰标本,无论是病毒基因ORF 1ab还是基因N的荧光信号扩增曲线中,痰标本的扩增曲线信号均比咽拭子强。其中,在病例1和病例4,咽拭子的病毒基因ORF 1ab及基因N的荧光信号均很微弱,而痰标本的信号则较明显。同样,痰标本中病毒基因ORF 1ab及基因N扩增曲线的CT值均低于咽拭子(表1)。
2.3病毒S基因检测 应用商品化试剂对4例2019-nCoV确诊病例的咽拭子和痰标本进行病毒基因S(图4)核酸检测。结果显示,痰标本中病毒基因S的扩增曲线信号强于咽拭子,CT值均低于咽拭子(表1)。而在病例4的病毒基因S核酸检测中,咽拭子呈现阴性结果。
3 讨 论
本研究对4例新型冠状病毒确诊病例的咽拭子与痰标本分别进行人体细胞GAPDH管家基因、病毒ORF 1ab基因、N基因及S基因核酸检测与比较。GAPDH管家基因几乎在所有组织中都高水平表达,在同种细胞或者组织中的表达量一般是恒定的。本研究通过检测咽拭子和痰标本的GAPDH管家基因来评估标本的采集质量及核酸提取质量,结果表明这4例新型冠状病毒确诊病例的咽拭子与痰标本的标本质量及核酸提取效果均符合要求。
对于新型冠状病毒的实验室检测,我们采用实验室检测技术指南发布的2019-nCoV荧光PCR检测引物和探针对4例2019-nCoV确诊病例的咽拭子和痰标本分别进行病毒ORF 1ab基因及N基因核酸检测,用市场流通的某商品化试剂对病毒S基因进行核酸检测。结果均表明,痰标本的病毒含量均高于咽拭子标本,痰标本的检测效果优于咽拭子,其中,在病例1和4表现更加明显,特别在病例4的咽拭子标本检测中,商品化试剂呈现阴性结果,而痰标本则呈现非常明显的阳性结果。且在病毒核酸提取过程,我们采取双倍标本(280 μL)提取核酸,如果采取常规的140 μL标本提取,病例1和4的核酸检测,可能都会出现阴性结果导致漏检。在痰标本的液化过程中,我们采用等体积的1%胰酶(AMRESCO, Solon, Ohio, USA)与痰液混合37 ℃孵育震荡液化15 min,但是痰标本的液化效果依旧不是很理想,如果能找到更佳的液化痰标本的方法,那么从痰标本中获取的病毒含量可能更高,更有利于实验室检测。
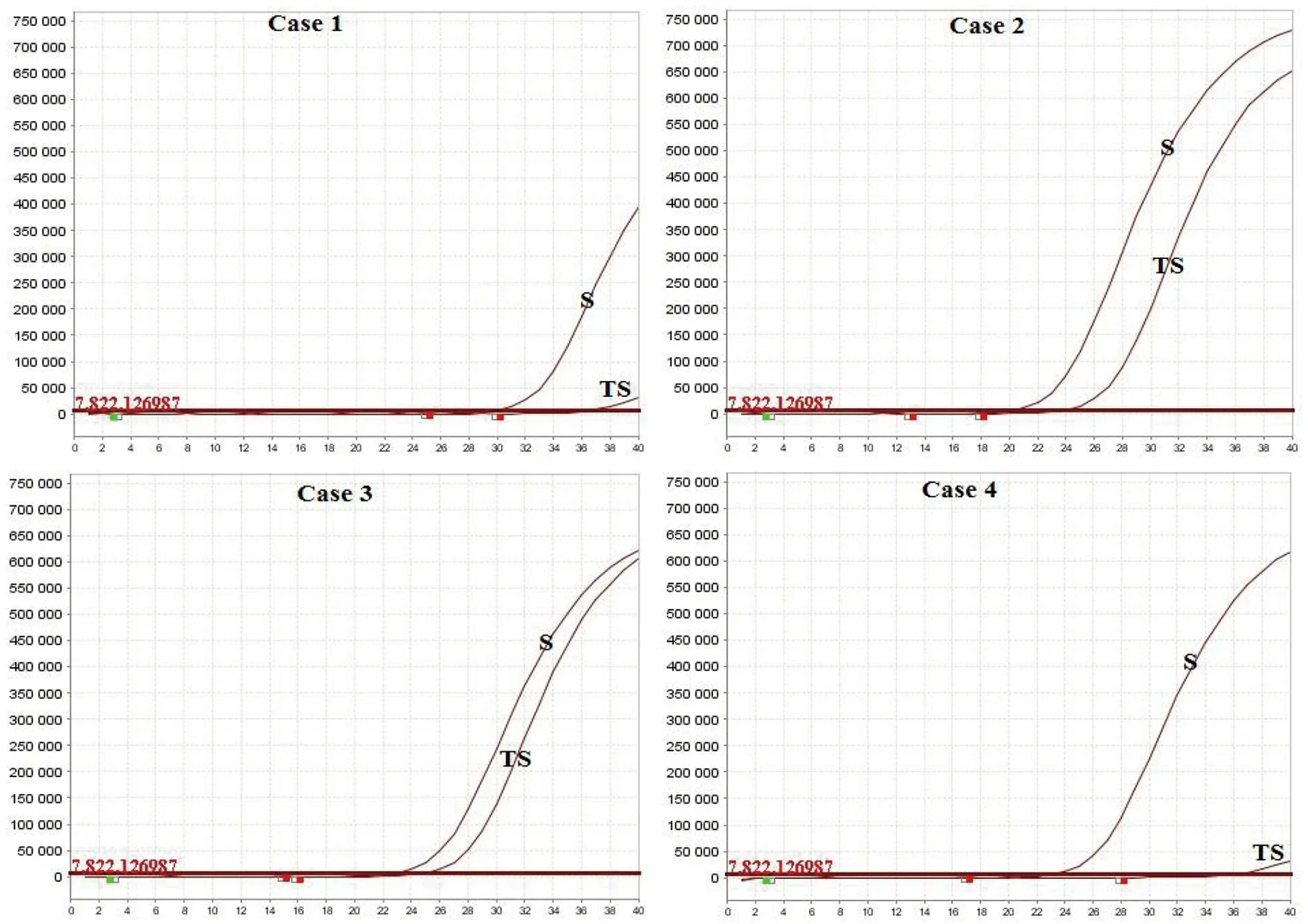
图2 4例2019-nCoV确诊病例咽拭子(TS)和痰(S)标本的病毒ORF 1ab基因的扩增曲线Fig.2 Amplification curves of viral gene ORF 1ab in throat swab (TS) and sputum (S) specimens from 4 2019-nCoV confirmed cases
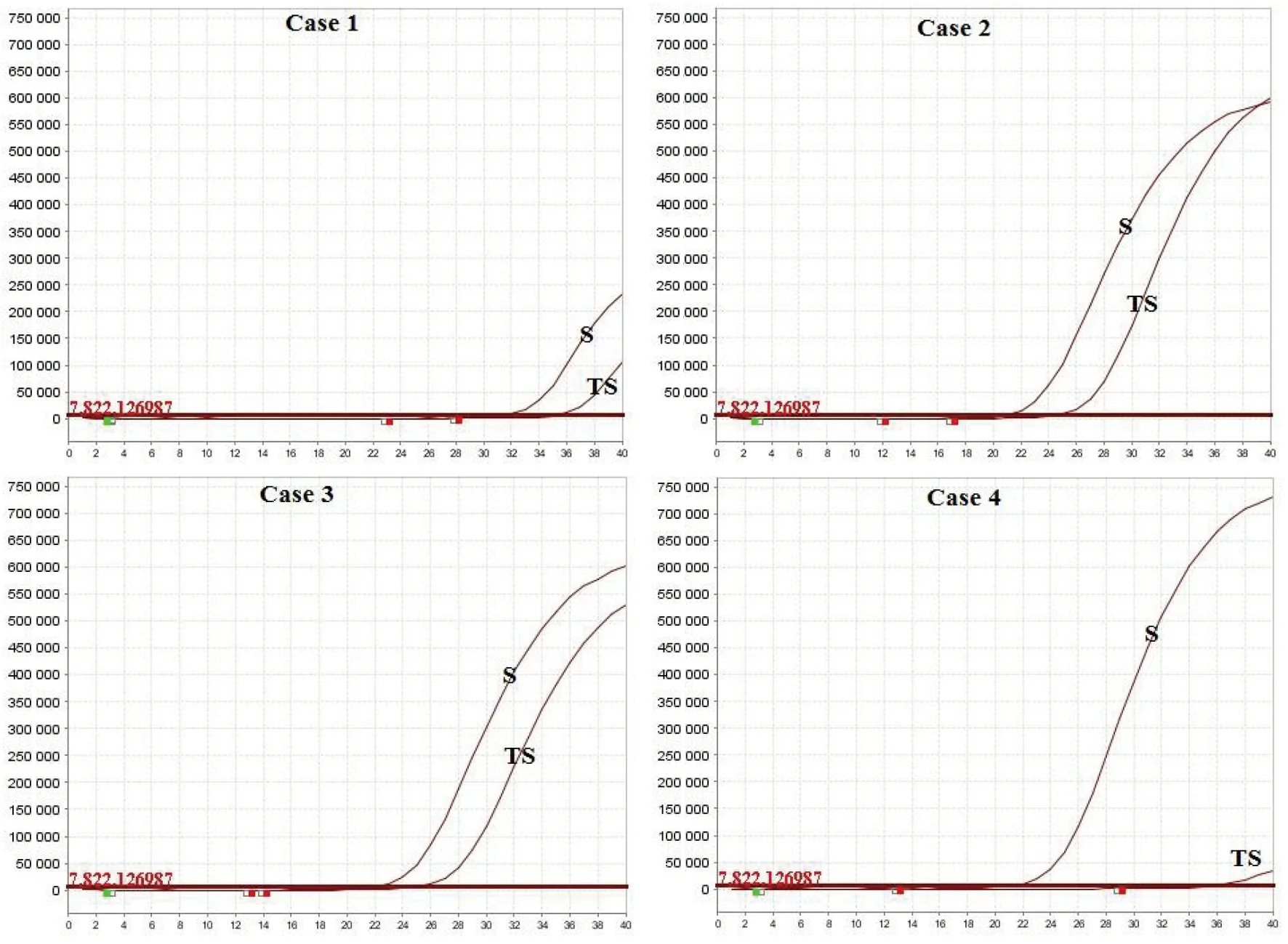
图3 4例2019-nCoV确诊病例咽拭子(TS)和痰(S)标本的病毒N基因的扩增曲线Fig.3 Amplification curves of viral gene N in throat swab (TS) and sputum (S) specimens from 4 2019-nCoV confirmed cases
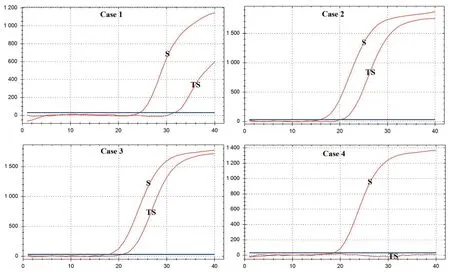
图4 4例2019-nCoV确诊病例咽拭子(TS)和痰(S)标本的病毒基因S的扩增曲线Fig.4 Amplification curves of viral gene S in throat swab (TS) and sputum (S) specimens from 4 2019-nCoV confirmed cases
痰标本的病毒含量高于咽拭子标本,可能与新型冠状病毒主要侵袭感染下呼吸道细胞有关,进而产生咳嗽、肺炎等临床表现。同时,本研究结果也提示,在新型冠状病毒感染肺炎病例实验室确诊及出院实验室诊断时,以咽拭子病毒核酸检测阴性作为排除感染及治愈标准在实施过程中需谨慎,必要时应当采集痰等其他标本进行检测。此外,本结果也提示,当前疫情防控措施需要增加宣传公众特别是肺炎患者不随地吐痰,加强痰液管理及公共场所地面环境的卫生消毒工作。
了解新型冠状病毒在咽拭子、痰液、血液及粪便不同标本中的病毒含量及存在时间,是实验室诊断新型冠状病毒感染肺炎病例及判断病例治愈的重要环节。本研究结果为新型冠状病毒实验室检测中标本的选择及防控措施等提供了一些建议。由于标本数量较少,在此后工作中,将进一步收集更多的数据进行比较分析。

