庆大霉素损伤条件下大肠杆菌内源过氧化氢对间体膜囊的作用
钟永亮,李 欣,1b,2,庞新跃,刘雪茹
(1.河南科技大学a.食品与生物工程学院;b.食品加工与安全国家级实验教学示范中心;c.医学技术与工程学院,河南 洛阳 471023; 2.河南省食品微生物工程技术研究中心,河南 洛阳 471023)
0 引言
间体膜囊是细菌在特殊环境下产生的一种由细胞质膜内褶而形成的囊状膜构造,参与细胞的多种生命活动[1-2],如作为电子传递、磷酸化、氧化还原反应的发生位点[1, 3],以及参与细胞分裂周期的DNA复制和分裂等[4-6]。众多研究证实,菌体的损伤会诱导细胞形成间体膜囊[7-10]。当菌体在恶劣环境胁迫下,氧化磷酸化作用会增强,细胞膜流动性增强,从而内褶形成间体膜囊,细胞的表面积增大,促进氧化反应,维持细胞代谢平衡[1]。不同抗生素损伤过的细菌均出现了间体膜囊,猜测细菌经适当的化合物、机械等损伤后也可能出现间体膜囊[2]。文献[11-15]研究发现:在受损的菌体中均出现内源过氧化氢(H2O2)的大量积累,且受损时形成的间体膜囊是这些内源H2O2的主要积累位点。

丙二醛(maleic dialdebyde, MDA)是多不饱和酸过氧化的主要产物之一,其细胞毒性较为显著。表现在机体内部氧自由基对膜上的不饱和脂肪酸进行攻击,伴随着攻击所衍生的脂质过氧化物,能对细胞膜原有结构造成损伤,进而导致细胞膜通透性的增高,在此基础之上,细胞膜出现损伤,同时,功能以及相关代谢过程受到影响,甚至直接导致细胞死亡[21-25]。所以,测定细胞悬液的MDA浓度可间接反映细胞的损伤程度。庆大霉素(gentamicin, GM)属于氨基糖类的广谱抗生素,与细菌中的30S核糖体亚单位16rRNA解码区的A部位发生直接作用,进而对蛋白质的合成加以阻碍,使得翻译异常或中断,最终导致菌体破裂而亡[26-27]。
本文选择庆大霉素对野生型大肠杆菌MG1655进行损伤处理,以电导率和MDA为损伤指标,对内源H2O2进行组织化学染色后,通过透射电子显微镜(transmission electron microscope, TEM)观察细菌损伤前后的变化情况,研究庆大霉素损伤处理对大肠杆菌内源H2O2和间体膜囊的影响。
1 材料与方法
1.1 材料
试验中所用的野生型大肠杆菌MG1655,由美国伊利诺伊大学微生物学院James A. Imlay教授惠赠,并采用Luria-Bertani(LB)培养基进行37 ℃活化与进一步培养。
氯化铈(CeCl3,分析纯):英国Sigma公司;硫酸庆大霉素(美国药典级):上海生工生物公司;溶菌酶(分子生物学级,酶活≥20 000 U/mg):上海生工生物公司;50%戊二醛溶液(质量分数50%,化学纯):上海生工生物公司;微量MDA测试盒:南京建成生物工程研究所。
TGL-16型台式高速冷冻离心机:湖南湘仪离心机仪器有限公司;雷磁DDS-307型电导率仪:上海仪电科学仪器股份有限公司;日立F-4500型荧光分光光度计:深圳市昊光机电科技应用有限公司;TEM-100C型透射电子显微镜:日本电子株式会社。
1.2 方法
1.2.1 电导率检测
将大肠杆菌培养至对数生长期,用梯度质量浓度的庆大霉素处理菌体后,6 000g室温离心10 min,此时测定上清液电导率并记录为σm。去除培养液中的上清液,将无菌水重悬菌沉淀,并静置于室温中5 min,此时测定菌悬液的电导率并记录为σs,重复上述操作直至数据稳定。根据记录,将横坐标定为σm,纵坐标定为σs,进行坐标轴的绘制,坐标图中直线与横坐标的相交点为细胞的电导率σp[28]。使用Origin软件绘制菌体电导率和上清液的折线图,横坐标为不同终质量浓度的庆大霉素,两个纵坐标分别为σp和σs。
1.2.2 间体膜囊的外排和制备
将大肠杆菌培养至对数期,6 000g离心10 min收集菌体,用Tris-HCl缓冲液(pH7.5)洗涤离心2次,去除上清液后加入原培养液1/10体积的Tris-HCl蔗糖高渗溶液重悬。室温静置90 min后,加入溶菌酶至终浓度为8.5 mol/L,37 ℃、80 r/min摇床处理30 min,再进行10 000g的离心,而后将含有间体膜囊的上清液轻轻吸出,将上清液置于4 ℃的环境中进行420 000g的离心,完成后静置120 min。将上清液去除之后即可获得间体膜囊沉淀,再通过适量的Tris-HCl缓冲液重悬间体膜囊,于-20 ℃存放备用[29]。
1.2.3 紫外光谱法和荧光光谱法测定H2O2浓度
利用H2O2在240 nm处有吸收峰的光谱特性[30-32],采用紫外光谱法对庆大霉素作用后的细菌内源H2O2浓度进行测定。按照文献[33-34]的方法,通过荧光光谱法对间体膜囊外排过程中上清液的H2O2浓度进行测定。
1.2.4 组织化学染色法检测H2O2浓度
参照文献[35]的测定方式,使用CeCl3进行H2O2的特异染色。通过离心进行菌体的收集,用50 mmol/L CeCl3重悬菌体,在37 ℃预处理90 min,再用醋酸铀和醋酸铅实施样品复染,借助TEM对铈过氧化物的沉积物进行观测。
1.2.5 硫代巴比妥酸(2-thiobarbituric acid, TBA)比色法检测MDA浓度
根据MDA测试盒相关要求,针对性地配制空白管、测定管、标准管和标准空白管,并用漩涡混匀器混匀,95 ℃水浴40 min,取出后流水冷却至室温,在可见光波长532 nm处,100 mm光径,以蒸馏水为参比液,测各管吸光度值,按照测试盒说明书中的计算公式换算成MDA的浓度:
(1)
2 试验结果
2.1 庆大霉素损伤对大肠杆菌细胞电导率的影响
菌悬液的电导率σs与细胞膜受损程度存在密切关系,外部环境中内部电解质释放导致σs的变化[36],σs越高,菌体损伤程度越严重。而σp是菌体颗粒的电导率,受菌体细胞壁上的羧基、磷酸盐和胺基等电解质类酸性基团分解的影响[37-38],σp越低,说明菌体的损伤越严重。
图1为庆大霉素损伤对大肠杆菌MG1655细胞电导率的影响。分析图1可知: 虽然上清液电导率σs和菌体颗粒电导率σp变化无明显规律,但两者的变化趋势相反。当庆大霉素终质量浓度为2.0 μg/mL时,σs和σp差值最大,可确定为有效且最优的损伤浓度。
2.2 紫外光谱法确定庆大霉素的最佳损伤时间
图2为庆大霉素损伤后大肠杆菌内源H2O2浓度随时间的变化。吸光度反映H2O2的浓度,吸光度A240的值越高,说明H2O2的浓度越高。由图2可知:随着庆大霉素损伤时间延长,细胞内源H2O2浓度呈现缓慢升高的趋势。在损伤时间为26 min时,内源H2O2浓度趋于峰值并保持稳定状态,所以确定26 min是庆大霉素的最佳损伤时间。
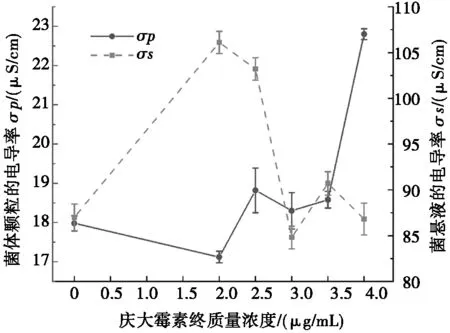
图1 庆大霉素损伤对大肠杆菌MG1655细胞电导率的影响
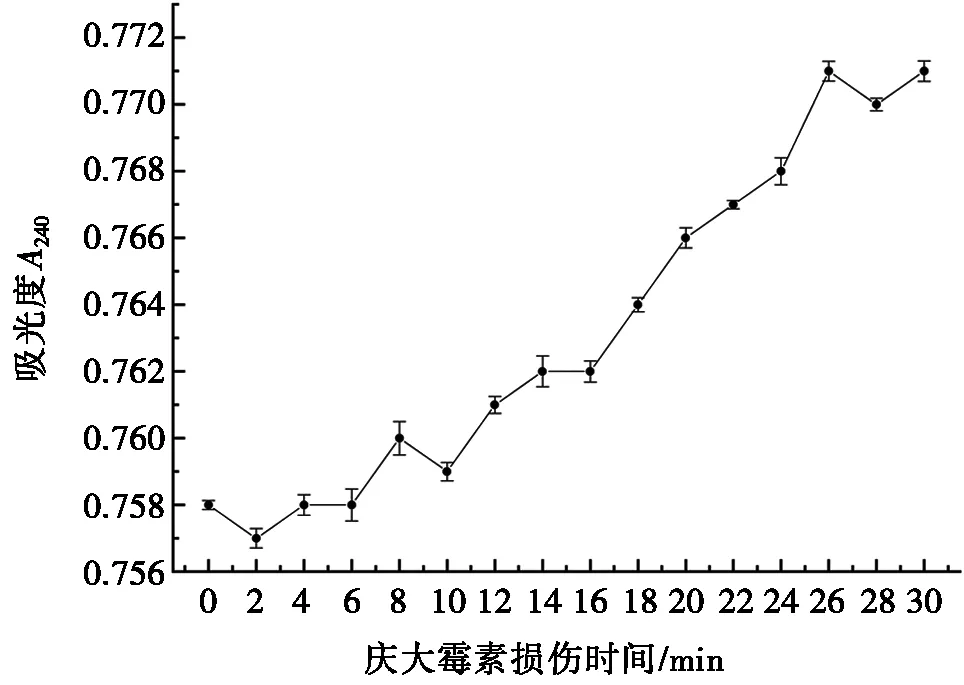
图2 庆大霉素损伤后大肠杆菌内源H2O2浓度随时间的变化
2.3 庆大霉素损伤对大肠杆菌内源H2O2和间体膜囊的影响
图3为庆大霉素损伤对大肠杆菌内源H2O2和间体膜囊的影响。对比图3a和图3b可知:庆大霉素损伤后,大肠杆菌周围的H2O2沉积量显著提升,并且间体膜囊数量增多。使用Image-Pro Plus7.0图像软件对菌体周围积累的H2O2面积占细胞面积的比例进行二维分析,损伤处理前后的面积占比分别为1.85%和32.05%。图3c和图3d为庆大霉素损伤前后离体的间体膜囊,由图3c和图3d可知:经庆大霉素损伤后,离体间体膜囊外周H2O2沉积显著增加,离体间体膜囊外周H2O2面积与菌体面积之比由54.59%增加至87.45%。上述结果充分表明:庆大霉素所造成的损伤致使大肠杆菌内源H2O2增加,并且间体膜囊聚集大量的H2O2。

(a) 庆大霉素损伤前的大肠杆菌
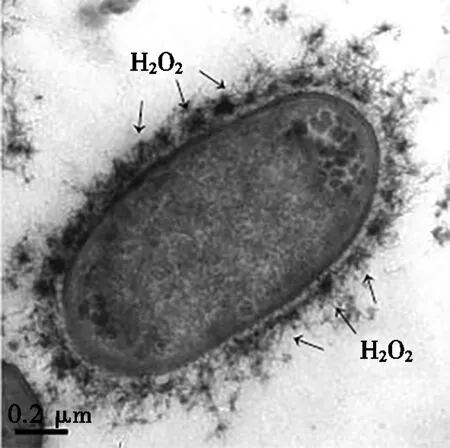
(b) 2.0 μg/mL庆大霉素损伤后的大肠杆菌
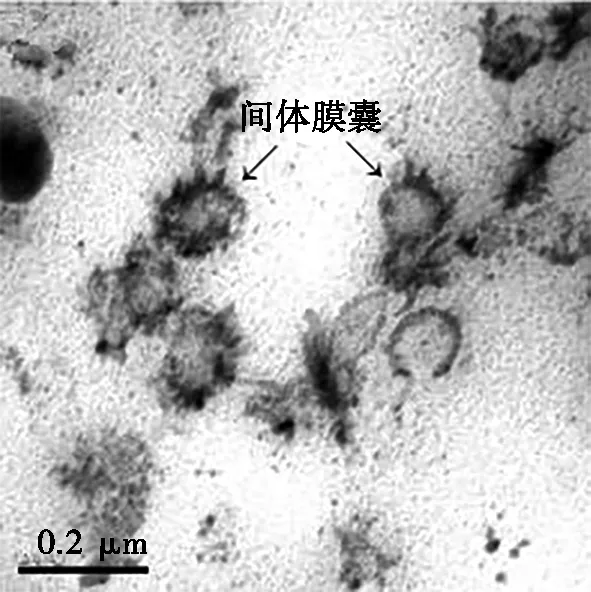
(c) 庆大霉素损伤前的离体间体膜囊

(d) 2.0 μg/mL庆大霉素损伤后的离体间体膜囊
图3 庆大霉素损伤对大肠杆菌内源H2O2和间体膜囊的影响
2.4 间体膜囊外排过程中H2O2和电导率的变化
观察图3能够发现:大肠杆菌经庆大霉素损伤处理,致使菌体和其间体膜囊的外周聚集大量的H2O2,间体膜囊外排。测定不同时段H2O2浓度和电导率的变化,可在一定程度上解析H2O2聚集在间体膜囊外周的时间段,以及间体膜囊与H2O2两者间存在的联系。
图4为间体膜囊外排过程中上清液H2O2浓度和电导率变化。由图4可知:通过Tris-HCl蔗糖高渗溶液处理90 min之后,采用荧光光谱法测得间体膜囊外排过程中,上清液的H2O2浓度明显增加,上清液的电导率下降;Tris-HCl蔗糖+溶菌酶处理相较于Tris-HCl蔗糖高渗溶液处理的结果并没有明显区别。说明在Tris-HCl蔗糖高渗溶液处理的90 min内,菌体大量产生内源H2O2,且在此期间细胞膜的损伤程度逐渐减弱。
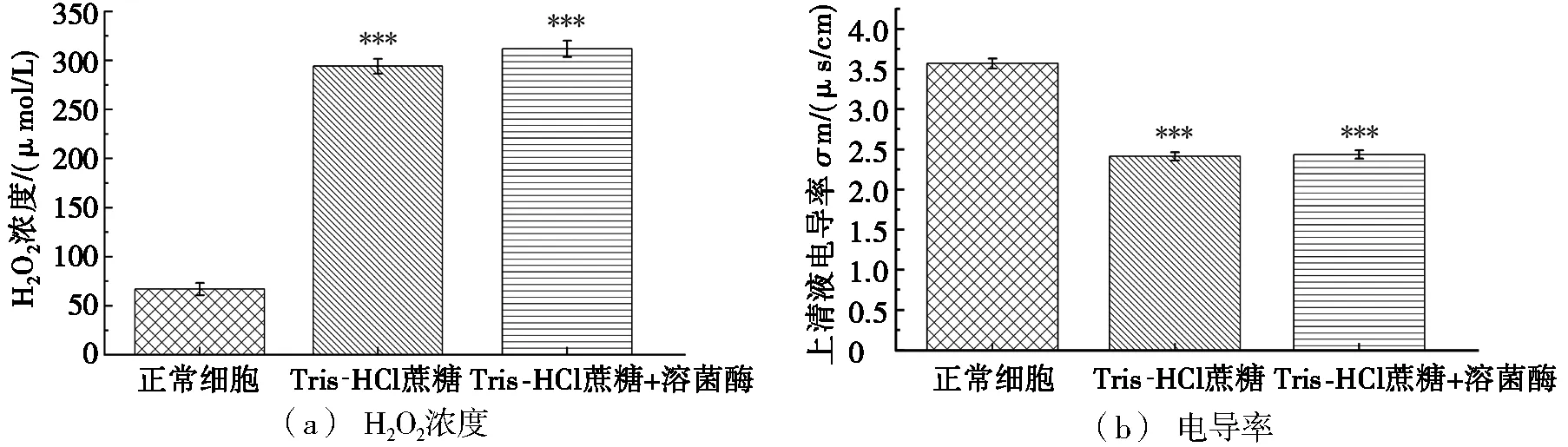
图4 间体膜囊外排过程中上清液H2O2浓度和电导率变化
2.5 内源H2O2浓度对间体膜囊MDA浓度的影响
对图4数据进行分析发现,菌体经Tris-HCl蔗糖高渗溶液处理后,其内源H2O2的浓度大幅度提升,并且上清液电导率下降,侧面说明随着H2O2浓度的上升,细胞膜的损伤得到缓解。图5为过氧化氢酶和庆大霉素处理对间体膜囊MDA浓度的影响。分析图4和图5的数据发现:经过过氧化氢酶或庆大霉素或两者共同处理,都能有效提高间体膜囊的MDA浓度。综上分析,内源H2O2的产生和间体膜囊外排H2O2可能有利于减轻大肠杆菌的损伤,发挥一定的保护作用,但仍需进一步研究验证。

图5 过氧化氢酶和庆大霉素处理对间体膜囊MDA浓度的影响
3 讨论
外排的间体膜囊外周聚集大量的H2O2,内源H2O2的产生和间体膜囊的外排似乎同时进行,并且随着H2O2浓度的提升,细胞的损伤程度出现显著性下降,说明内源H2O2的产生和间体膜囊外排H2O2可能有利于减轻大肠杆菌的抗损伤能力,但其保护机理需后续试验验证。庆大霉素的损伤和过氧化氢酶处理会使间体膜囊中的MDA浓度提升,而过氧化氢酶能有效清除H2O2,因此间体膜囊损伤程度与H2O2浓度呈相反的趋势。进一步验证间体膜囊周围积累的H2O2浓度对间体膜囊具有保护作用,即伴随间体膜囊外排产生的H2O2以及庆大霉素损伤条件下间体膜囊自身产生的H2O2都对间体膜囊具有保护作用。庆大霉素和过氧化氢酶处理的间体膜囊中的MDA浓度远高于未经庆大霉素处理的。经庆大霉素损伤能使间体膜囊外周的H2O2积淀增加(H2O2浓度提升),结合H2O2的保护作用,可说明庆大霉素和过氧化氢酶共同作用后的间体膜囊中MDA浓度增多,且损伤程度更严重。
大肠杆菌经庆大霉素损伤之后,发现菌体和间体膜囊中H2O2积淀物数量显著性提升,由此可知,间体膜囊可能是一种与正常细菌类似的内源H2O2产生位点,而间体膜囊是否能产生大量的H2O2或间体膜囊是否能聚集胞内H2O2并排到胞外,这些推测仍需后续试验验证。
目前,对于间体膜囊的形成及相关功能的研究尚未有结论,推测间体膜囊可能是一种特殊的电子传递通道[15],但已有研究表明间体膜囊中含有参与氧化还原反应所需的氧化还原酶以及所有细胞色素,真核细胞的线粒体与间体膜囊两者功能存在许多相同之处,由此可知间体膜囊与线粒体DNA之间的联系是存在的[1, 3],有相关研究指出间体膜囊是一种线粒体的等同物[1, 3]。但鉴于间体膜囊与线粒体两者之间的结构功能等存在一定差异性[1],同时,针对线粒体内含物的研究还存在许多不明之处,猜测间体膜囊可能是线粒体的一种内含物,或是线粒体的一种衍生物。文献[20]研究认为,间体膜囊具有重要的生物学功能,但是间体膜囊中的活性物质尚不清楚。
本试验研究结果证实了间体膜囊与H2O2之间的特殊关系,间体膜囊可能通过H2O2这一信号传递因子来完成更多的生理功能,而不仅仅只是损伤条件下的自我保护。对间体膜囊与H2O2的进一步研究将有助于更深入地了解间体膜囊。
4 结论
(1)使用非致死的庆大霉素损伤野生型大肠杆菌MG1655,损伤浓度与损伤程度并非呈正相关,且损伤期间细胞的内源H2O2浓度随时间的增长趋于稳定。庆大霉素损伤的最佳终质量浓度为2.0 μg/mL,最佳损伤时间为26 min。
(2)庆大霉素损伤后的大肠杆菌外周以及离体间体膜囊外周H2O2的积淀量明显增加。
(3)当大肠杆菌受到庆大霉素损伤时,大量内源H2O2聚集在间体膜囊外周,且这些H2O2对间体膜囊具有保护作用。

