利用GFP-Trap 技术筛选与TaTLP1 相互作用的蛋白
王 菲,杨毅清,武文月,崔钟池,王海燕,刘大群,2
(1.河北农业大学 植物保护学院/河北省农作物病虫害生物防治工程技术研究中心,河北 保定 071000; 2.中国农业科学院 研究生院,北京 100081)
小麦叶锈菌(Puccinia triticina)是一种专化性很强的活体营养型寄生真菌,具有高度遗传多样性,且小种进化速度极快。在生产中,大多利用化学农药和抗病育种的方法来防治小麦叶锈病[1],然而化学农药会给生态环境造成极大的压力与负担,因此应开展小麦与叶锈菌互作关系的研究,明确植物抗、感病信号通路,发掘更多优良基因,将其转入种植的农家品种中,对于小麦抗锈性的合理布局和小麦锈病的可持续控制具有重要的理论指导作用。
植物受到病原物侵染后,会产生高效的防御机制,如超敏反应(Hypersensitive Response, HR)[2]、活性氧的迸发(Oxidative Burst)[3]、病程相关蛋 白(Pathogenesis-Related Proteins, PRs)[4]的产生等。PR 蛋白共有18 个家族(PR1 ~PR18)[5],大量研究表明,病程相关蛋白在植物抗病反应中起到关键作用,特别是针对于植物的系统获得性抗性(SAR)。
PR5 家族属于类甜蛋白家族(TLPs),分为Thaumatin、Zeamatin、Osmotin 三类,可裂解真菌菌丝的细胞壁,具有抗真菌活性,在植物防御系统中起到关键的作用。Cao 等[6]通过对拟南芥、水稻、杨树、玉米等植物进行全基因组序列分析,发现TLPs 基因具有保守结构域,可参与生物与非生物胁迫。Ojola 等[7]将水稻类甜蛋白基因Ostlp 通过转基因技术转入木薯中,该基因的超表达增强了木薯对炭疽病的抗性。麻楠等[8]通过串联亲和纯化(Tandem Affinity Purifica-tion, TAP)与质谱联用的方法明确了小麦中翻译控制肿瘤蛋白(Translationally Controlled Tumor Protein, TCTP) 与 类 甜 蛋 白TaTLP1 互作,增强小麦抵抗叶锈菌侵染的能力。Jiao 等人[9]发现从香蕉中分离纯化出的BanTLP 基因能够在pH 4 ~10、温度20 ~50 ℃的范围内发挥作用,使青霉真菌细胞渗透压发生变化,破坏真菌细胞结构,导致病原菌的死亡。Manghwar 等[10]将小麦根腐病菌分别接种于不同品种的小麦和玉米中,发现该病原菌接种于小麦抗病品种‘RWP13’时,PR1、TLP、β-1,3-葡聚糖的表达量明显提高,而接种于小麦感病品种SWG13 后,这些基因没有表达,而且该试验结果在玉米中得到了同样的证明。因此可将这些抗病基因通过转基因的方式转入感病植物中,可以提高寄主植物的抗病性。
小麦基因组庞大,且含有较多的重复序列,与病原菌的互作研究相对滞后。本研究前期获得了小麦类甜蛋白基因TaTLP1(Genbank 登录号:KJ764822),qRT-PCR(Quantitative real time polymerase chain reaction)分析结果表明,TaTLP1在接种叶锈菌后36、96、120 h 表达量上调,表明该基因的表达受叶锈菌的诱导,且基因与蛋白表达趋势一致[11];Zhang 等[12]明确了该基因定位于胞外,且该基因参与TcLr19 小麦抗叶锈病防御反应。已有研究结果都表明该基因参与了小麦抗叶锈病防御反应,但对于该基因参与抗病反应的分子机制还不了解。本研究拟利用Gateway 克隆技术构建重组载体TaTLP1-pEarleyGate103,通过烟草异源表达该蛋白,进一步利用GFP-Trap 技术快速钓取与TaTLP1 互作的蛋白,以期为小麦与叶锈菌互作的研究奠定基础。
1 材料与方法
1.1 试验材料
植物材料:本氏烟;质粒:pEarleyGate 103、阳性对照质粒PR1-Promoter。
1.2 主要试剂
试剂:pENTR/D-TOPO(Invitrogen)、卡那霉素、ECL 显色液(上海生工生物工程有限公司)、硝酸纤维素膜(酷莱博)、限制性核酸内切酶MluI(TaKaRa)、GFP 一抗(兔抗)、羊抗兔HRP 二抗(索莱宝)、蛋白marker(赛默飞)。
1.3 试验方法
1.3.1 引物设计 按照Gateway 定向克隆技术的要求,通过primer-premier 5.0 软件设计含有信号肽的TaTLP1 的入门载体引物。同时,因为入门载体(pENTR/D-TOPO)上特殊位点attL1 的一侧突出了4 个碱基,即GTGG,所以需在上游引物的5'端加上对应的4 个碱基,即CACC。引物由上海生工生物工程有限公司合成(表1)。

表1 PCR 引物的序列Table1 Sequences of primers for PCR
1.3.2 TaTLP1-pEarleyGate 103 的构建 利用表1中的引物进行PCR 扩增,获得平末端PCR 产物;纯化产物用于连接体系的配置:PCR 产物4 µL,盐溶液1 µL,TOPO 载体1 µL,瞬时离心,25 ℃室温孵育过夜;取连接液,通过热激法将其转化到大肠杆菌感受态细胞DH5α 中,PCR 验证无误后,送北京中科希林测序,入门重组载体TaTLP1-pENTR 构建成功。
由于试验用入门载体pENTR/D-TOPO 和终载体pEarleyGate 103 都是卡那霉素抗性,导致抗生素筛选困难。因此,需利用Mlu I 限制性内切酶酶切TaTLP1-pENTR,并纯化,将其与带有GFP 标签的Gateway 载体pEarleyGate103 连接。连接体系为:酶切纯化后的TaTLP1-pENTR 7.7 µL,pEarleyGate103质粒0.3 µL,LR 酶2 µL,25 ℃室温过夜,蛋白酶K 1 µL,37 ℃终止连接反应。将连接液转化到大肠杆菌感受态细胞DH5α 中,PCR 验证、测序。
1.3.3 TaTLP1 蛋白的异源表达 将TaTLP1-pEarley-Gate 103 转化到农杆菌感受态细胞GV3101 中,借助烟草的异源表达技术,选择4 ~6 叶期本氏烟草叶片的第2 ~5 叶注射含有重组载体TaTLP1-pEarleyGate 103 的菌液[13],避光培养48 h 后,利用生工植物活性蛋白质提取试剂盒,使用液氮将叶片研磨成粉末状,在冰冻的条件下,加入蛋白提取缓冲液,4 ℃条件下缓慢融化后,将其转移至无菌离心管中,于4 ℃ 12 000 r/min 离心20 min,此时液面分为有机层、蛋白液、沉淀层,获得该蛋白,于-20 ℃分装保存。
制备SDS-PAGE 胶(15%分离胶,5%浓缩胶),90 V,10 min;120 V,120 min 电泳,利用湿转法将蛋白转移到0.45 µm 的NC 膜上,丽春红染色检测转膜情况,按1∶1 000 的比例分别稀释GFP 一抗和HRP 二抗,孵育膜上的融合蛋白,ECL 显色液于黑暗环境下膜上孵育2 min,利用BIO-RAD 公司的ChemiDoc Touch Imaging System 进行膜上曝光,检测蛋白曝光结果。
1.3.4 利用GFP-Trap 钓取TaTLP1 的互作蛋白 按照Chromotek 公司GFP-Trap 的试剂盒说明操作:将TaTLP1 蛋白液加入预冷的裂解缓冲液,在冰上放置30 min,每10 min 充分吹吸1 次;4 ℃,1 300 r/min,离心10 min,取上清,向其中加入稀释缓冲液;将珠子与上清混合,4 ℃上下缓慢摇动6 ~8 h,500 r/min,4 ℃,离心2 min;弃上清,利用pH 2.5的甘氨酸溶液洗脱挂在珠子上的纯化蛋白;通过pH 10.4 的Tris 溶液来调整蛋白洗脱液的酸碱度,加上样缓冲液,western blot 检测无误后,将纯化蛋白的泳道切下来,送北京华大蛋白质研发中心有限公司进行质谱分析。
2 结果与分析
2.1 Gateway 克隆技术构建重组载体TaTLP1-pEarleyGate 103
Gateway 定向克隆技术无需BP 反应,可将平末端PCR 产物定向克隆到入门载体pENTR/D-TOPO上。利用表1 中的引物扩增TaTLP1 基因,琼脂糖凝胶电泳结果显示,扩增产物为516 bp,与预期大小一致(图1A)。利用TaKaRa 的凝胶回收试剂盒回收目的片段,通过连接体系将TaTLP1 连接到TOPO 载体上,获得TaTLP1-pENTR 入门重组载体。
利用限制性内切酶Mlu I 酶切构建好的TaTLP1-pENTR 重组体,酶切产物纯化后,在LR 酶的作用下与终载体pEarleyGate103(图1B)连接,转化大肠杆菌,经菌落PCR 验证,检测到插入片段为516 bp,测序结果表明序列正确,表明成功构建TaTLP1-pEarleyGate103 终载体。

图1 重组载体TaTLP1-pEarleyGate103 的构建Fig1 Construction of recombinant vector TaTLP1-pEarleyGate103
2.2 TaTLP1 蛋白的表达检测
由于pEarleyGate103 载体中GFP-tag 位于插入位点attR1 和attR2 之后,pEarleyGate103 空载体在烟草细胞中检测不到GFP 基因表达。因此以PR1-Promoter 作为阳性对照,经质壁分离后,荧光显微镜下观察显示,阳性对照组中细胞核、质、膜中均可以看到明显的GFP 荧光; TaTLP1-pEarleyGate103 的实验组中,GFP 荧光出现在细胞间隙,表明TaTLP1在烟草中成功表达(图2A)。
提取成功表达TaTLP1 的烟草全蛋白,预计融合蛋白应为45 kD。通过SDS-PAGE 凝胶电泳,考马斯亮蓝R250 染胶,结果显示条带清晰、主带明显,达到试验要求(图2B-1);Western Blot 转膜后,丽春红染色结果显示清晰的蛋白条带,表明转膜成功(图2B-2);将该蛋白进行GFP 一抗和HRP 二抗杂交,ECL 显色液黑暗条件下膜上孵育,经BIORAD ChemiDoc Touch Imaging System 检测,曝光37 s 后,在40 ~55 kD 出现蛋白条带,位置正确(图2B-3),表明TaTLP1 在烟草中成功表达,达到完成GFP-Trap 的试验要求。
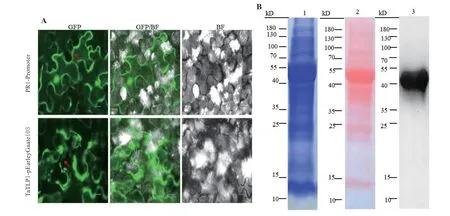
图2 TaTLP1 蛋白的异源表达Fig. 2 Heterologous expression of TaTLP1 protein
2.3 利用GFP-Trap 技术钓取与TaTLP1 互作的蛋白
GFP-Trap 珠子吸附的蛋白纯化收集液经SDSPAGE 凝胶电泳后,考马斯亮蓝染色结果显示,泳道“+”与“-”中的蛋白分别为加入GFP-Trap 珠子和未加入GFP-Trap 珠子的TaTLP1 蛋白。对比两泳道蛋白条带的差异情况,发现在泳道“+”中大约17 kD 处出现差异蛋白条带,证明该处可能存在与TaTLP1 互作的寄主蛋白(图3)。

图3 TaTLP1 蛋白GFP-Trap 的SDS-PAGE 检测Fig. 3 SDS-PAGE detection GFP-Trapof TaTLP1 protein
2.4 TaTLP1 互作蛋白的质谱分析
将2.4 中验证无误的TaTLP1 蛋白通过GFPTrap Beads,获得的洗脱蛋白送由北京华大蛋白质研发中心有限公司,以液相色谱-质谱-质谱(LC/MS/MS)联用方法进行质谱分析。蛋白质谱分析共获得165 个蛋白,包含了PR1、PR5、Osmotic 和非特异性脂质转移蛋白家族等。由于明确TaTLP1 定位于胞外,于是重点分析了定位于胞外的蛋白,其中PR 蛋白家族的评分较高,且定位与胞外[14]。本实验室Gao[15]等克隆获得TaPR1(Genbank 登录号:HQ848391)基因,并且明确该蛋白为17 kD。因此拟计划下一步实验需验证TaPR1 与TaTLP1 的互作关系(见表2)。

表2 蛋白质谱分析获得可能与TaTLP1 存在互作的蛋白Table 2 Summary of proteins that may interact with TaTLP1 by mass spectral analysis
3 讨论
Gateway 技术是一项由Invitrogen 公司开发的快速体外克隆技术,适用于如植物、动物、昆虫、病原等多种系统,该技术无需传统的酶切、连接等步骤,直接利用LR 酶完成表达载体的快速构建。目前国际上已经开发或改造多个带有不同标签的Gateway 载体,可以用于不同目的的重组载体的构建。Anggoro等[20]通过Gateway 克隆技术,构建转基因重组载体,完成稳定遗传的转基因植物的制备,且转入的外源基因的表达水平高达普通方法制备重组载体的3倍,试验效率大大提高;Hatsugai 等[21]利用TOPO定向克隆技术获得两种拟南芥的转基因植物GFPPIP2a 和mRFP-VAM3a,通过Pull down 实验验证植物R 基因产物PRM1 与病原体因子AvrRPM1 之间存在相互作用。Liu 等[22]利用Gateway 克隆技术构建了双分子荧光互补(Bimolecular fluorescence complementation, BIFC) 和 免 疫 共 沉 淀(Coimmunoprecipitation, Co-IP)的不同的载体,通过这两项技术验证了小麦中TaCBL4 和TaCIPK5 存在互作,而且两者的互作会增强小麦对于小麦条锈菌的抗性。然而,目前该技术在小麦叶锈病的研究上还属于空白。本研究利用Gateway 克隆技术成功将前期获得的一个小麦类甜蛋白基因TaTLP1 连接到了带有GFP 标签的Gateway 载体上。由于入门载体pENTR/D-TOPO 和终载体pEarleyGate103 都是卡那霉素抗性,抗生素筛选失去了作用。为了解决这一问题,对入门载体进行改造,即利用Mlu I 限制性内切酶酶切重组入门载体TaTLP1-pENTR,有效分割目的片段,再以LR 酶将其与带有GFP 标签的Gateway 载体pEarleyGate103 连接,对传统的Gateway 克隆进行了适应实际需要的有效改进。
在Gateway 重组载体成功构建的基础上,利用PR 蛋白在植物中的高度保守性这一特点,借助烟草异源表达TaTLP1 基因,在成功对其进行亚细胞定位的同时,利用国际先进的GFP-Trap 技术快速获得了TaTLP1 的互作蛋白。该技术将GFP 结合蛋白(GBP)偶联到琼脂糖球或者磁力珠子上,形成GFP 陷阱。与普通抗体结合GFP 相比,GFP-Trap,结 合GFP 在 时 间 上 要 快5 ~30 min[23]。Xia 等人利用GFP-Trap 技术验证了在拟南芥中泛素受体DA1 与E3 泛素连接酶DA2 的互作[24];Zhang 等人通过GFP-Trap 技术研究发现,真菌的内切多聚半乳糖醛酸酶与拟南芥受体蛋白RBPG1 互作可抑制灰霉病菌的生长[25]。目前国际上常用的获得互作蛋白的方法除了GFP-Trap 技术之外,还包括GST-Pull down、酵母双杂交技术(Yeast Two-Hybrid, Y2H)等。Wang 等[26]人通过酵母双杂交技术,以大豆中响应高温高湿胁迫的GmCDPKSK5 蛋白为诱饵,获得了与之互作的蛋白GmTCTP,并通过GST-Pull down 和双分子荧光互补(BiFC)的方法验证其互作。Zhang 等人利用Pull down 的方法,获得了与棉花黄萎病菌分泌蛋白PevD1 互作的蛋白GhPR5,并通过酵母双杂交(Y2H)、免疫共沉淀(CoIP)的技术验证两者互作,发现该分泌蛋白具有抑制GhPR5 的抗真菌作用,可促进真菌感染[27]。不论用何种方法获得互作蛋白,都需要结合不同实验技术手段验证蛋白互作的真实性,最终明确互作的意义。
在获得与TaTLP1 互作的候选蛋白之前,需将GFP-Trap 获得的纯化产物进行蛋白质谱分析,结果表明有两类蛋白家族值得重点分析:病程相关蛋白家族和非特异性脂质转移蛋白家族。病程相关蛋白1 的评分为521 分,Beatrice 等人以丁香假单孢菌接种猕猴桃,qRT-PCR 结果显示PR1、PR5 表达量增加,而两基因表达量的增加引起了植物体内壳聚糖的积累,从而激发植物体内的抗病防御反应[28]。Chen 等人发现PR1 碳端的氨基酸序列中含有一段短肽(CAPE1),该短肽与植物的PTI(PA-MPs-triggered immunity)有关[29],由于PR1 在许多生物体中序列高度保守,在拟南芥AtPR1 中发现的CAPE1 短肽同样具有抗病的生物学活性,因此该短肽可能有助于增强其他植物物种的抗应激能力。在线软件STRING(https://string-db.org/cgi/input.pl)预测蛋白互作,以PR5 为预测对象,以模式植物拟南芥为背景,预测结果显示PR5 和PR1 之间可能存在相互作用。这些证据均为两者之间互作增加可能性。因该类互作没有相关文献支撑,还需要后续实验验证。
非特异性脂质转移蛋白(nsLTP)评分为266,nsLTP 在植物中大多会参与植物抗病防御反应,序列大多很短,为碱性蛋白,参与植物抗病防御反应,但关于小麦抗病反应的报道较少。Wang 等[30]人研究整理了121 个物种的595 个nsLTPs,并构建了关于nsLTPs 的数据库,发现它们具有8 个半胱氨酸的保守结构域,并将nsLTPs 分成I 和II 两个类型,而且nsLTPs 的保守性在结构稳定性或脂质结合能力中起重要作用。Wang 等[31]人从绿豆中提取出非特异性脂质转移蛋白基因nsLTP,与从小麦、玉米种子中获得的该基因一样具有脂质转移的活性,可对茄病镰刀菌、尖孢镰刀菌、腐霉和菌核病菌等产生抗性。关于nsLTP 是否与TaTLP1 互作还需要后续实验验证。
综合上述,认为TaTLP1 蛋白可能与PR1 或者nsLTP 存在互作,下一步将对这些候选互作蛋白进行进一步验证,并利用酵母双杂交(Y2H),双分子荧光互补(BiFC),免疫共沉淀(CoIP)等技术进行互作的深度验证,明确互作的关键位点,探索TaTLP1所参与的信号通路以及抗病相关的互作机制。
本研究的创新点在于利用改造后的Gateway 技术准确构建TaTLP1 基因在烟草中异源表达的载体,并利用GFP-Trap 技术快速获得与TaTLP1 的互作蛋白,下一步工作需要对钓取的互作蛋白进行BiFC 和CoIP 的验证,从信号通路的角度初步解析TaTLP1参与小麦与叶锈菌互作的分子机制,为明确小麦抗叶锈病防御机制奠定理论基础。

