NLR、PLR及血清MCP-1对重度脑外伤患者并发VAP的诊断价值
张凤香,刘敏,王英青岛市中心医院,山东青岛266042
呼吸机相关性肺炎(VAP)是指原无肺部感染的重症患者,建立人工气道进行机械辅助通气治疗48 h后或拔管48 h内肺部发生感染性炎症。VAP具有较高的患病率,且严重危及患者身体健康[1]。VAP临床诊断的“金标准”为肺组织病理活检与细菌学培养,但临床检测时间较长,导致患者错过最佳治疗时间[2]。重度脑外伤患者中枢神经严重受损,急需进行呼吸机辅助治疗,但由于患者存在急性呼吸功能障碍、免疫力低下等,导致VAP发生率明显升高,另外因重度脑外伤患者体内炎症反应加剧更易引发VAP[3]。因而寻找诊断VAP的生物学指标,对提高临床治疗效果及改善患者预后具有重要意义。研究表明,中性粒细胞/淋巴细胞(NLR)与血小板/淋巴细胞(PLR)可作为反映机体炎症及免疫反应状态的指标,二者可用于诊断及监测呼吸系统、消化系统等疾病发生及进展情况[4]。单核细胞趋化蛋白1(MCP-1)通过将单核细胞募集至炎症部位进而参与急性冠状动脉综合征发生发展,可作为判断疾病进展情况的重要指标[5]。关于NLR、PLR、MCP-1与VAP的相关研究相对较少。因此本研究探讨NLR、PLR及血清MCP-1水平对重度脑外伤患者发生VAP的诊断价值。
1 资料与方法
1.1 临床资料 选取2017年2月~2018年3月本院收治的重度脑外伤患者137例,男91例、女46例,年龄(47.13±6.89)岁。纳入标准:①符合重度颅脑外伤诊断标准[6];②入院时格拉斯哥昏迷评分(GCS)3~8分;③重症监护室建立人工气道且呼吸机辅助通气时间超过48 h;④VAP患者胸部X线检查肺部出现新的浸润阴影;⑤入住重症监护室前未接受机械辅助通气治疗。排除标准:①患有严重器质性疾病;②合并其他器官严重损伤;③肺部或身体其他部位存在感染;④合并慢性疾病;⑤机械通气期间肺外器官严重感染。患者均接受机械辅助通气,48 h后根据是否发生VAP分为VAP组(62例)与非VAP组(75例),VAP诊断符合相关诊断标准[7]。又根据治疗效果将VAP组分为好转组(40例)与恶化组(22例),其中肺炎症状改善或消失且X线检查显示病情无明显进展定义为好转;肺炎症状持续存在且X线检查显示病情进展并出现感染性休克等致命性并发症定义为恶化[8]。VAP组男37例,女25例,年龄(57.87±12.03)岁;非VAP组男54例,女21例,年龄(58.64±11.36)岁。两组临床资料比较差异无统计学意义(P>0.05),具有可比性。好转组男21例,女19例,年龄(57.45±11.73)岁;恶化组男10例,女12例,年龄(58.11±11.57)岁。好转组与恶化组临床资料比较差异无统计学意义(P>0.05),具有可比性。患者或其家属均签署知情同意书,本研究经本院医学伦理委员会批准。
1.2 外周血NLR、PLR测算 分别于机械辅助通气前1 h与通气48 h采集患者空腹肘静脉血2 mL,用DxH800血细胞分析仪(中国贝克曼库尔特商贸有限公司)检测中性粒细胞、淋巴细胞、血小板计数,计算NLR、PLR。
1.3 血清MCP-1检测 分别于机械通气前1 h与机械通气48 h采集空腹肘静脉血3 mL,将枸橼酸钠(0.109 mol/L)抗凝剂加入抽取的血液中,混匀,室温静置1 h,以3 000 r/min离心10 min,吸取上层血清置于试管中。采用ELISA法检测MCP-1。试剂盒购自武汉默沙克生物科技有限公司,严格按照试剂盒说明书进行操作。
1.4 炎性指标检测 分别于机械通气前1 h与机械通气48 h采集空腹肘静脉血4 mL,其中2 mL血液样本用DxH800血细胞分析仪检测血白细胞(WBC)并计数;另外2 mL血液样本经3 000 r/min离心10 min,分离血清,用免疫比浊法检测血清C反应蛋白(CRP)。检测试剂盒购自北京利德曼生化股份有限公司。
1.5 患者肺部感染程度评价[9]分别于机械通气前1 h与机械通气后48 h采用临床肺部感染评分(CPIS),用于评估患者肺部感染程度,分值越高,肺部感染越严重。

2 结果
2.1 VAP组与非VAP组机械辅助通气前后各指标比较 通气前两组各指标比较差异无统计学意义(P均>0.05)。与通气前比较,通气后非VAP组WBC、CRP水平均升高(P均<0.05),NLR、PLR、血清MCP-1水平及CPIS均升高但差异无统计学意义(P均>0.05);机械辅助通气后VAP组NLR、PLR、血清MCP-1水平及WBC、CRP、CPIS均升高(P均<0.05),且VAP组NLR、PLR、MCP-1、WBC、CRP、CPIS评分均高于非VAP组(P<0.05)。见表1。

表1 VAP组与非VAP组机械辅助通气前后各指标比较
2.2 VAP患者NLR、PLR及血清MCP-1水平与CPIS的相关性分析 NLR、PLR及血清MCP-1水平与CPIS均呈正相关(r分别为0.625、0.511、0.488,P均<0.05)。
2.3 NLR、PLR及血清MCP-1对VAP的诊断价值 NLR诊断VAP的最佳截断值为3.89,此时敏感度为87.10%、特异度为81.33%、准确度为89.25%;PLR诊断VAP的最佳截断值为159.24,此时敏感度为79.03%、特异度为97.33%、准确度为86.76%;血清MCP-1诊断VAP的最佳截断值为151.21 μg/L,此时敏感度为77.42%、特异度为93.33%、准确度为84.38%。NLR、PLR及血清MCP-1诊断VAP的ROC曲线分析见表2。
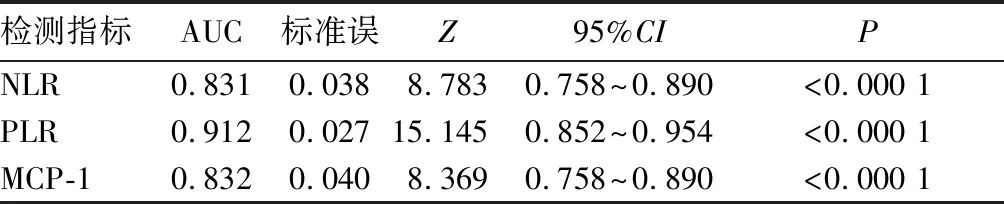
表2 NLR、PLR及血清MCP-1诊断VAP的ROC曲线分析
2.4 好转组与恶化组NLR、PLR及血清MCP-1水平比较 通气前,与好转组相比,恶化组NLR、PLR及血清MCP-1水平高(P均<0.05);通气后,与好转组相比,恶化组NLR、PLR及血清MCP-1水平高(P均<0.05)。见表3。

表3 好转组与恶化组NLR、PLR、血清MCP-1水平比较
3 讨论
重度脑外伤患者体内应激反应活化并释放大量炎性递质进而引发VAP,及时诊断VAP并有效评估病情进展可为治疗方案的制订提供参考,有效降低患者病死率[10]。研究显示VAP发生的主要原因是中性粒细胞与淋巴细胞异常活化,中性粒细胞与淋巴细胞数量增加可加重患者肺部炎症[11,12]。CRP与WBC作为传统炎性指标对VAP诊断具有一定敏感性但其缺乏特异性[13]。因此,本研究探寻诊断VAP的新型标志物,为提高临床诊断效率及治疗效果提供理论依据。
因中性粒细胞属于吞噬细胞的一种,可调节机体炎症和免疫反应,而发生炎症反应时,淋巴细胞凋亡又是普遍现象。因此NLR可有效反映机体炎症反应状态。此外,血小板可合成并释放多种炎症介质,在炎症刺激下,巨核细胞大量增加,从而导致血小板数量明显增多,因此PLR也可用于判断体内炎症反应情况。同时有研究证实NLR及PLR在急性胰腺炎、癌症等多种疾病中明显升高,并与疾病严重程度及患者预后密切相关[14]。并有研究发现联合检测可有效提高高危患者诊断准确率[15,16]。本研究结果显示机械辅助通气后非VAP组NLR、PLR升高,但与通气前比较差异不明显;而VAP组NLR、PLR明显升高,且VAP组NLR、PLR均高于非VAP组。说明机械通气治疗后NLR、PLR升高并参与VAP发生过程。MCP-1属于趋化因子C-C家族成员,发挥较强的趋化活化单核细胞及T细胞作用,可介导炎症与免疫反应,进而保持机体平衡。有研究表明,MCP-1作为调节炎症细胞渗透与迁移的关键因子之一,且单核细胞参与动脉内膜迁移聚集过程,因此其可作为临床诊断心脑血管疾病的重要指标[17,18]。研究显示,MCP-1可通过促进炎症反应影响动脉粥样硬化进程,甚至损伤神经功能[19]。关于重度脑外伤患者血清MCP-1水平变化的研究相对较少。本研究结果显示机械辅助通气后VAP组血清MCP-1、CRP、WBC均明显升高,且VAP组MCP-1水平高于非VAP组。说明MCP-1可能参与重度脑外伤患者VAP的发生。分析原因可能为VAP患者体内中性粒细胞数量升高,而中性粒细胞可调节巨噬细胞功能,MCP-1又可促使巨噬细胞或单核细胞释放炎性介质促进炎症反应的发生[20]。提示MCP-1在VAP患者炎症反应中发挥重要调控作用。
CPIS可用于评估VAP患者肺部感染严重程度,评分越高表明其肺部感染程度越严重[21]。本研究结果显示机械辅助通气后VAP组CPIS升高,而非VAP组CPIS无明显变化,说明VAP组肺部感染程度加重。进一步比较VAP患者NLR、PLR及MCP-1水平与CPIS的相关性,结果显示NLR、PLR及MCP-1水平均与CPIS呈正相关,说明患者外周血NLR、PLR及血清MCP-1水平越高其CPIS越高,提示NLR、PLR及MCP-1水平与肺部感染严重程度密切相关。同时本研究采用ROC曲线分析NLR、PLR及MCP-1水平对VAP的诊断价值,结果显示患者外周血NLR为3.89、PLR为159.24、血清MCP-1水平为151.21 μg/L作为诊断VAP界限时,诊断VAP均具有较高的敏感度及特异度。提示外周血NLR、PLR及血清MCP-1水平均可作为诊断VAP的指标。
本研究中VAP患者治疗后可根据治疗效果分为好转组与恶化组,治疗前后恶化组外周血NLR、PLR及血清MCP-1水平均明显高于好转组。因此在治疗前对外周血NLR、PLR及血清MCP-1进行检测,可预测患者预后。
综上所述,外周血NLR、PLR及血清MCP-1可作为诊断重度脑外伤并发VAP的指标,并可预测预后。但本研究存在不足之处,由于样本量较少导致部分数据可能存在局限性,需进一步扩大样本量深入研究NLR、PLR及血清MCP-1在VAP发生发展过程中的作用机制。

