二肽基肽酶-4通过促进LncRNA ENST00000565307的表达调控人血管平滑肌细胞增殖和迁移
刘朝林 徐通洁 黄寅 何虎强 施森 刘勇 何延政
西南医科大学附属医院血管外科(四川泸州646000)
目前心血管疾病是全球死亡的首要原因[1],而动脉粥样硬化(atherosclerosis,AS)是常见的心血管疾病之一。AS 是由多种危险因素促进的心血管疾病,包括巨噬细胞的积累,促炎细胞因子的产生及内皮细胞和血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的功能障碍[2-4]。目前的研究认为VSMCs 的增殖与AS 的修复有着密切联系[6]。然而,目前关于AS 中VSMCs 的增殖和迁移的具体调控机制尚不完全明确[7]。因此,研究VSMCs 的增殖和迁移机制对AS 和血管成形术后再狭窄的治疗和干预具有重大意义。
二肽基肽酶-4(dipeptidyl peptidase-4,DPP4)是一种普遍表达的细胞表面蛋白酶,又称为腺苷 脱 氨酶络合蛋白2 或T 细胞表面抗原CD26[8]。研究发现在多种组织中均表达DPP4,如免疫细胞、内皮细胞、平滑肌细胞。研究发现DPP4 在心血管功能的调节方面发挥着重要作用[10]。例如,NINA-WRONKOWITZ 等[11]研究发现可溶性DPP4(sDPP4)通过蛋白酶活化受体2 诱导人类血管平 滑肌细胞(human vascular smooth muscle cells,HVSMCs)的炎症和增殖。ISHIBASHI 等[12]研究发现sDPP4 通过6-磷酸甘露糖/胰岛素样生长因子受体2 诱导人脐静脉内皮细胞产生氧化应激反应。在笔者的前期实验研究中,也证实了DPP4 可以通过ERK/NF-κβ信号通路促进HVSMCs 的钙化[13]。
长链非编码RNA(long non-coding RNA,LncRNA)是属于非编码RNA 家族中一类长度超过200个核苷酸且无蛋白质编码能力的RNA 分子[14]。LncRNA 可从染色质重塑、转录调控及转录后加工等多种层面实现对基因表达的调控[15]。研究表明,LncRNA 存在组织特异性、细胞特异性、发育阶段特异性、时空特异性以及疾病特异性[16]。在笔者的同期研究中,发现DPP4 可以通过抑制LncRNA ENST00000540293 的表达,从而促进HVSMCs 的钙化[17]。而LncRNA ENST00000565307位于16号染色体,长度为593 个核苷酸,是基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)的天然反义基因,其在HVSMCs 增殖和迁移过程中的作用和机制尚未明确。本研究以sDPP4 干预HVSMCs,验证DPP4 可促进HVSMCs 增殖和迁移,并进一步探究相关LncRNAs 在其过程中的作用和机制。
1 材料与方法
1.1 材料HVSMC、SMCM(Sciencell 公司,美国),sDPP4(R&D 公司,德国),MMP-2 抗体(abcam 公司,英国),羊抗鼠荧光二抗(DyLight 800)(Cell Signaling Technology 公司,美国),RNA 提取试剂盒(四川成都福际生物公司,中国),RNA 逆转录试剂盒(TOYOBO 公司,日本),LncRNA 引物和mRNA引物(武汉生工公司,中国)见表1,LncRNA 沉默试剂盒(广东锐博公司,中国),PCR 试剂盒(QIAGEN 公司,荷兰),CCK-8 试剂盒(东仁化学科技(上海)有限公司,中国)。

表1 引物序列Tab.1 Primer sequences
1.2 实验方法
1.2.1 细胞培养HVSMCs置于液氮中冻存,SMCM培养基遵循说明书配置,4 ℃保存。细胞培养过程中严格遵循无菌操作原则,每2~3 d 换液一次,细胞生长融合大于95%时用0.25%胰酶(不含EDTA)消化传代,使用第3 ~8 代细胞实验。
1.2.2 基因芯片检测HVSMCs 分为空白对照组和DPP4 诱导的实验组,干预4 d 后,分别收集细胞,提取总RNA,测定RNA 的浓度及完整性,质量检测合格后,由上海康成生物公司进行基因芯片技术筛查检测上述两组间差异表达的LncRNAs,实验重复3 次,选择实验组中表达升高明显的基因LncRNAENST00000565307 作为后续研究目标。
1.2.3 基因沉默根据LncRNA沉默试剂盒说明书,将细胞分为4组。以1×105个/孔的密度将HVSMCs 接种于6 孔板,当细胞密度大于50%时开始转染。采用LncRNAENST00000565307 smart silencer 推荐沉默浓度转染细胞,本实验以100 nmmol/L 作为后续转染实验浓度。转染步骤:在CP buffer(1×)中加入lncRNAENST00000565307 smart silencer,混匀,再加入CP reagent,混匀后室温静置15 min,最后加入各组培养基中。空白对照组仅加入SMCM 培养基;转染对照组加入含转染试剂的SMCM 培养基;转染阴性组加入含lncRNAENST00000565307 沉默阴性对照试剂的SMCM 培养基;转染阳性组加入含lncRNAENST00000565307 沉默阳性对照试剂的SMCM 培养基。细胞干预培养48 h 后,采用RTPCR 检测lncRNAENST00000565307 的沉默效果。
1.2.4 荧光定量PCR根据RNA 提取试剂盒说明书,提取总RNA 并测定浓度;按照逆转录试剂盒说明书将RNA 逆转录为cDNA;LncRNA 引物和mRNA 引物均使用Primer Premier 5.0 设计,最终由武汉生工公司合成,引物序列见表1。以β-actin 作为内参,参照PCR 试剂盒说明书进行实时荧光定量PCR 反应(RT-qPCR)。反应条件设定为:预变性(95 ℃,2 min),扩增(95 ℃5 s、60 ℃10 s;45 个循环);通过溶解曲线分析扩增产物的特异性。最终结果用2-ΔΔCt方法计算基因的相对表达水平。每个样本设置3 个复孔,实验重复3 次。
1.2.5 划痕实验以1×105个/孔的密度将HVSMCs接种于6 孔板,每组设置3 个复孔,当细胞密度大于60%时,用无血清培养基饥饿处理细胞24 h,200 μL 枪头于6 孔板每孔中心细胞表面作一垂直水平线的划痕,洗去划痕上的细胞,分别加入预先配置好的培养基,分别于0、48 h 观察细胞生长情况,测量划痕宽度,数据进行统计学分析。
1.2.6 Transwell 实验取对数生长期的HVSMCs,以1 × 105个/孔的密度将HVSMCs 接种于Transwell 12 孔板上层小室,上层小室分别加入条件培养基,下层小室加入SMCM 培养基,每组设置3 个复孔。将Transwell 12 孔板置于37 ℃、5%CO2培养箱中培养,于48 h 后收集小室,多聚甲醛固定小室底部碳酸脂微孔膜上的细胞,用棉签轻轻擦去上室未穿过孔的细胞,下室细胞用龙胆紫染色,显微镜下人工计数视野中迁移细胞数量,数据进行组间比较。
1.2.7 Western Blot实验收集干预后的HVSMCs,提取总蛋白,采用BCA 法测定蛋白浓度。SDSPAGE 分离后 转 至PVDF 膜,用5% BSA 封闭液封闭,加入MMP-2(1∶1 000)一抗4 ℃孵育过夜,复温后用TBST 洗膜3次,加入羊抗鼠荧光二抗(1∶50 000)室温下孵育1 h,再用TBST 洗膜3 次,使用免疫荧光成像系统曝光,图像分析软件扫描条带,用Image-Pro Plus 6.0 软件计算灰度值,计算MMP-2 的相对表达,实验重复3 次。
1.3 统计学方法应用Graphpad Prism 7.0 进行统计学分析,正态分布的计量资料采用均数±标准差表示,采用独立样本t检验和方差分析,P<0.05 为差异有统计学意义。
2 结果
2.1 DPP4 可以促进HVSMCs 的增殖迁移与对照组相比,DPP4(200 ng/mL)干预HVSMCs 48 h后,其增殖能力明显提高(P<0.0001,图1A)。划痕实验结果进一步表明DPP4 促进了HASMCs 的“创伤”愈合(图1B、1C)。
2.2 基因芯片分析将HVSMCs分为空白对照组和DPP4诱导组,以200 ng/mL的DPP4浓度干预4 d,提取总RNA,进行基因芯片筛查,部分差异表达的LncRNAs(图2A),选取上调明显的LncRNA ENST-00000565307,同时在http://genome.ucsc.edu 中查找到LncRNAENST00000565307 是基质金属蛋白酶2(MMP-2)的天然反义基因。采用RT-qPCR技术验证LncRNAENST00000565307 在空白对照组和DPP4诱导组的差异表达情况,结果显示:与对照组相比,DPP4 诱导组中LncRNAENST00000565307 的表达显著上升(P<0.05,图2B);且MMP-2 蛋白的表达显著上升(P<0.001,图2C、2D)。
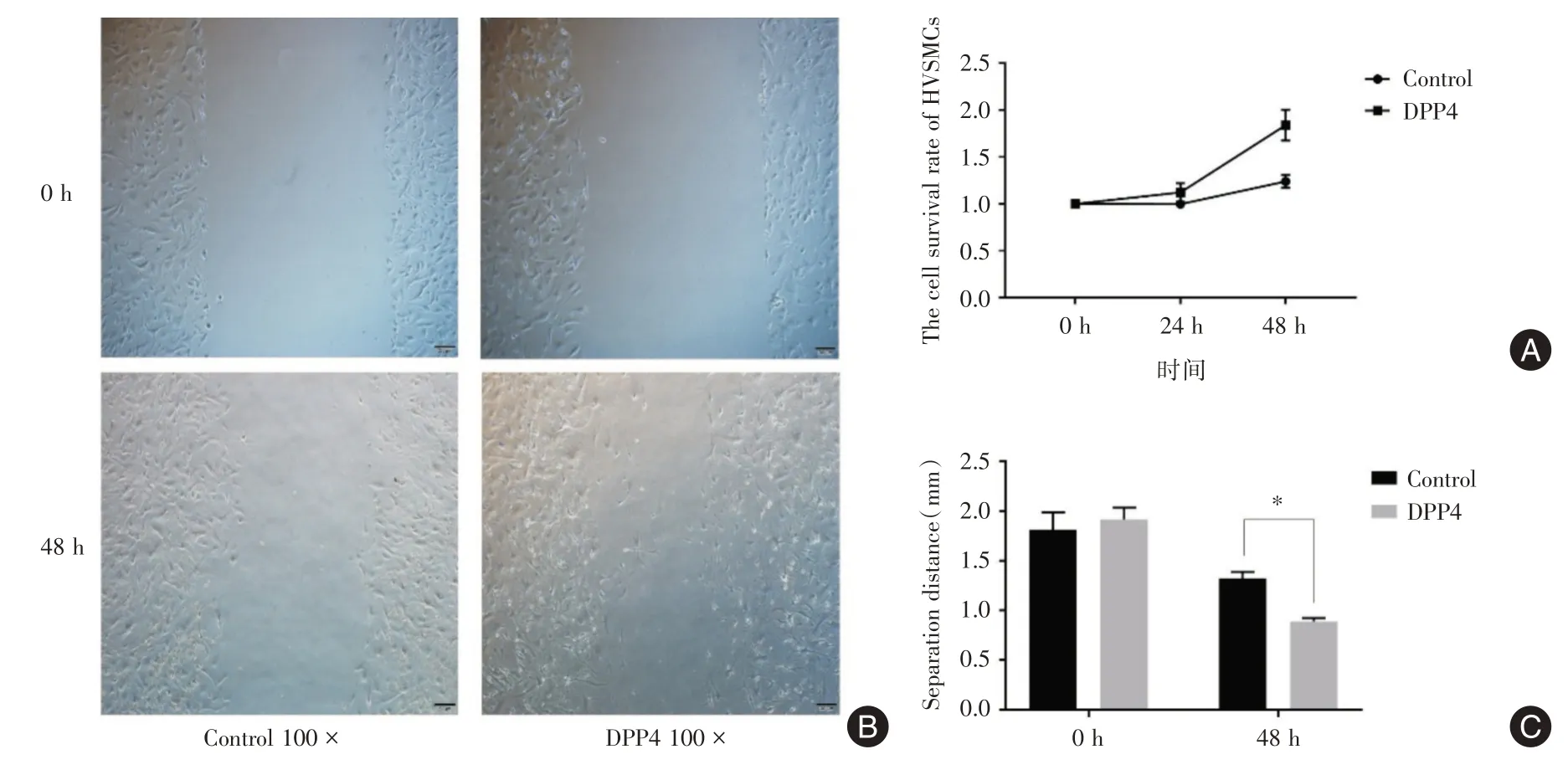
图1 DPP4 对人血管平滑肌细胞增殖迁移的影响Fig.1 Effect of DPP4 on proliferation and migration of human vascular smooth muscle cells

图2 DPP4 对HVSMCs 的LncRNAs 表达的影响Fig.2 Effect of DPP4 on LncRNAs expression in HVSMCs
2.3 沉默LncRNA ENST00000565307 后MMP-2蛋白的表达下调以100 nmol/L 的LncRNA ENST-00000565307 smart silencer 浓度转染HVSMCs 后,与转染阴性试剂对照组相比,转染阳性试剂组LncRNA ENST00000565307 的表达显著下调(P<0.001,图3A),同时MMP-2 蛋白在转录水平也明显下调(P<0.01,图3A),免疫蛋白印迹实验表明MMP-2蛋白的表达同样明显降低(P<0.001,图3B)。
2.4 沉默LncRNA ENST00000565307后HVSMCs的增殖迁移能力下降细胞转染48 h 后,与对照组相比,沉默组HVSMCs 的增殖能力显著下降(P<0.05,图4B);在划痕实验中,与转染阴性对照组相比,转染阳性组HVSMCs 的创伤愈合能力显著下降(P<0.05,图4C、4D);在Transwell实验中,与转染阴性对照组相比,沉默组HVSMCs 的迁移能力显著下降(图4A)。而与对照组相比,转染阴性对照组的创伤愈合能力和迁移能力并没有明显的差异。
3 讨论
动脉粥样硬化是一种慢性炎症性疾病,好发于大中动脉,是常见的心血管疾病之一,也是全球发病率和死亡率最常见的疾病之一[18]。血管重塑与AS 的进展密切相关,VSMC 的增殖和迁移是血管重塑中的主要细胞事件[19]。VSMC 的增殖和迁移在内膜增生中起重要作用[20]。因此,探究VSMC增殖和迁移的相关机制对于治疗或干预AS 和血管成形术后再狭窄具有重大意义。

图3 LncRNA ENST00000565307 沉默后对蛋白MMP-2 的影响Fig.3 Effect of LncRNA ENST00000565307 on protein MMP-2 after silencing

图4 沉默LncRNA ENST00000565307 后对HVSMCs 增殖迁移的影响Fig.4 Effect of silencing LncRNA ENST00000565307 on proliferation and migration of HVSMCs
研究表明,DPP4 抑制剂可以上调胰高血糖素样肽-1(GLP-1)等表达,从而起到保护心血管的作用,其作用机制和增加GLP-1 的生物利用度相关[21],研究还发现DPP4可以通过蛋白酶活化受体2促进HVSMCs的增殖[11]。本研究验证了DPP4 可以促进HVSMCs 的增殖迁移,使用DPP4 干预HVSMCs 48 h 后,相比 对 照组,DPP4 干 预组HVSMCs 增 殖明显增强,迁移能力增强,且MMP-2 的表达明显上调。但是DPP4 促进HVSMCs 增殖的相关分子机制尚未完全明确。
LncRNA 在许多生物过程中均发挥着调控的作用[22]。LncRNA LINC00341 通过miR-214/FOXO4反馈环促进VSMCs增殖和迁移[23]。LncRNA XR007793 通过抑制miR-23b 调节VSMCs 的增殖和迁移[24]。本研究通过基因芯片技术检测发现在HVSMCs 的增殖迁移过程中,多种LncRNA 存在异常表达,且在DPP4 干预的HVSMCs 中过表达或低表达,这表明可能有多种LncRNA 参与了DPP4 诱导HVSMCs 增殖和迁移的调控过程。
为进一步探究LncRNA对HVSMCs的增殖迁移的调控作用。选取其中上调明显的LncRNA ENST-00000565307 作为实验的研究对象,同时在http://genome.ucsc.edu 中查找到LncRNA ENST00000565-307 位于16 号染色体,是(MMP-2)的天然反义基因。通过RT-qPCR 技术验证,DPP4 干预HVSMCs 48 h 后,LncRNA ENST00000565307 的表达显著上调。通过沉默LncRNA ENST00000565307 后,且CCK-8 实验,发现HVSMCs 的增殖受到抑制。RTqPCR 结果显示,MMP-2 的转录水平显著下调。在划痕实验和Transwell 实验中,沉默LncRNA ENST-00000565307 后,HVSMCs 的增殖迁移能力受到抑制。研究结果表明,DPP4可能是通过促进LncRNA ENST00000565307的表达进而调控HVSMCs 的增殖及迁移过程。
本实验仅在体外细胞实验中验证了DPP4 通过诱导LncRNA ENST00000565307 的过表达从而促进HVSMCs 的增殖和迁移,还缺乏体内实验验证。总体而言,LncRNA ENST00000565307 能否作为血管动脉粥样硬化疾病防治的新靶点,还需要更进一步的深入研究。

