大葱水提物对辣椒疫病的控制作用及其活性成分分析
陈煜文 何超 陈夕军 贺 振 魏利辉 刘邮洲 黄奔立


摘要 為明确大葱水提物对辣椒疫病的控制效果及其主要活性成分,通过室内毒力、田间防效以及GC-MS联用测定发现,大葱茎叶与根水提物均对辣椒疫病菌有一定抑制作用,且浓度越高抑制作用越强。在含300 mg/mL根水提物的平板上培养2 d,辣椒疫病菌菌丝生长的抑制率高达81.50%;但随着时间的推移,抑制作用减弱,5 d 后,200 mg/mL根和茎叶水提物对病菌的抑制率仅为34.18%和25.62%。用300 mg/mL大葱水提物灌根,对辣椒疫病的防效可达50%左右。将大葱与辣椒轮作或混栽可有效降低田间辣椒疫病的病情,防病效果分别为 40.67%和 41.21%。GC-MS 测定结果表明,大葱根和茎叶水提物中分别含有 14种和28 种挥发性物质,且均以有机硫化物为主,分别占总挥发性物质的 82.17%和99.40%,这些硫化物对辣椒疫病菌的生长均有较强的抑制作用。这些结果表明,大葱产生的挥发性物质在辣椒疫病的绿色防控上有很好的应用前景。
关键词 控制作用; 活性成分; 水提物; 辣椒疫病; 大葱
中图分类号: S 482.1
文献标识码: A
DOI: 10.16688/j.zwbh.2019149
Control effect of the aqueous extract from Allium fistulosum on
pepper phytophthora blight and its active components
CHEN Yuwen1, HE Chao1, CHEN Xijun1, HE Zhen1, WEI Lihui2, LIU Youzhou2, HUANG Benli1
(1. College of Horticulture and Plant Protection, Yangzhou University, Yangzhou 225009, China;
2. Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract
To determine the effect of the aqueous extracts welsh onion from Allium fistulosum on the growth of Phytophthora capsici and pepper phytophthora blight, the extracts from different parts of the welsh onion plant were added into the medium or poured into the rhizosphere soil of pepper. The results showed that the aqueous extracts from different parts of welsh onion had significantly inhibitory effects on the growth of P.capsici. After 2 days, the fungus cultured in the medium containing 300 mg/mL aqueous extracts from welsh onion root was significantly inhibited and the inhibition rate reached 81.50%. As time went on, the effects of the extracts from welsh onion root and stem on the pathogen growth gradually decreased and the inhibition rates were only 34.18% and 25.62%, respectively, at the 5th day. The solution containing 300 mg/mL aqueous extracts from welsh onion was poured into the rhizosphere of pepper, which reduced the severity of pepper phytophthora blight by about 50%. Rotation or mixed planting with welsh onion could effectively reduce the disease of pepper blight, and the control effects were up to 40.67% and 41.21%, respectively. The results of GC-MS showed that there were 14 or 28 kinds of volatile substances in the aqueous extract of onion root and stem/leaf, mainly organic sulfide, accounting for 82.17% or 99.40%, respectively. Some organic sulfides had strong inhibitory effect on the growth of P.capsici. These results indicated that volatile substances from welsh onion had a good application prospect for the green prevention and control of pepper blight.
Key words
control effect; activity component; aqueous extract; pepper phytophthora blight; welsh onion
辣椒是人们喜爱的一种蔬菜,在世界各地均有种植,在过去30年间,辣椒的种植面积增加了40多倍[1]。我国是世界辣椒生产和消费的第一大国,且近年来种植面积仍在逐年增加[2]。辣椒适应性强、品种多、经济效益高,已成为许多地区农民增收、农村发展的重要支柱产品[3]。但辣椒在生产过程中可遭受多种病害的侵袭,特别是辣椒疫病,已成为全世界辣椒生产过程中最具破坏性的病害[ 45]。
辣椒疫病是由Phytophthora capsici Leon.引起的一种毁灭性病害,可经雨水、土壤、气流等多种途径传播,除引起大面积死秧外,还可造成叶片枯萎、果实腐烂、茎秆出现坏死斑,以及整株萎蔫死亡,这些症状受寄主抗性、生育期、病菌侵染点和环境条件的影响[1, 67]。由于该病传播途径多,生产上经常呈暴发性危害,因此单一的防治方法往往达不到理想的防控效果。而化学农药的过量使用,使得水体和土壤等受到污染,辣椒产品存在食用安全性问题。因此,采用肥水管理、轮作、日光能处理等物理与栽培措施,结合筛选安全、有效的生物源农药,从而达到辣椒疫病的有效控制显得非常重要。
生物源物质主要来源于动物、植物和微生物及其次生代谢产物,这些物质对环境相对友好,已有多种被开发成农药、肥料、生长调节剂和生物诱抗剂等[89]。大葱Allium fistulosum作为一种重要的蔬菜和调味品,具有治疗感冒、预防癌症、降低血压和抵抗病毒的作用,其粗提物中的某些组分已被证明有药用和杀菌功能,如葱辣素和大葱油等[1011]。大葱总提取物对黄瓜和番茄疫病菌的菌丝生长有明显抑制作用,且在一定浓度下对棉花枯萎病菌、棉花黄萎病菌和黄瓜枯萎病菌的孢子萌发抑制率达100%[1213]。有研究表明,大葱抑菌成分中包含大量含有二硫键的化合物,这些化合物以真菌含有的-SH位点作为作用靶点,竞争性地抑制病原菌几丁质酶和蛋白酶活性,抑制病菌菌丝代谢相关蛋白质的合成[14]。但到目前为止,大葱提取物中到底是哪些物质在起作用,这些物质在田间控病,特别是对辣椒疫病的控制效果如何还不得而知。本文通过室内毒力测定与田间混栽轮作试验,结合大葱水提物抗菌成分分析,以期找到适合于辣椒疫病防控的大葱次生代谢产物,从而为新型农药的研制以及防治辣椒疫病提供理论依据。
1 材料和方法
1.1 供试材料
1.1.1 供试植物
辣椒品种:‘茄门甜椒,易感辣椒疫病。用 55℃温水浸泡辣椒种子 3~4 h,清水淋洗后将种子放入垫有潮湿纱布的培养皿中,26℃恒温培养箱中催芽。待种子露白后穴播于装有伯爵泥炭BM-2育苗基质的塑料穴盘中,每穴 3~4 粒种子,22~24℃温室中培养至6片真叶,备用。
大葱品种:‘胡葱,购自扬州市区农贸市场。气温为13~20℃时将种子播于试验田中,待大葱茎叶长至15~17 cm,选取长势相近的植株备用。
1.1.2 供试菌株
辣椒疫病菌Phytophthora capsici YM-103,分离自江苏的辣椒疫病病株,经形态与分子生物学鉴定,并通过柯赫氏法则验证。
1.2 大蔥水提物的制备
将新鲜的大葱洗净晾干至表面无水珠后,分别称取50 g茎叶和根,用10%次氯酸钠表面消毒30 min,无菌水冲洗3~5次后,剪碎并加入少量石英砂研磨。匀浆后双层滤纸抽滤,滤液用无菌水定容至20 mL,配成2 500 mg/mL(大葱鲜重/体积)母液,经细菌滤器过滤后备用。
1.3 大葱水提物对辣椒疫病菌生长的抑制作用测定
向温热的马铃薯葡萄糖琼脂培养基中加入大葱水提物母液,配制成含水提物浓度为200、250 mg/mL和300 mg/mL的培养基,倒平板。用打孔器从活化的辣椒疫病菌菌落边缘取直径5 mm 的菌丝块,置于含不同浓度大葱水提物的平板中央,28℃恒温培养箱中黑暗培养,2 d后开始测量菌落直径,每天1次,共测量4次,计算抑制率。每处理重复4次,以清水作对照。
抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%;
菌落直径=测量值-接种菌丝块直径。
1.4 大葱水提物对辣椒疫病的防效测定
1.4.1 孢子悬浮液的制备
参照Chen等[15]的方法制备辣椒疫病菌孢子液:将辣椒疫病菌经活化后接种于胡萝卜琼脂培养基,25℃恒温培养箱中黑暗培养4 d,再置于光照培养箱中同温度培养2 d。向培养皿中加入10 mL无菌水,于室温下10 min,4℃下10 min,室温下20 min,即有大量游动孢子释放。将孢子洗脱,经两层纱布过滤后加无菌水稀释,配制成106个/mL的孢子悬浮液用于接种。
1.4.2 防效测定
将长势一致的 6 叶期辣椒苗移栽至装有灭菌土的塑料盆中,7 d 后接种辣椒疫病菌,每株浇灌孢子悬浮液 10 mL。1 h 后,将配制好的200、250、300 mg/mL 的大葱根和茎叶水提液倒入辣椒苗近基部土壤中,每盆 15 mL,每处理 10 盆,重复 3 次,以倒入清水作对照。保湿 24 h,7 d 后调查发病情况,计算病情指数与防治效果。辣椒疫病严重度分级标准[16]:0 级,无病症;1 级,幼苗根部轻微变黑,叶片不萎蔫或可恢复性萎蔫; 2 级,幼苗根茎部变黑达 1~2 cm,叶片不可恢复性萎蔫,下部叶片偶有脱落;3 级,幼苗根茎部变黑超过 2 cm,叶片明显萎蔫或落叶明显;4 级,幼苗根部变黑缢缩,除生长点外全部落叶或植株萎蔫;5 级,整株枯死。
病情指数=∑(病级×该病级病株数)/5×调查总株数×100;
防效=(对照病情指数-处理病情指数)/对照病情指数×100%。
1.5 与大葱轮作或混栽对辣椒疫病的控制效果测定
于3月上旬移栽‘茄门甜椒苗,移栽后15 d用106个/mL孢子悬浮液灌根接种,保持田间湿度,等田间植株普遍发病后(病株率大于80%)进入正常管理,作为病田土备用。同年9 月中旬,在清除田间病残体后,分别种植大葱和‘茄门甜椒。次年 3 月上旬,分别取大葱田和辣椒田表层土(<20 cm)装盆(盆口直径14 cm,高10 cm,装土1 000 g)备用。将长势一致的‘茄门甜椒苗(6叶期)移至装有病土的盆中,每盆1株,每种病土栽种10盆,3次重复。保湿24 h,7 d后调查发病情况,计算病情指数与防治效果。
将辣椒疫病病茎剪成0.5 cm小段,每盆加入10 g与灭菌土混匀,模拟田间病残体,将长势一致的大葱与‘茄门甜椒苗(6叶期)混栽于盆中,两植株相距 5 cm,以单独移栽甜椒苗为对照。每处理10盆,重复3次,保湿24 h,25℃温室中培养30 d后调查发病情况,计算病情指数与防治效果。
1.6 大葱水提物中挥发性物质的成分测定
称取大葱根、茎叶各20 g,分别加入200 mL去离子水于组织粉碎机中粉碎,将粉碎的样品倒入 250 mL锥形瓶中,加入转子,用封口膜密封,放在40℃恒温磁力搅拌器上快速搅拌。将固相微萃取装置(美国Supelco公司)的萃取头(PDMS,100 μm)针头插入封口膜,并小心将萃取头推出,同时用铁架台固定固相微萃取手柄。自萃取头推出后开始计时,对挥发物提取2 h。在萃取头捕集样品前,先将其在气相色谱进样口内(250℃)热解吸20 min,以保证萃取头中无杂质和其他污染物。
气质联用检测:使用美国惠普公司HP6890GC-HP5973MS毛细管柱(HP-5MS,30 m×0.25 mm×0.25 μm)。色谱条件为: GC进样口温度 280℃,炉温程序升温至50℃并保持3 min,然后以8℃/min的速度升温至300℃,保持3 min;EI离子源,离子源温度280℃,载气为氦气(流速1 mL/min),电子轰击能量70 eV,质量扫描范围 50~550 amu,不分流。 对大葱水提物总离子流图中的峰面各进行归一化法测量,明确各组分的百分含量,各组分图谱在 NIST谱库中自动检索后选用高相关结果。
1.7 数据统计分析
所有数据的统计分析均使用DPS V 6.55软件中Duncan氏新复极差法进行。
2 结果分析
2.1 大葱水提物对辣椒疫病菌生长的抑制作用
不同浓度的大葱根和茎叶水提物对辣椒疫病菌均有抑制作用,且浓度越高,抑制作用越强。辣椒疫病菌在含300 mg/mL大葱茎叶或根水提物的培养基上生长2 d,病菌生长抑制率分别为78.20%和81.50%;但是随着时间的延长,各浓度处理对病菌的抑制作用均有所下降,5 d后300 mg/mL大葱茎叶或根水提物对病菌生长的抑制率降至66.14%和67.91%(表1)。这一结果表明,大葱水提物中起抑菌作用的可能是一些挥发性物质,随着时间的推移因物质挥发导致抑制作用下降。
2.2 大葱水提物、大葱与辣椒轮作或混栽对辣椒疫病的控制效果
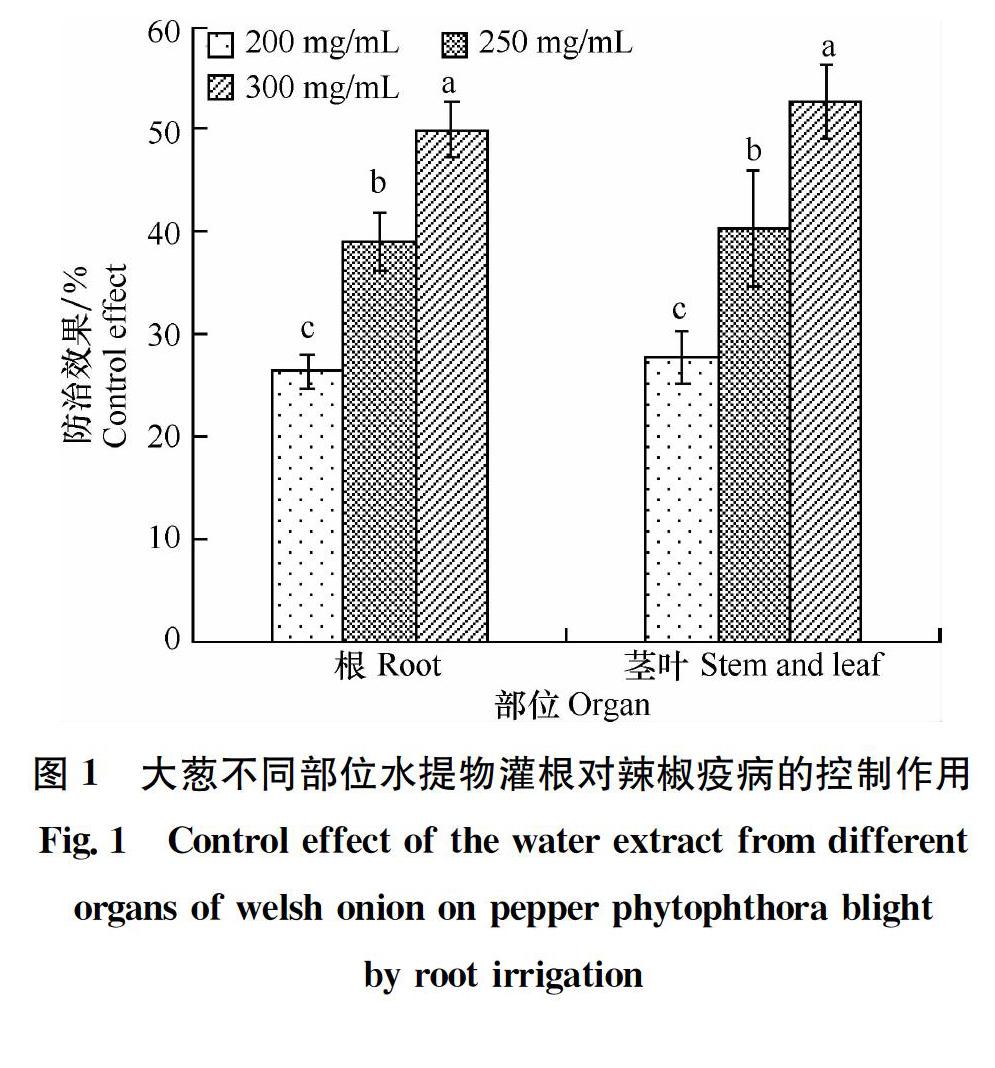
不同浓度大葱茎叶和根水提物都对辣椒疫病有一定的控制作用,且浓度越高,控病效果越好。以300 g/mL 茎叶和根水提物灌根,对辣椒疫病的防效分别为可达52.67%和49.88%;相同浓度的茎叶水提物和根水提物对辣椒疫病的防治效果差异不显著 (图1)。将大葱与辣椒轮作或混栽对辣椒疫病亦有一定的控制效果,防效可分别达 40.67% 和 41.21%,说明采用与大葱轮作或混栽的方式是田间防控辣椒疫病的一种有效手段(表2)。
2.3 大葱水提物主要化学成分分析結果
对大葱根和茎叶水提物样品挥发性物质进行 GC-MS 分析,得各水提物总离子流图。结果表明,大葱根和茎叶水提物中挥发性物质均以硫化物为主,分别占总挥发性物质的 99.40%、82.17%,但其组成成分和含量有明显差别。根水提物中挥发性物质有 14 种,主要成分为二丙基二硫醚(61.33%)、1,2二硫杂环戊烷(21.16%)、2,4-二甲基噻吩(12.36%)和二丙基三硫醚(3.8%);茎叶水提物中挥发性物质有 28 种,主要成分为2,4-二甲基噻吩(52.92%)、二丙基二硫醚(17.16%)、2-乙基反式2-丁烯醛(9.09%)、2-硫代羧基-氧-甲基肼酯(4.2%)、甲基异丙基二硫醚(3.74%)、2,6-二叔丁基对苯二酚(2.86%)和甲基丙烯基二硫醚(2.49%)(表3、图2)。由表3 可知,大葱根和茎叶水提物中的硫化物主要以二硫化物和一硫化物为主,一硫化物以2,4-二甲基噻吩为主,二硫化物以二丙基二硫醚和1,2-二硫杂环戊烷为主。
2.4 外源添加大葱提取物纯品对辣椒疫病菌生长的影响
分别向培养基中加入大葱挥发物主成分二丙基二硫醚和2,4-二甲基噻吩,在10~100 mg/L浓度下,这两种物质对辣椒疫病菌的生长均有明显的抑制作用,且浓度越高抑制作用越强。且2,4-二甲基噻吩对辣椒疫病菌的抑制作用明显好于二丙基二硫醚,在100 mg/L浓度下其抑制率可高达87.89%(图3)。
3 讨论
大葱不仅是人们喜爱的调味料之一,也是一味中药材,其含有多种微量元素、蛋白质、氨基酸和挥发油等,这些物质不仅可以解毒、舒张血管,还具有减肥、抗氧化和杀菌消炎的作用[1721]。
从20世纪70年代开始,就有人从事大葱挥发物成分研究,但不同提取方法、不同大葱种类与不同分析方法获得的成分及其含量不同[2224]。Kuo等[25]利用GC和GC-MS方法从大葱有机溶剂萃取物中鉴定出67种挥发性物质,其中多种是此前未有报道的。目前,分离和鉴定大葱挥发性物质的方法主要有减压蒸汽蒸馏、液液连续萃取、气相色谱和气相色谱质谱等方法,获得的主要成分亦大多为二丙基二硫化合物、3-苯基-1,4-十二碳二烯、十六烷、5-羟甲基糠醛、己醛和2-丙烯基丙基二硫化合物等[14, 21]。黄雪松[26] 和郭海忱等[27]分别采用GC-MSD和GC-MS测定了大葱中挥发油成分,发现这些成分多不相同,即使有些成分相同(如硫醚类和噻吩)其差异也较大。后者在大葱挥发油中得到的最大含量组分2-甲基-2-戊烯醛在前者的测定结果中并未出现。比较发现,这些提取方法多首先通过蒸馏,然后再进行萃取并进行气相色谱质谱联用,在这一过程中可能有大量的挥发性成分被损失。本研究将大葱组织捣碎后直接连接固相微萃取装置,并连接气相色谱仪测定其挥发物质,效率高,损耗小,应更能准确测定大葱水提物中挥发物的种类及各物质含量。
大葱是传统的药用植物,对于治疗人类疾病如感冒、腹痛、头痛和心脏病等均有良好效果。近年来,葱蒜类植物也被用于与其他蔬菜轮作、间作来控制蔬菜病虫害。生物测定结果表明,大葱提取物对多种动植物病原菌,如葡萄球菌、肠炎沙门氏菌、黑曲霉、青霉、尖孢镰刀菌和大丽轮枝菌等的生长有较好的抑制作用[28]。盆栽试验表明,大葱提取物对黄瓜枯萎病、辣椒疫病和辣椒根腐病有很好的预防和控制效果[14]。本文通过灌根施用大葱提取物,以及将大葱与辣椒进行轮作和混栽,发现几种方法均可减轻田间辣椒疫病的发生,防效均在40%以上。这些结果说明,对于植物病害的生物防控来说,大葱及其提取物具有较好的潜力与应用前景。
尽管目前对于大葱提取物和挥发性物质的鉴定研究有很多,但有关其中到底是哪些物质在起杀菌控病作用,目前还未有相关报道。杨粟艳等[13]分别研究了大葱总提取物、蛋白成分、多糖成分和挥发成分的抑菌作用,结果发现仅总提取物和挥发性成分对黄瓜枯萎病菌的孢子萌发与菌丝生长有抑制作用,而大葱蛋白及多糖成分对供试菌均无抑制效果,说明大葱的抑菌物质可能主要在其挥发物中。作者前期研究发现,在葱蒜中普遍存在的硫醚、二硫醚和三硫醚等硫化物对辣椒疫病菌有很好的抑制作用[29]。将大葱根与茎叶挥发物中的主成分二丙基二硫醚和2,4-二甲基噻吩分别加入培养基中,同样可有效抑制辣椒疫病菌的生长。目前,在生产上硫醚类和噻吩类杀菌剂已得到广泛应用,噻吩类杀菌剂主要有噻吩酰胺类、Stroburins类、联芳香环类、磺酰胺类、噻吩脲类及其他类7类,防治对象包括稻瘟病、霜霉病、疫病、炭疽病和白粉病等,日本日产报道的化合物49除具有很强的杀菌作用外,在1 000 mg/L浓度下对黑尾叶蝉的杀灭效果达100%[30]。本研究在大葱茎叶中发现的2,4-二甲基噻吩在100 mg/L浓度下对辣椒疫病菌的抑制效果达87.89%,具有很好的开发成高效杀菌剂的潜力。
参考文献
[1] REHRIG W Z, ASHRAFI H, HILL T. CaDMR1 cosegregates with QTL Pc5.1 for resistance to Phytophthora capsici in pepper (Capsicum annuum) [J]. The Plant Genome, 2014, 7: 112.
[2] 王立浩, 刘伟, 张宝玺. 我国辣椒种业科技发展现状、挑战及其思考[J]. 辣椒杂志, 2016, 14(3): 16.
[3] 黄任中, 黄启中, 吕中华, 等. 我国干制辣椒产业现状及发展对策[J]. 中国蔬菜, 2015(2): 911.
[4] BARCHENGER D W, LAMOUR K H, BOSLAND P W. Challenges and strategies for breeding resistance in Capsicum annuum to the multifarious pathogen, Phytophthora capsici [J/OL]. Frontiers in Plant Science, 2018, 9: 628.DOI:10.3389/fpls.2018.00628.
[5] KOC E, ISLEK C, ARICI Y K. Spermine and its interaction with proline induce resistance to the root rot pathogen Phytophthora capsici in pepper (Capsicum annuum) [J]. Horticulture Environment and Biotechnology, 2017, 58(3): 254267.
[6] LAMOUR K H, STAM R, JUPE J, et al. The oomycete broad-host-range pathogen Phytophthora capsici [J]. Molecular Plant Pathology, 2012, 13(4): 329337.
[7] MANSFELD B N, COLLE M, KANG Yunyan, et al. Transcriptomic and metabolomic analyses of cucumber fruit peels reveal a developmental increase in terpenoid glycosides associated with age-related resistance to Phytophthora capsici [J]. Horticulture Research, 2017, 4:17022.
[8] HUBERT J, UNZBERGOV Z, SANTINO A. Plant volatile aldehydes as natural insecticides against stored-product beetles [J]. Pest Management Science, 2008, 64(3): 5764.
[9] SINGH J S, STRONG P J. Biologically derived fertilizer: A multifaceted bio-tool in methane mitigation [J]. Ecotoxicology & Environmental Safety, 2015, 124: 267276.
[10]黃依璇, 陈慧敏, 姚亮, 等. 大葱提取物葱辣素的体外抗菌和抗病毒作用研究[J]. 现代食品科技, 2018, 34(2): 6974.
[11]周晓娜, 常丽丽, 王莉. 大葱提取物对人胃癌细胞裸鼠皮下移植瘤生长的抑制作用研究[J]. 现在中西医结合杂志, 2012, 21(27): 29862987.
[12]文冰, 吕巡贤, 程路明, 等. 新疆两种野生葱浸提液对几种植物病原真菌的抑制作用[J]. 中国生物防治学报, 2001, 17(4): 170174.
[13]杨粟艳, 刘长远, 浦铜良, 等. 大葱提取物对黄瓜枯萎病菌抑菌活性研究[J]. 沈阳农业大学学报, 2009, 40(2): 218220.
[14]杨粟艳. 大葱提取物抑菌活性及作用机制研究[D]. 兰州:兰州大学, 2009.
[15]CHEN X R, KLEMSDAL S S, BRURBERG M B. Identification and analysis of Phytophthora cactorum genes up-regulated during cyst germination and strawberry infection [J]. Current Genetics, 2011, 57(5): 297315.
[16]苏莉. 大蒜鳞茎粗提物对辣椒疫霉病抑制效应及其机理[D]. 杨凌:西北农林科技大学, 2008.
[17]SUNG Y Y, KIM D S, KIM S H, et al. Aqueous and ethanolic extrats of welsh onion, Allium fistulosum, attenuate high-fat diet-induced obesity [J]. BMC Complementary and Alternative Medicine, 2018, 18: 105.
[18]CHEN J H, TSAI S J, CHEN H I. Welsh onion (Allium fistulosum L.) extracts alter vascular responses in rat aortae [J]. Journal of Cardiovascular Pharmacology, 1999, 33(4): 515520.
[19]WANG Borsen, HUANG Gunanjhong, LU Yahui, et al. Anti-inflammatory effects of an aqueous extract of Welsh onion green leaves in mice [J]. Food Chemistry, 2013, 138(23): 751756.
[20]WANS B S, LIN S S, HSIAO W C, et al. Protective effects of an aqueous extract of Welsh onion green leaves on oxidative damage of reactive oxygen and nitrogen species [J]. Food Chemistry, 2006, 98(1): 149157.
[21]JANG H W, KA M H, LEE K G. Antioxidant activity and characterization of volatile extracts of Capsicum annuum L. and Allium spp. [J]. Flavour and Fragrance Journal, 2008, 23(3): 178184.
[22]BOELENS H, DE VOLOIS P J, WOBBEN H J, et al. Volatile components from onion [J]. Journal of Agricultural and Food Chemistry, 1971, 19: 984991.
[23]BLOCK E, BENTLEY M D, DAVIS F A, et al. Electron impact induced process of thermally and photochemically labile organic sulfur compounds. A mass spectral study of dialkyl disulfides, trisulfides, and α-disulfones [J]. The Journal of Organic Chemistry, 1975, 40: 27702773.
[24]ALBRAND M, DUBOIS P, GELIN R, et al. Identification of a new volatile compound in onion (Allium cepa) and leak (Allium porum): 3,4-dimethyl-2,5-dihydrothiophene [J]. Journal of Agricultural and Food Chemistry, 1980, 28: 10371038.
[25]KUO M C, HO C T. Volatile constituents of the solvent extracts of Welsh onions (Allium fistulosum L. Variety Maichuon) and scallions (A.fistulosum L.Variety Caespitosum) [J]. Journal of Agricultural and Food Chemistry, 1992, 40: 19061910.
[26]黃雪松. 大葱挥发油含量与化学成分的分析[J]. 食品与发酵工业, 2004, 30(10): 114117.
[27]郭海忱, 崔兰, 朱前翔, 等. 用GC/MS测定大葱挥发油中的化学成分[J]. 质谱学报, 1996,17(2): 6366.
[28]BENKEBLIA N. Antimicrobial activity of essential oil extracts of various onions (Allium cepa) and garlic (Allium sativum) [J]. LWT-Food Science and Technology, 2004, 37(2): 263268.
[29]季文平, 陈夕军, 何超, 等. 大蒜粗提物挥发性成分分析及其对辣椒疫病的控制作用[J]. 中国蔬菜, 2019(1): 5764.
[30]吴峤, 伍强, 张茜, 等. 噻吩类杀菌剂的研究进展[J]. 农药, 2010, 49(1): 510.
(责任编辑:田 喆)
收稿日期: 20190325 修订日期: 20190604
基金项目:现代农业产业技术体系(CARS-24-C-01);江苏省重点研发计划(现代农业)项目(BE 2018359);江苏省农业科技自主创新资金[CX(18)2005]
致 谢: 参加本试验部分工作的还有江代礼、谭翰杰、张能和纪烨斌等同学,特此一并致谢。
通信作者 E-mail:陈夕军xjchen@yzu.edu.cn;黄奔立yzhbl2003@163.com
#为并列第一作者

