参麦注射液联合化疗对肺癌合并肝硬化患者ALB、PAB及LMR的影响
蔡亚军,姚仲彩,皮文妍
浙江省诸暨市人民医院 1药剂科,2感染科(浙江绍兴 311800); 3湖州市卫生健康委员会(浙江湖州 313000)
肺癌是我国恶性肿瘤中发病率及病死率最高的肿瘤[1],肺癌80%~85%为非小细胞肺癌(non-small cell lung cancer,NSCLC)[2]。有研究认为肺癌的发生和吸烟、室内微小环境、职业环境接触、空气污染以及电离辐射相关[3-4]。在肺癌基础上合并肝硬化,则会增加患者的病死率。近年有研究[5]表明含铂化疗方案联合参麦注射液治疗NSCLC时,能够提高患者的生活质量及免疫功能,有助于增加化疗的近期疗效,并减轻铂类药物的不良反应。另有文献[6]报道在化疗前1周给予参麦注射液可以预防化疗所致的肝功能损伤,并可降低化疗的不良反应。因此,本研究以2017年4月到2018年10月至浙江省诸暨市人民医院接受治疗的108例肺癌合并肝硬化患者为研究对象,通过观察两组临床疗效、肝功能指标、淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio,LMR)以及发生不良事件情况的差异,以了解参麦注射液对肺癌合并肝硬化患者白蛋白(albumin,ALB)、前白蛋白(prealbumin,PAB)及LMR的影响。
1 资料与方法
1.1 一般资料 选择2017年4月到2018年10月至诸暨市人民医院接受治疗的108例肺癌合并肝硬化患者为观察对象,采用随机数字表法将其分为对照组(54例)和联合治疗组(54例)。两组患者性别、年龄、肺癌TNM分期及病理分型等基础资料比较,差异无统计学意义(P>0.05),见表1。患者均签署知情同意书,且本研究已通过医院伦理委员会的审核。

表1 两组患者基础资料比较 例
纳入标准:(1)符合NSCLC的诊断标准[7];(2)根据国际抗癌联盟TNM分期进行分期,属于ⅢB期、Ⅳ期者[8-9];(3)肿瘤最长径≥20 mm者;(4)符合肝硬化的诊断标准[10]。
排除标准:(1)易过敏体质者;(2)心、脑、肾等脏器有严重疾病者;(3)患有精神疾患不能配合治疗者。
1.2 方法 对照组采取GP化疗方案治疗:静脉滴注吉西他滨(江苏豪森药业股份有限公司,国药准字H20030104)1 250 mg/m2,d1与d8;静脉滴注顺铂(江苏豪森药业股份有限公司,国药准字H20040813)75 mg/m2,d1~d3。以及常规护肝对症支持治疗。1个疗程为21 d,连续治疗3个疗程。
联合治疗组采取参麦注射液(正大青春宝药业有限公司,国药准字Z33020018)联合GP化疗方案治疗,即在对照组基础上给予静脉滴注参麦注射液100 mL,d1~d7。连续治疗3个疗程。
1.3 观察指标 (1)临床疗效:根据实体瘤治疗疗效评价标准(response evaluation criteria in solid tumors,RECIST)[11]评价临床疗效,完全缓解为治疗后肿瘤较前完全消失;部分缓解为治疗后肿瘤最长径较治疗前缩小≥30%;稳定为治疗后肿瘤最长径较治疗前缩小<30%且较前增大<20%;疾病进展为治疗后肿瘤最长径较治疗前增大≥20%。(2)肝功能指标:在治疗前及3疗程结束后,抽取两组患者空腹时静脉血,经离心后取血清用生化分析仪检测两组患者肝功能指标,包括ALB和PAB。(3)LMR:在治疗前及3疗程结束后,抽取两组患者空腹时外周血用全自动三分类血液细胞分析仪进行LMR细胞学检测。(4)不良反应事件:观察治疗过程中两组患者恶心呕吐、口腔炎、周围神经炎、贫血、血小板减少、白细胞减少等发生情况。

2 结果
2.1 两组临床疗效比较 经治疗,联合治疗组临床疗效优于对照组,差异有统计学意义(Z=-2.012,P=0.044),且联合治疗组有效率为85.18%,优于对照组的有效率77.77%。见表2。
2.2 两组肝功能及LMR指标比较 治疗前两组肝功能指标ALB、PAB比较,差异无统计学意义(P>0.05)。3个疗程结束后,联合治疗组ALB、PAB均优于对照组,差异有统计学意义(P<0.05)。治疗前两组LMR比较差异无统计学意义(P>0.05)。治疗结束后,联合治疗组LMR水平高于对照组,差异有统计学意义(P<0.05)。见表3。

表2 两组临床疗效比较 例(%)
2.3 两组发生不良事件情况比较 治疗过程中,联合治疗组不良事件发生率均低于对照组,差异有统计学意义(P均<0.05),见表4。
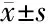

项目ALB(g/L)PAB(mg/L)LMR治疗前治疗后治疗前治疗后治疗前治疗后联合治疗组18.08±3.0028.54±2.25186.07±24.42244.22±14.773.53±0.254.04±0.20对照组17.52±3.1922.49±1.80178.44±21.64201.21±17.273.50±0.233.79±0.17t值0.94215.4461.71813.9080.7817.381P值0.3480.0000.0890.0000.4370.000

表4 两组发生不良事件情况比较 例(%)
3 讨论
肺癌,因其乃有形之物,可属中医“肺积”范畴。《难经》云“肺之积,名曰息贲,在右胁下如覆杯,气逆背痛,久则喘咳”,这与现代医学肺癌临床表现咳嗽、气促、胸痛、发热、血痰大致相同。李中梓在《医宗必读》中指出“积之成也,正气不足,而后邪气踞之”,说明肺癌病因病机在于人体正气不足,又因外感六淫、食伤、邪毒侵袭以及先天禀赋不足等导致脏腑功能失调,肺之宣降失常,从而导致气血壅滞,津失输布,积聚成痰,痰作为病理产物同时,亦可作为致病因素,痰凝气滞,使得气血进一步瘀滞,最后气、血、痰、瘀互相胶着,日久则成肺积。故肺积总属于本虚标实,孙旭等[12]总结文献发现中晚期NSCLC化疗前后辨证以气虚、阴虚为主。关于肝硬化,现代医家认为肝硬化仍属本虚标实之证,由肝、脾、肾三脏受损或功能失调,气滞、血瘀、水停腹中所致。二者皆为虚实夹杂之征,中医治疗不离益气养阴之法。
参麦注射液由人参、麦冬二味组成,即《千金要方》中生脉散去五味子。方中人参性味甘平,可益气复脉,生津止渴;麦冬性味干旱,可养阴润肺、清心除烦、益胃生津。两药合用,一补一清,共奏益气养阴之效。现代研究证明参麦注射液有抗肿瘤、调节免疫功能作用[13-14]。张喜平等[15]通过5种复方中药注射液与粒细胞集落刺激因子治疗化疗所致白细胞减少症小鼠的疗效以及对小鼠多脏器和胸腺的影响的实验,证实了参麦注射液能治疗化疗所致白细胞减少症,具有一定升血小板作用,以及有一定护肝作用。综上,肺癌合并肝硬化正属该药应用范围之内。
本研究得到联合治疗组临床疗效有效率85.18%优于对照组有效率77.77%的结果,这与徐泳等[5]研究分析所得参麦注射液联合化疗可提高近期疗效结果一致。现代药理研究证实人参具有抑制肿瘤生长、促进肿瘤细胞凋亡以及调节免疫作用,其中皂苷Rh2通过多种途径诱导肿瘤细胞凋亡对多种癌症有抑制作用[16]。而麦冬中多糖成分可以提高NK细胞活性,发挥抗肿瘤、抗炎作用,亦有免疫调节作用,增强机体免疫能力[17],从而提高了患者对化疗药物的耐受性。曹科峰等[18]通过实验证实麦冬多糖可以减轻对肝细胞的损害,其护肝机制可能与抗氧化通路有关。本研究亦证实参麦注射液一定程度上可以改善肝功能。
目前已明确多种肿瘤的发生及发展有炎症参与,而淋巴细胞参与细胞及体液免疫的各个环节,在炎症中也具有重要作用。有研究[19]表明低淋巴计数是肿瘤患者预后不良的独立影响因素,即低淋巴计数提示肿瘤患者预后不良;同时[20]通过共同培养单核细胞与恶性T细胞的实验发现单核细胞有促进肿瘤进展的作用,即高单核细胞计数可以提示肿瘤患者预后不良。黄金兰等[21]对 LMR与胶质母细胞瘤患者预后评估的相关性分析中得出LMR值越高提示患者预后预后越好,反之则越差。本研究也得到联合治疗组LMR高于对照组(P<0.05)的结果,说明参麦注射液可以改善该类患者预后。
综上所述,参麦注射液联合化疗可提高肺癌合并肝硬化患者化疗的临床疗效,降低不良事件的发生率,有效改善患者预后,减轻患者肝功能损害,降低化疗不良反应发生率,值得临床应用与推广。

