动物类脂肪酸脱氢酶研究进展
吴 敏,孙敬蒙,张炜煜*
(1.长春中医药大学,长春 130117;2.吉林大学第一医院,长春 130021)
PUFAs具有较高药用价值,其生理功能可作用于心血管系统疾病、促进细胞生长、抗炎、抗癌、免疫调解等作用;缺乏不饱和脂肪酸,会引起生长发育迟缓,血小板减少,加速衰老,不能供储能量等症状[1]。其中二十碳五烯酸(20:5 n-3,EPA)和二十二碳六烯酸(22:6 n-3,DHA)及二十碳四烯酸(花生四烯酸,20:4 n-6,AA)并不能被动物自身合成,只有动物在外界环境的刺激或食物摄取获得。最近研究发现,一些动物在外界低温环境的刺激下,能通过动物体内存在的FADs将外源性摄入的亚油酸(Linoleic acid,LA),和亚麻酸(α-linolenic acid,ALA)转化成EPA、DHA、AA,来满足自身的需要[2];FADs能催化与载体结合的饱和或不饱和脂肪酸在脂酰链上形成双键,例如△6-脂肪酸脱氢酶(△6-FAD)可以在脂肪酸的6号碳上脱氢,形成引入成双键。PUFAs参与了生物膜的构成,对生物膜的形成和物理性质、膜脂中脂肪酸的组成与不饱和度等方面起主要调节作用,恒温动物或变温动物能通过调节细胞膜中脂肪酸的饱和程度来适应外界环境温度的变化,这种适应能力主要是通过FADs对脂肪酸的去饱和催化作用来实现的,主要不饱和脂肪酸类别,见表1。
因此,FADs受到极大关注,特别是近年来FADs在医药领域内、基因工程方面都取得相当进展,成为科学研究的热点之一[3-4]。

表1 主要的不饱和脂肪酸类别
1 PUFAs的研究进展
我国对于脂肪酸脱氢酶的研究相对较晚,但在近几年,发展非常迅速,取得了令人瞩目的成就。根据引入C=C不饱和双键时所具有的链长特异性和位置特异性,FAD有△4、△5、△6、△9、△12和 △15 共6种[5]。
THIEDE M A等[6]首先从鼠肝中分离到△9-FAD的基因组文库(cDNA),并在烟草中得到表达。ARONDEL V等[7]首先从拟南芥中分离到内质网中△15-FAD基因的cDNA,后来陆续在拟南芥叶绿体、大豆质体、油菜微粒体中分离到,蓝细菌、拟南芥、水稻、线虫线粒体中也克隆到△15-FAD基因。随后,霉菌、琉璃苣、线虫、鼠、人等20余种生物中都分离到了该基因,并分别在酿酒酵母、烟草、油菜、马铃薯、曲霉、大豆中获得功能性表达。MICHAETON L V等[8]首次报道了从线虫中分离到△5-FAD基因,并在酵母中进行了功能性表达。
1.1 △6-FAD及其合成PUFAs的途径 近年来,关于△6-FAD研究最多,△6-FAD是在不饱和脂肪酸的第6位和第7位碳原子脱氢,从而引入双键,是多不饱和脂肪酸形成过程中的限速酶[9]。AKI T等[10]从大鼠中克隆了△6-FAD的全长基因,从人体内克隆出△6-FAD的全长基因。吴景等[11]克隆得到镜鲤肝脏中高不饱和脂肪酸(HUFA)合成代谢的△6-FAD基因cDNA全序列。于海彦等[12]以家蚕最新基因组数据库资源为依据,通过生物信息分析方法对家蚕脂肪脱氢酶进行克隆、序列分析,并对家蚕n3-FAD和△6-FAD基因进行了表达模式、原核表达、酿酒酵母表达进行研究。李凯等[13]以武定鸡和大围山微型鸡为研究对象,检测肌肉组织中脂肪酸含量及△6-FAD基因表达量,比较不同鸡种脂肪酸含量及FAD基因表达差异。
△6-FAD合成多不饱和脂肪酸途径是在从油酸(oleic acid,OA)开始,从而进入多不饱和脂肪酸代谢的n-3途径,也可以直接进入n-6途径。此时,2条途径中的LA和α亚麻酸(α-linolenic acid,ALA)必须经△6-FAD的催化分别转化成γ-亚麻酸(γ-1inolenic acid,GLA)和十八碳四烯酸(octadecatetraenoic acid,OTA)。GIA和OTA在其它酶的催化下经过一系列延长和脱氢,可进一步转化成n-3和n-6途径中诸如AA、DHA,见图1。

图1 △6-FAD合成PUFAs的途径
1.2 △9-FAD合成PUFAs的途径 △9-FAD是第一个被发现其cDNA的酶,研究初期相关报道较少,但近年来△9-FAD的研究也较为深入,△9-FAD以C18的脂酰-辅酶A(脂酰-CoA)和脂酰-酰基载体蛋白(脂酰-ACP)为底物,在第9、10位碳原子间引入第一个双键,是目前唯一已知的可溶性脂肪酸脱氢酶。从草鱼体内克隆出△9-FAD,同时发现△9-FAD mRNA 在肝脏和大脑中的表达量最高[14-15]。虱目鱼、鲤鱼和罗非鱼体内均克隆得到了△9-FAD[16-18]。吴永保等[19]利用PCR-SSCP技术检测安卡鸡、文昌鸡和如皋鸡△9-FAD基因的单核苷酸多态性(SNP),并对不同基因型与胸肌脂肪酸含量进行关联分析。HYEKYUNG P C等[20]首次从甲壳动物中华绒螯蟹肝胰腺组织中克隆出△9-FAD,并在中华绒螯蟹各组织内,对该基因的含量进行定量检测,结果表明△9-FAD基因在中华绒螯蟹肝胰腺中表达量最高。PERLING P等[21]证明地中海鳎中存在脂肪酸延长酶和△4-FAD,并发现低温环境会引起△9-FAD基因表达上调,同时细胞膜上的PUFAs会显著增加,来保持膜的流动性以适应冷水环境。这一点已在多种鱼类中得到证明[22]。
△9-FAD合成多不饱和脂肪酸途径是在从多不饱和脂肪酸的代谢从硬脂酸(18:0)开始,必须在△9-脂肪酸脱氢酶的催化下形成OA,进而进入到下一步的氧化过程中,见图2。

图2 △9-FAD合成PUFAs的途径
1.3 △5-FAD及其合成PUFAs的途径 △5-FAD是多不饱和脂肪酸合成途径中的第2个限速酶[23-25],,其合成多不饱和脂肪酸途径是一部分从20:4二十碳四烯酸(花生四烯酸;ARA)开始,必须经过△5-FAD的催化作用,催化生成EPA。另外一部分从20:3γ-次亚麻酸开始,必须经过△5-FAD的催化作用,才能催化生成AHA,见图3。

图3 △5-FAD合成PUFAs的途径
1.4 其他种类脂肪酸脱氢酶 △4-FAD是DHA合成过程的关键酶酶。当硬脂酸(18:0)经过都△5-FAD合成途径催化生成EPA后,必须经过△4-FAD催化最终形成DHA。
△12-FAD、△15-FAD是动物体内没有的2种脂肪酸脱氢酶,△12-FAD又称油酸脱氢酶(oleate desaturases)只存在于植物和微生物中,因为人和哺乳动物细胞中缺乏在脂肪酸的第9位碳原子以上位置引入不饱和双键的脱氢酶[26-28]。其主要作用是在单不饱和脂肪酸油酸的第12和13位碳原子之间插入一个双键,形成含有2个双键的多不饱和脂肪酸-亚油酸。因为它是PUFAs代谢n-3、n-6途径的限速酶,所以控制着植物细胞中大多数不饱和脂肪的合成。同时它也是油酸脱氢形成亚油酸的关键酶。
△15-FAD在植物中一般有2个基因,一个在微粒体中,一个在质体中。ARONDEL V等首先从拟南芥(Arabidopsis)中分离到内质网中△15-FAD基因的cDNA,后来陆续在拟南芥叶绿体、大豆质体、油菜微粒体中,蓝细菌、水稻、线虫线粒体中也克隆到该基因[29-31]。
2 PUFAs的合成途径
在生物体内,动物类PUFAs的合成共有两个途径,其中,一条途径为脂肪酸延长去饱和途径,它是以硬脂酸(18:0)为底物,通过脂肪酸延长酶与脱氢酶作用完成的[32-33]。PUFAs的合成可分为n-6和n-3两种途径,分别由ALA经n-6和n-3途径中的各种脱氢酶和延长酶的催化经过一系列脱氢和延长进一步转化成AA、EPA、DHA。另一条途径为聚酮合酶合成途径,因其不涉及到脂肪酸脱氢酶的催化过程,故本文不进行分析。见图4。
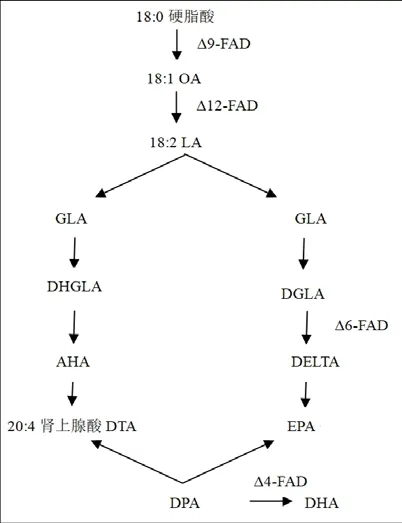
图4 PUFAs的延长去饱和合成途径
3 PUFAs的基因工程
目前主要的几种脂肪酸脱氢酶都已从动物、植物和真菌等不同生物体中克隆到,并在多种微生物、模式植物、油料种子作物和一些动物中获得功能性表达。贾雪琦等[33]针对人类基因组密码子的使用特性对大豆n-3和n-6脂肪酸脱氢酶基因的编码序列进行改造,为得到可以产生多不饱和脂肪酸的转基因动物奠定了一定基础,从而对人体内必需脂肪酸的合成的研究提供了思路。
4 小结
研究表明,越来越多的疾病与不饱和脂肪酸的摄入及代谢的不平衡有关,脂肪酸脱氢酶的研究和应用以及基因的克隆和转化研究越来越受到重视。随着生物技术的发展,尤其是基因工程手段的利用,越来越多的脂肪酸脱氢酶基因被克隆到动植物体内,通过脂肪酸脱氢酶基因的遗传操作来控制生物体中PUFAs的组成,获得功能性脂肪酸成为可能,从而提高人们的生活质量。

