分散液液微萃取-悬浮固化-液相色谱法测定杂粮中的4种农药残留
武文英, 任丽媛, 赵文霏, 陈振家,3, 荆 旭*,3, 王晓闻,3
(1.山西农业大学资源环境学院,山西太谷 030801;2.山西农业大学食品科学与工程学院,山西太谷 030801;3.山西功能食品研究院,山西太谷 030801)
杂粮,俗称小杂粮,泛指除了玉米、水稻、大豆、小麦和薯类等大宗粮食以外的其他小宗粮豆作物的总称。杂粮中含有大量蛋白质、矿物质、维生素等许多对人体有益的物质[1],是人们日常饮食中不可缺少的一部分[2]。三嗪类除草剂是一种含有三嗪环结构的广谱除草剂[3];三唑类杀菌剂是具有独特的1,2,4-三唑环的广谱杀菌剂,残留在杂粮中的三嗪类除草剂和三唑类杀菌剂会给人体带来潜在的健康危害[4]。
为满足食品安全快速检验的要求,迫切需要建立粮食中农药残留的快速检测技术[5]。目前,液相萃取[6]和固相萃取[7]仍是常用的前处理方法。但这些方法不仅耗时,还会消耗大量的有机溶剂。分散液液微萃取作为一种新型的样品前处理方法可以与液相色谱仪、气相色谱仪等多种仪器联用,在食品安全分析方面具有广阔的应用前景[8,9]。然而,分散液液微萃取所用的萃取剂多为卤代烃等毒性较大的溶剂。为避免髙毒试剂的使用,长链醇和碳氢化合物等毒性低且密度较低的萃取溶剂可以应用到分散液液微萃取中,但使用这种溶剂的主要缺点是难以收集[10]。操作简便、绿色环保的悬浮固化新型分离技术,利用长链醇等溶剂熔点低的特点,萃取完成后悬浮于溶液表面的萃取剂经冰浴后固化,将其取出在室温下融化后即可直接进样分析[11]。该方法集萃取和浓缩于一体,萃取时间短、操作简单、无需净化、溶剂毒性低、富集倍数高、重现性好、准确度高,适合较复杂基质样品的萃取,在痕量分析领域具有广泛的应用前景[12]。
本文拟将液液微萃取与悬浮固化技术相结合,建立一种新型的固体样品前处理方法。以十二醇作为萃取剂,乙腈作为分散剂,结合水相形成三元混合体系,萃取富集杂粮中的三嗪类除草剂(西玛津和莠去津)和三唑类杀菌剂(腈菌唑和氟环唑),采用高效液相色谱-二极管阵列检测(HPLC-DAD)法测定。通过优化萃取和色谱检测条件,建立一种高效快速的测定荞麦、燕麦、藜麦和小米等杂粮中农药残留的分析方法。
1 实验部分
1.1 仪器与试剂
安捷伦1260高效液相色谱仪购买自美国安捷伦科技有限公司;SB5200超声波清洗器购买自上海必能信超声有限公司。
西玛津(纯度95%)、莠去津(纯度99%)、腈菌唑(纯度96%)、氟环唑(纯度99%)来自农业部农药检定所;十一醇和十二醇购自山东西亚化学股份有限公司;色谱纯乙腈和甲醇购自天津市四友精细化学品有限公司;分析纯NaCl购自天津市北辰方正试剂厂。超纯水由Milli-Q超纯水净化系统制得。
荞麦、燕麦、藜麦和小米来自于山西农业大学。
1.2 色谱条件
色谱柱为Agilent Eclipse Plus C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇-水(80∶20,V/V),流速为0.5 mL/min,柱温为20 ℃,进样量为20 μL,检测波长为220 nm。图1是荞麦、燕麦、藜麦和小米的加标样品色谱图,西玛津、莠去津、腈菌唑、氟环唑的保留时间分别为6.9、7.8、9.3和10.8 min。
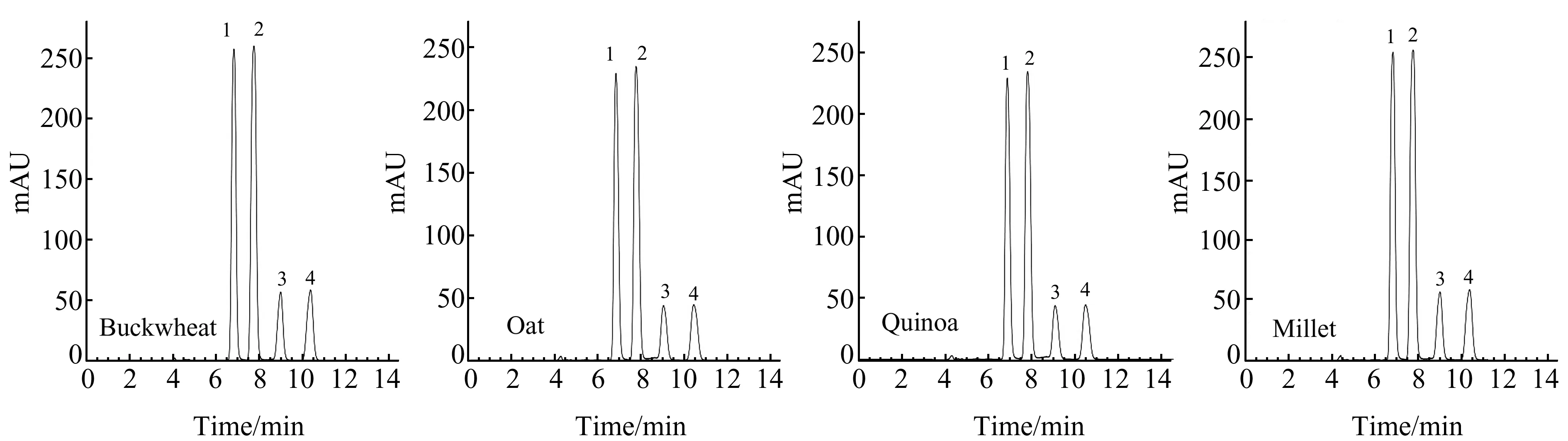
图1 荞麦、燕麦、藜麦和小米的加标样品色谱图Fig.1 Chromatograms of spiked samples1.simazine;2.atrazine;3.myclobutanil;4.epoxiconazole.
1.3 分散液液微萃取-悬浮固化操作过程
称量1 g粉碎后的杂粮样品于10 mL离心管中,加入1.5 mL乙腈,超声3 min。另取一支10 mL离心管,加入5 mL超纯水和150 mg NaCl,移取150 μL十二醇(萃取剂)和1 mL上述乙腈溶液(分散剂)的混合液,快速注入超纯水中,即得到十二醇/乙腈/水的三元浑浊体系。将离心管在3 000 r/min的转速下离心3 min,进行冰浴,待溶液上层的十二醇凝固后,将十二醇白色固体取出放入自动进样瓶中,在室温下快速融化,进高效液色谱仪检测。
2 结果与讨论
2.1 萃取条件的优化
2.1.1 萃取剂的选择在悬浮固化分散液液微萃取过程中,萃取剂性质是影响萃取效率的重要因素之一。在选择萃取剂时,萃取剂要具有凝固点高、对目标分析物很好的萃取能力和易于与样品溶液分离的能力[13]。基于上述条件,选择十一醇和十二醇作为萃取剂进行优化,结果如图2所示。选用十二醇的萃取效果显著优于十一醇,萃取率为十一醇的1.5倍。此外,由于十二醇的凝固点比十一醇的高,在冰浴时能更快速地完成凝固,有利于缩短前处理的时间。凝固的十二醇在常温下比十一醇更不容易融化,利于分离操作,并能减小实验误差。因此,本实验选择十二醇作为萃取剂。
2.1.2 萃取剂体积的影响萃取剂使用量是影响萃取效率的重要因素[14],萃取剂用量过少会降低萃取效率,萃取剂用量过多,会导致富集倍数降低。实验考察了十二醇体积分别为25、50、75、100和150 μL时对萃取效率的影响。结果如图3所示,随着萃取剂用量的增加,萃取效率逐渐提高。当十二醇的体积为150 μL时,萃取率在83.05%~84.14%之间,并且相对标准偏差较低。综合考虑到萃取效果和方法的重现性,因此,本实验选择使用150 μL作为萃取剂的体积。
2.1.3 盐用量的影响盐的用量通常会对分散液液微萃取的萃取效率产生重要影响[15],加盐可以增大溶液的离子强度,减少目标分析物在水相中的溶解度,从而增加其在有机相的分配,导致萃取效率升高;但过多的盐会提高水溶液的粘度,可能会导致目标分析物向萃取剂中的传质系数降低,从而降低萃取效率。本实验考察了NaCl用量分别为0、10、50、100、150、200和250 mg时对萃取效率的影响。结果如图4所示,当NaCl的用量在0 mg到150 mg时,随着盐用量的增加,萃取效率逐渐提高,当NaCl用量为150 mg时,萃取率为81.05%~92.49%。当NaCl用量继续增大,萃取率逐渐降低,可能是由于盐改变了目标分析物的能斯特扩散膜的物理性质,从而影响了目标分析物向萃取剂中的扩散。因此,本实验选择150 mg作为NaCl的用量。
2.1.4 超声时间的影响为了保证本方法的准确度和精密度,须确保4种农药在乙腈和杂粮样品之间达到分配平衡。超声能够使目标分析物与乙腈之间的能量传递效率加快[16],在短时间内使农药与乙腈充分接触。本实验考察了超声时间分别为0、0.5、1、2、3和5 min时对萃取效率的影响。结果如图5所示,随着超声时间的增加,萃取率逐渐提高,2 min以后的萃取率保持稳定。在3 min时,萃取率为83.63%~96.05%,相对标准偏差较小。因此,本实验选择3 min作为超声时间。
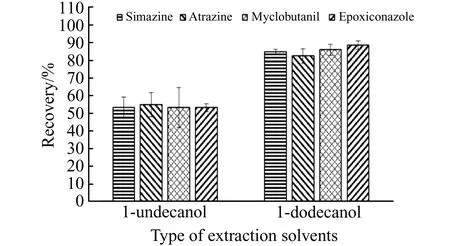
图2 萃取剂种类对萃取效率的影响Fig.2 Effect of the type of extraction solvents on extraction efficiency
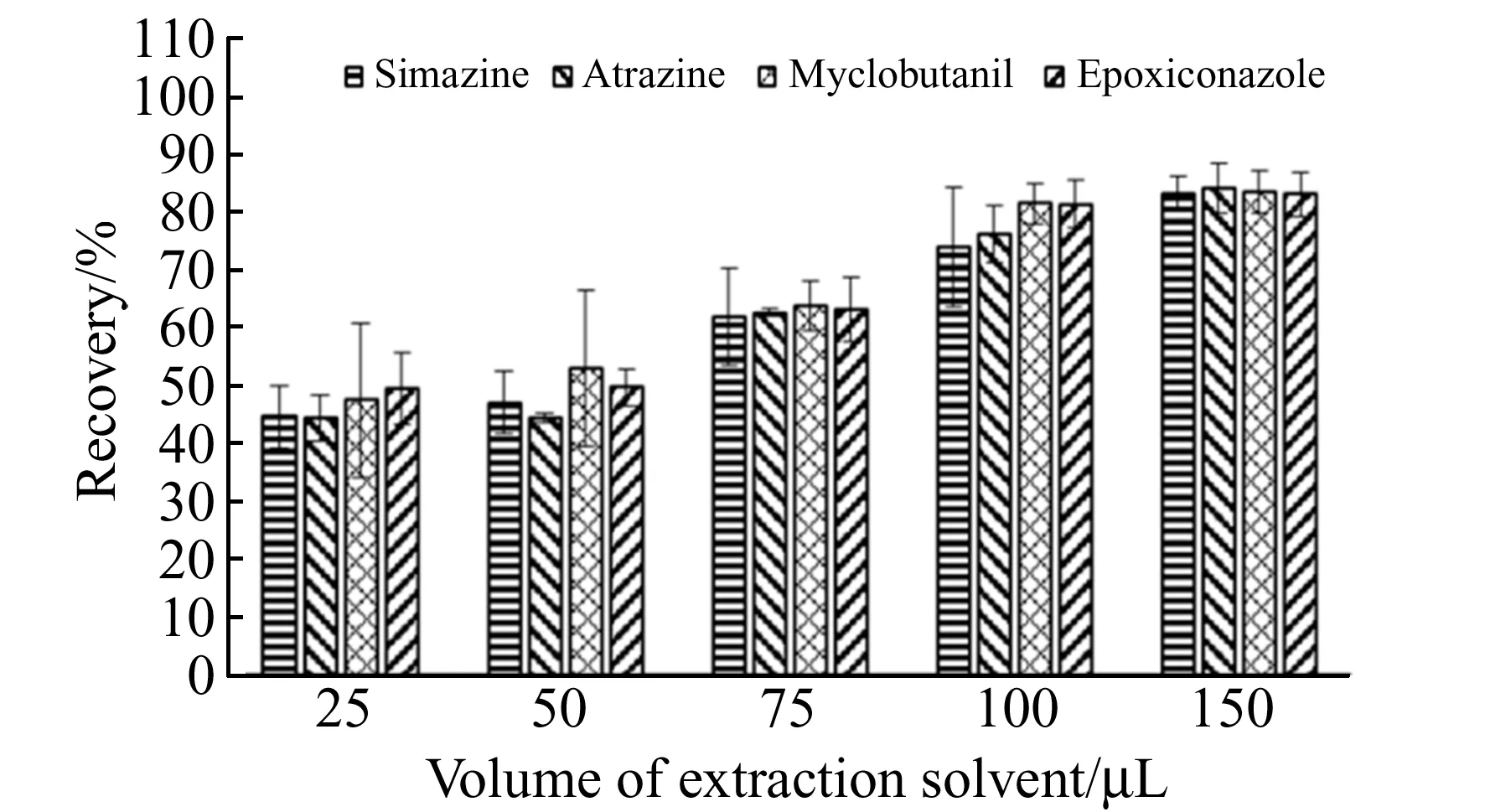
图3 萃取剂体积对萃取效率的影响Fig.3 Effect of extractant volume on extraction efficiency
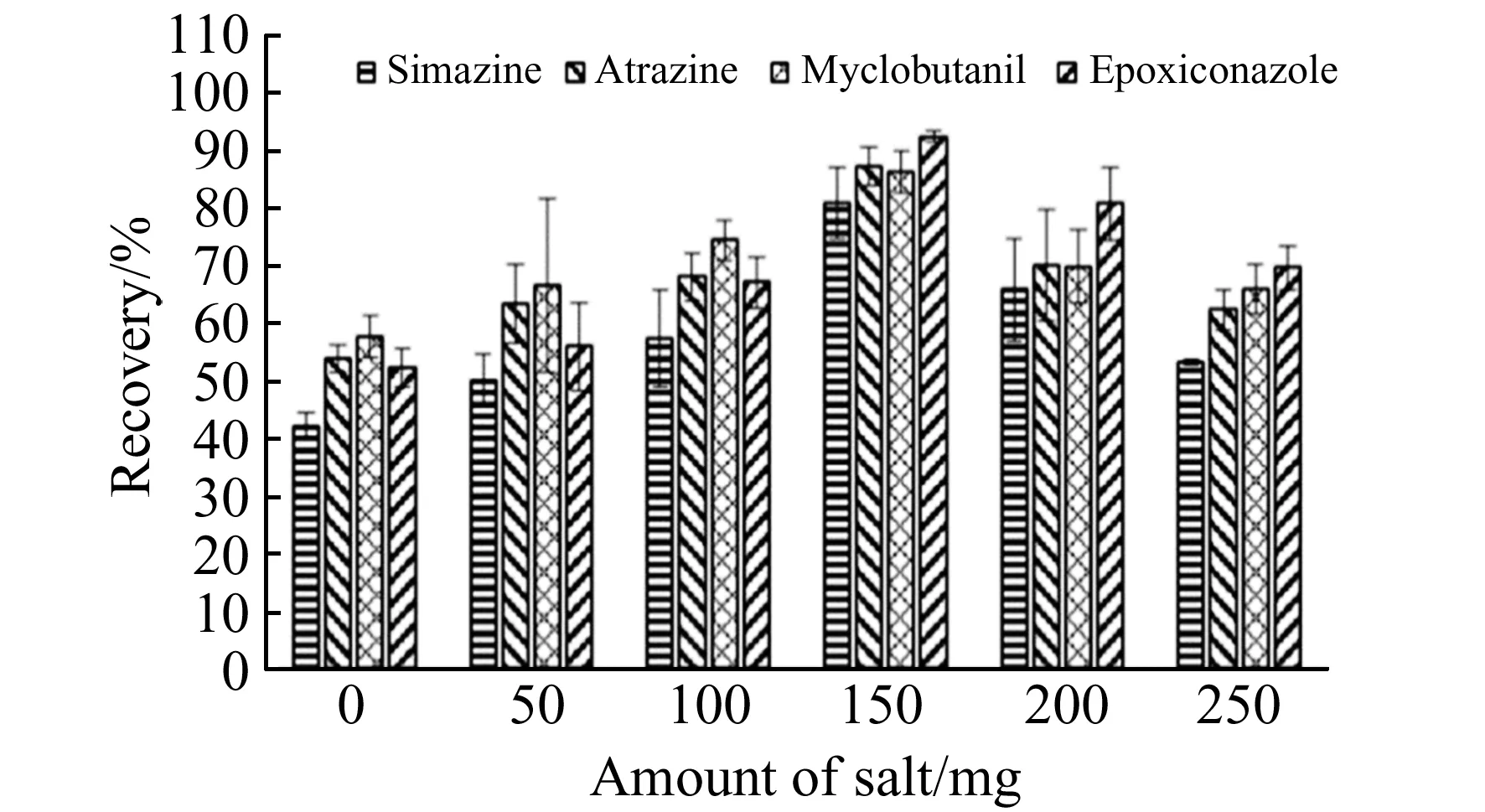
图4 盐用量对萃取效率的影响Fig.4 Effect of salt amount on extraction effieiency
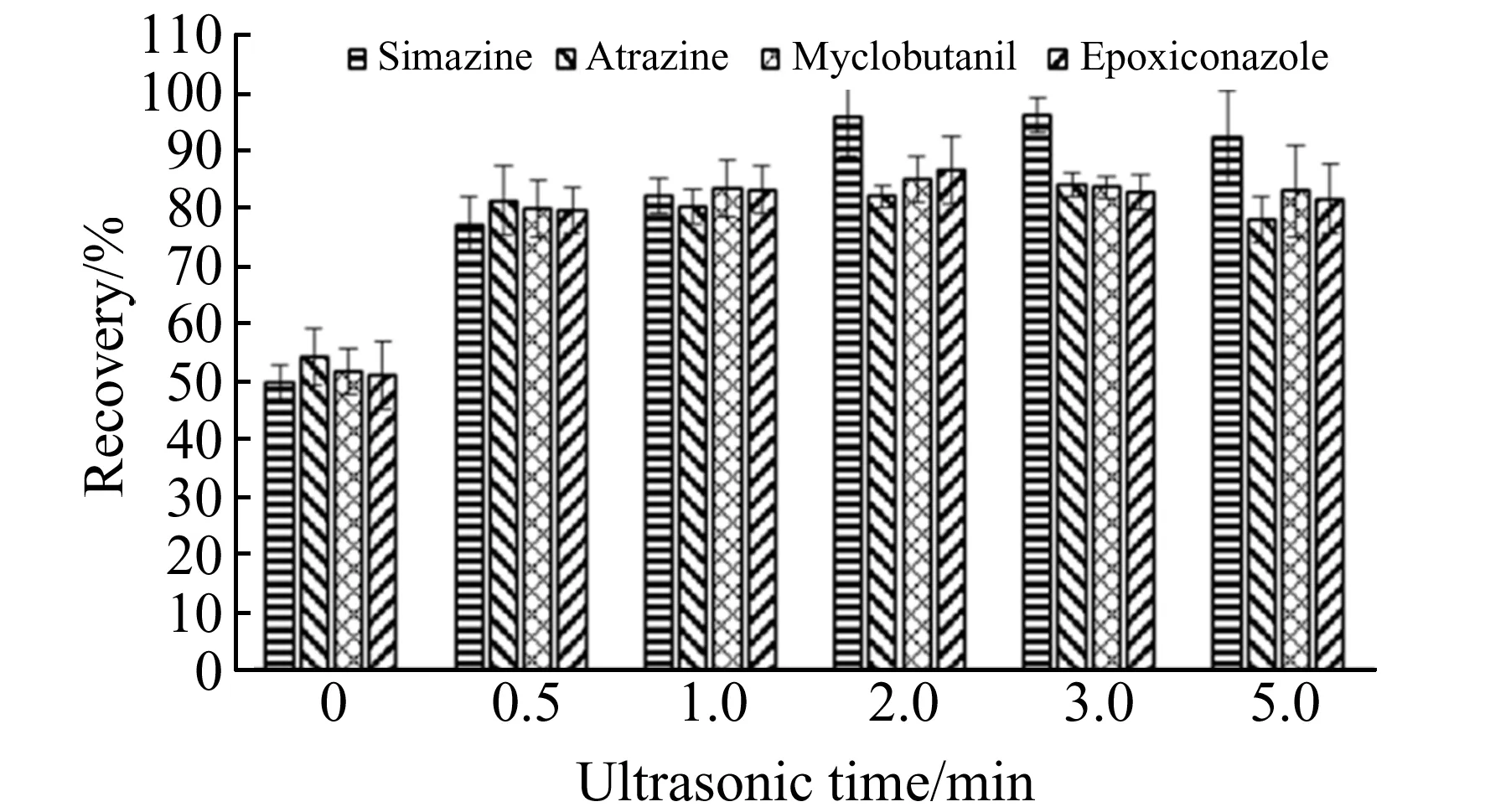
图5 超声时间对萃取效率的影响Fig.5 Effect of ultrasonic time on extraction efficiency
2.2 方法评价
在优化后的提取条件下,对所建立方法的线性、检出限及定量限进行了评估。以标准溶液浓度为横轴,相应的目标分析物的平均峰面积为纵轴,绘制标准曲线。本实验在添加浓度为50~5 000 μg/kg的范围内进行测定,得到了4种农药在不同杂粮样品中的线性方程和相关系数,实验结果如表1所示。4种农药在50~5 000 μg/kg范围内线性关系良好,相关系数均大于0.99。检出限按信噪比(S/N)=3计算,定量限按信噪比(S/N)=10计算,4种农药在杂粮中的定量限为2.62~24.45 μg/kg,检出限为0.79~7.41 μg/kg。
2.3 方法回收率与精密度
在优化后的提取条件下,将所建立的方法用于荞麦、燕麦、藜麦和小米中的农药残留分析,结果表明这4种农药在杂粮样本均未检出。为评价方法的准确度和适用性,设置添加浓度为50 μg/kg和500 μg/kg,平行测定3次,计算其平均回收率。由表2可知,西玛津在荞麦、燕麦、藜麦和小米中的回收率为71.86%~97.55%;莠去津在荞麦、燕麦、藜麦和小米中的回收率为71.69%~96.16%;腈菌唑在荞麦、燕麦、藜麦和小米中的回收率为74.40%~92.85%;氟环唑在荞麦、燕麦、藜麦和小米中的回收率为74.28%~96.44%,表明该方法具有良好的准确度和适用性。4种农药的相对标准偏差均在1.02%到6.78%之间,表明该方法具有良好的精密度。

表1 方法的线性回归方程、相关系数、检出限及定量限
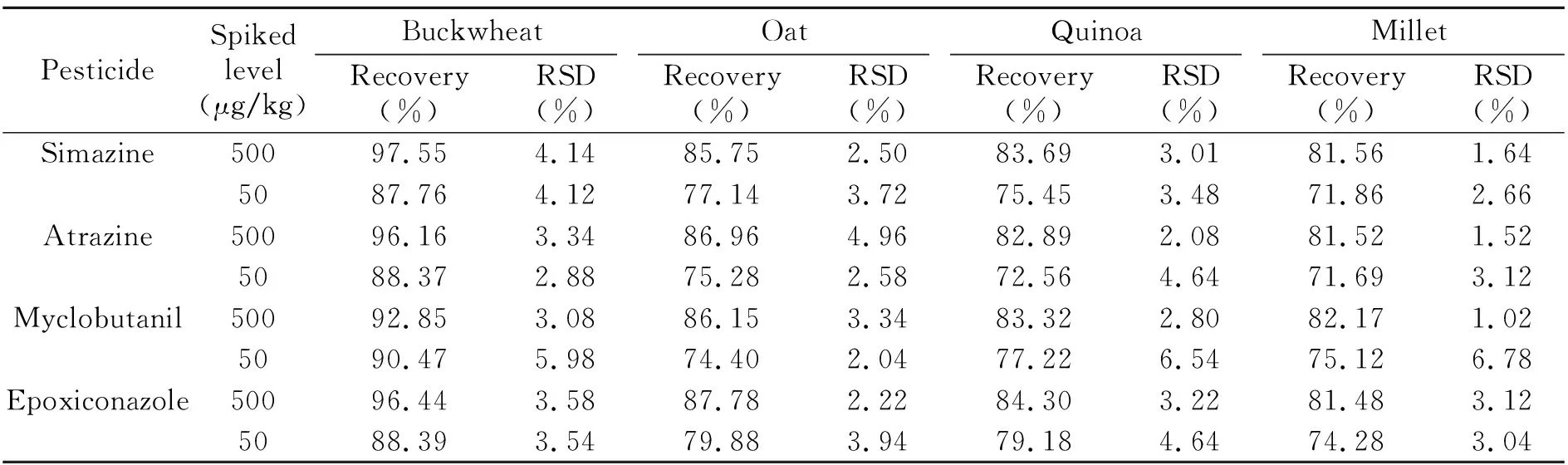
表2 杂粮样品的回收率和相对标准偏差
3 结论
本研究基于分散液液微萃取-悬浮固化-液相色谱,建立了杂粮中4种农药的分析方法。采用绿色的十二醇作为萃取剂,乙腈作为分散剂,经过萃取和富集,冰浴固化收集萃取剂,高效液相色谱进行定量分析。本实验对萃取剂种类、萃取剂体积、盐用量、超声时间等影响因素进行了优化。本方法已成功用于检测荞麦、燕麦、藜麦和小米等杂粮样品中的农药残留分析,具有良好的线性关系、准确度、精密度和适用性。本研究为杂粮中农药残留的检测提供了一种高效、便捷的前处理方法,具有较强的实用价值。

